酿酒酵母异丁醇合成途径调控的研究进展
成婷 苑帅 张晓元 林良才 李欣 张翠英
(1.工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室 省部共建食品营养与安全国家重点实验室 天津科技大学生物工程学院,天津 300457;2.山东省药学科学院,济南 250101)
酿酒酵母(Saccharomyces cerevisiae)是一种重要的真核模式微生物,属于一般公认安全的工业微生物,具有许多生理和代谢优势:(1)可以耐受低pH值,从而降低了被污染的风险;(2)允许长期、重复、连续发酵;(3)抗逆性强,具有单倍体和二倍体的生命形态,能适应发酵过程中的恶劣条件,菌株活力好[1]。这些优势使酿酒酵母可以用于异丁醇的微生物合成。随着对酿酒酵母基因组测序的完成和对其生理代谢及调控的广泛研究,酿酒酵母逐步成为生产各种高级醇的微生物细胞工厂之一。
异丁醇是一种支链高级醇,与生物乙醇相比,具有更高的能量密度和辛烷值,这使异丁醇在作为火花点火式发动机和轻型发动机的燃料上有很好的前景[2]。并且异丁醇具有较低的腐蚀性和吸湿性,能与现有管道基础设施中较好地适配。此外异丁醇还可以用作涂料树脂的原料、除冰液、抛光添加剂等[3]。随着化石燃料造成的环境恶化和石油价格上涨,许多研究者尝试利用代谢工程及合成生物学手段改造酿酒酵母生产新一代可持续的生物燃料和化学品,以降低现代工业对化石燃料的依赖并减少温室气体的排放[4]。相对其他微生物细胞工厂,酿酒酵母具有性状遗传稳定、安全性高、对各种环境压力耐受性高、可进行高密度发酵等优点。
天然酿酒酵母自身具有成熟的异丁醇合成途径,但只产生微量的异丁醇[5]。在酿酒酵母中,根据2-酮异戊酸酯(KIV)的来源不同,将异丁醇合成途径分为从头合成途径(Harris)和分解代谢途径(Enrlich)[6-7],如图1所示。在分解代谢途径(位于细胞质)中,以缬氨酸为底物合成异丁醇过程分为三步:首先,缬氨酸在支链氨基酸转氨酶Bat2p催化下转氨生成2-酮异戊酸酯;然后2-酮异戊酸酯在酮酸脱羧酶催化下脱羧生成异丁醛;最后,异丁醛在醇醛脱氢酶催化下生成异丁醇[8],同时伴随NADH作为氧化还原辅因子被氧化为NAD+。在从头合成途径(位于线粒体)中,由葡萄糖经糖酵解途径生成的两个丙酮酸分子在乙酰乳酸合酶Ilv2p催化下形成2-乙酰乳酸(ALAC);2-乙酰乳酸在乙酰羟基酸还原异构酶Ilv5p催化下异构为2,3-二羟基异戊酸酯(DIV),同时NADPH作为氧化还原辅因子被氧化为NADP+;2,3-二羟基异戊酸酯在二羟基脱水酶Ilv3p催化下脱水生成2-酮异戊酸酯;线粒体中的2-酮异戊酸酯可以在支链氨基酸转氨酶Bat1p催化下转化为缬氨酸运输到胞质中,也可以直接运输到胞质中以合成异丁醇[9]。
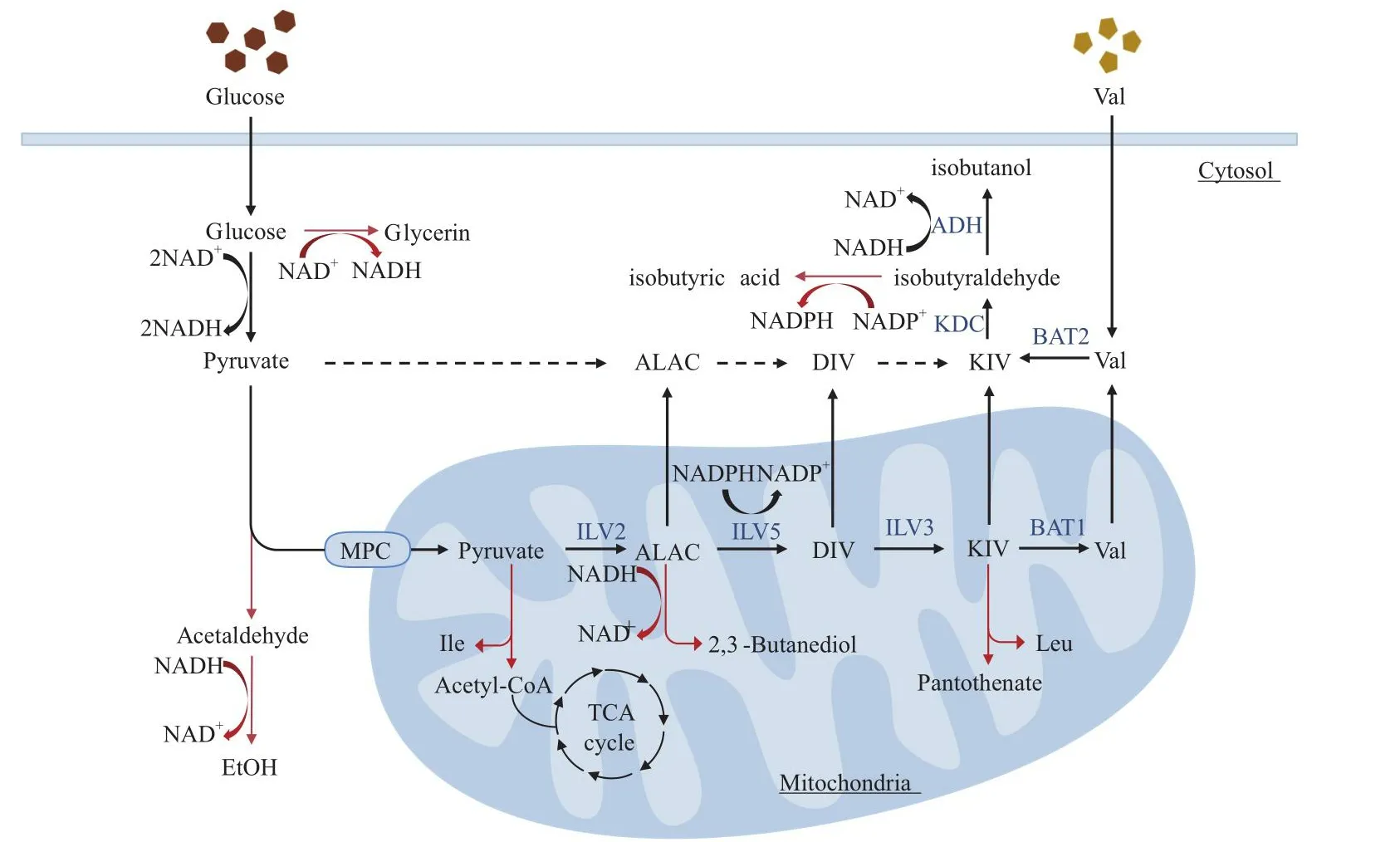
图1 酿酒酵母中异丁醇合成及竞争途径Fig.1 Isobutanol synthesis and competitive pathway in S.cerevisiae
近年来,代谢工程改造酿酒酵母使其高产异丁醇成为研究热点。随着合成生物学的飞速发展,研究者在理性改造酿酒酵母细胞、定向调控异丁醇生产上做了许多努力。本文综述了在近年研究中应用于促进酿酒酵母合成异丁醇的代谢工程策略。在酿酒酵母中乙醇仍然是发酵的主产物,异丁醇的最大产量仅为2.60 g/L,远低于理论最高产量[10-12]。因此,本文不仅详细介绍了目前酿酒酵母生产异丁醇的代谢工程策略,而且对酿酒酵母高产异丁醇过程中存在的瓶颈及有效对策进行了探讨,期望未来将会有更多成功的异丁醇生产实例。同时,酿酒酵母是饮料酒酿造过程中的主要微生物,是白酒主要风味物质高级醇(异丁醇、正丙醇、异戊醇和β-苯乙醇)的生产者。饮料酒中高级醇的积累直接影响饮料酒的风味和品质,含量过高会产生令人不愉的异杂味,危害人体健康;过低会使饮料酒味淡薄,口感较差。研究者可以在结合各种代谢策略的基础上深入解析酿酒酵母中异丁醇的合成机制,这有利于科学阐明酿酒酵母高级醇合成代谢机制,为适量产高级醇菌株的定向选育提供理论支撑[13]。
1 增强异丁醇合成途径
在酿酒酵母中,异丁醇的合成途径分为从头合成途径(Harris)和分解代谢途径(Enrlich)。在从头合成途径中,Chen等[14]过表达从头合成途径中的基因ILV2、ILV3、ILV5以及编码细胞质支链氨基酸转氨酶的基因BAT2,促进了异丁醇合成途径中间产物2-酮异戊酸酯的合成,使酿酒酵母的异丁醇产率提高了13倍。Kondo等[15]在酿酒酵母中过表达了α-酮酸脱羧酶(KDC)、醇脱氢酶(ADH)以增强内源性Enrlich途径的活性,并且过表达了线粒体中从头合成途径第一步的编码乙酰乳酸合酶基因ILV2,敲除了一个编码丙酮酸脱羧酶的基因PDC1,来增加丙酮酸流向异丁醇的通量,减少流向乙醇的通量。通过这些基因工程策略及发酵条件的优化使酿酒酵母的异丁醇产量提高了13倍,产率为6.6 mg/g(异丁醇/葡萄糖)。
2 阻断异丁醇竞争途径
在酿酒酵母的异丁醇合成中存在多条竞争途径,如异丁醇合成的前体物2-乙酰乳酸、2-酮异戊酸酯、异丁醛、丙酮酸等可以作为其他物质生物合成的底物,从而分散异丁醇合成的碳流量。因此阻断竞争途径以减少与酿酒酵母异丁醇生物合成竞争的碳流出,对提高酿酒酵母异丁醇的生成量至关重要。
2.1 阻断线粒体中的竞争途径对2-乙酰乳酸、2-酮异戊酸酯和丙酮酸的消耗
异丁醇从头合成途径中间产物2-乙酰乳酸除了可以转化为2,3-二羟基异戊酸酯外,还可以脱羧形成二乙酰基,二乙酰基在丁二醇脱氢酶Bdh1p和Bdh2p催化下生成乙啶,随后氧化为2,3-丁二醇[16-17]。另一中间产物2-酮异戊酸酯是Enrlich途径和从头合成途径都能合成的一种重要的异丁醇前体物质,但也是亮氨酸、异戊醇和泛酸合成途径的底物[18]。亮氨酸合成途径中2-酮异戊酸酯在2-异丙基苹果酸合成酶Leu4p和Leu9p的催化下转化为2-异丙基苹果酸(亮氨酸和异戊醇的初始底物);泛酸合成途径中2-酮异戊酸酯在3-甲基-2-氧丁酸羟甲基转移酶Ecm31p的催化下转化为2-脱氢泛酸(泛酸的初始底物)。Wess等[19]利用CRISPR-Cas9基因编辑系统敲除了基因BDH1和BDH2,阻断了2,3-丁二醇的生物合成,并进一步敲除了基因LEU4和LEU9来阻断亮氨酸和异戊醇的生物合成,异丁醇浓度和产率分别提高了2.5倍和2.3倍;最后通过敲除基因ECM31来阻断泛酸的生物合成,但异丁醇产量并没有明显升高。有趣的是,在Ida等[20]的研究中,单敲除基因ECM31的工程菌株异丁醇产量相比出发菌株提高了1.7倍。Funovics等[10]在工程菌株中选择敲除基因LEU1来阻断亮氨酸和异戊醇的生物合成,异丁醇产量提高了5.4%,原因是敲除该基因既可以减少2-酮异戊酸酯流向亮氨酸,又可以减少Leu1p对Fe-S辅基的利用。
丙酮酸是细胞质中糖酵解途径的终产物和线粒体中三羧酸循环的主要底物,是调控碳代谢的关键节点。同时,丙酮酸也是生物质分解代谢途径和合成代谢途径的交叉点[21]。作为异丁醇从头合成途径中的重要前体,丙酮酸在线粒体中被部分竞争途径消耗,从而影响了酿酒酵母合成异丁醇的能力。线粒体中的丙酮酸和2-酮丁酸(由苏氨酸通过苏氨酸脱氢酶Ilv1p催化生成)是异亮氨酸合成途径的重要底物,在Ilv2p、Ilv5p、Ilv3p的催化下生成异亮氨酸。Lee等[22]敲除基因ILV1后其异丁醇浓度提高了90%,这是由于基因ILV1敲除阻断了异亮氨酸合成途径的第一步,从而增加丙酮酸流入异丁醇合成途径的通量。与此同时,异亮氨酸和异丁醇合成途径在线粒体中由Ilv2p、Ilv5p、Ilv3p催化,敲除基因ILV1阻断异亮氨酸合成途径可以增强Ilv2p、Ilv5p、Ilv3p在异丁醇合成途径的利用率[23]。
2.2 阻断细胞质中的竞争途径对丙酮酸、异丁醛的消耗
丙酮酸除了在线粒体中被消耗外,也会在细胞质中被其他竞争途径消耗。在酿酒酵母中,大部分的丙酮酸会用于细胞结构的合成、乙醇的合成以及线粒体呼吸作用等。线粒体丙酮酸载体(MPC)负责将丙酮酸从细胞质中运输到线粒体,在早期的研究中,Bricker等[21]发现了线粒体内膜蛋白Mpc1p和Mpc2p形成的复合物介导了丙酮酸转运。随着蛋白复合物鉴定技术的发展,Tavoulari等[24]研究发现MPC以异二聚体的形式发挥转运丙酮酸的功能,并且异二聚体Mpc1p/Mpc2p的丙酮酸转运活性和热稳定性均低于异二聚体Mpc1p/Mpc3p。Park等[25]在过表达线粒体中异丁醇生物合成途径的酶之后,又进一步过表达了线粒体丙酮酸载体Mpc1p/Mpc3p,使工程菌株的异丁醇产量提高了1.9倍。在该研究中,过表达Mpc1p/Mpc2p对异丁醇产量的提高效果低于过表达Mpc1p/Mpc3p,这与Tavoulari等的研究结论一致。
当发酵处于厌氧、高葡萄糖浓度条件下时,由于Crabtree效应,丙酮酸生成乙醇成为异丁醇合成途径中最大的竞争途径[26]。在乙醇生成途径中,丙酮酸在酮酸脱羧酶(由基因PDC1/5/6编码)催化下脱羧生成乙醛,乙醛在醇醛脱氢酶(由基因ADH1/2/3/4/5编码)催化下还原为乙醇。Wess等[19]研究发现,同时敲除基因PDC1、PDC5会导致菌株无法生成乙醇和异丁醇,而单独敲除也无法有效减少乙醇的生成。敲除醇醛脱氢酶基因ADH1可以干扰乙醇的形成,使乙醇产量大幅下降83%,但工程菌株中异丁醇的产量并未明显提高,而甘油生成量显著增加。Lane等[11]同样敲除基因ADH1来阻断乙醇对丙酮酸的利用,但获得工程菌株的乙醇、甘油产量并未明显变化,而异丁醇产量提高了13%。两项研究中异丁醇和乙醇变化趋势不同的原因可能是出发菌株不同、发酵方式不同以及氧化还原辅因子平衡的差异。
除了丙酮酸外,异丁醛作为异丁醇的前体物质,在醛脱氢酶(基因ALD6编码)催化作用下会将异丁醛转化为异丁酸[27],从而减少异丁醛向异丁醇转化。Milne等[28]认为在有氧发酵下,异丁醛会被氧化为异丁酸而不是还原为异丁醇。Ida等[20]研究发现,单敲除基因ALD6菌株的异丁醇产量相比野生型菌株提高了2.4倍;Park等[29]研究发现,单敲除基因ALD6菌株的异丁醇产量增加了1.3倍。同样,Lee等[22]在改造后的工程菌株上继续敲除基因ALD6之后异丁醇产量得到了提高。
3 平衡氧化还原辅因子
在酿酒酵母中,异丁醇生物合成途径的糖酵解过程产生两分子的NADH,而线粒体从头合成途径会消耗一分子的NADPH,胞质Enrlich途径会消耗一分子的NADH,这导致在整个异丁醇合成途径中出现一分子NADPH短缺和一分子NADH过剩的不平衡。因此,解决氧化还原辅因子的不平衡是提高酿酒酵母异丁醇产量的关键[30]。在目前的研究中通常都会采用以下两种策略解决该问题。第一种策略是异源表达依赖NADH的酮醛酸还原异构酶KARI,该酶的作用与乙酰羟基酸还原异构酶Ilv5p相似,可以将2-乙酰乳酸催化生成2,3-二羟基异戊酸酯,这样可以消耗过剩的一分子NADH。Gambacorta等[31]采用第一种策略,异源表达大肠杆菌中编码KARI的基因ilvC6E6并将异丁醇途径重新定位在胞质,但工程菌株中异丁醇产量没有得到提高。原因可能是过剩的一分子NADH未能被KARI利用,而是优先在醇醛脱氢酶催化乙醛生成乙醇过程中消耗;而第二种策略是利用向酿酒酵母中引入一个具有转氢作用的分流反应(NADH+NADP+→NADPH+NAD+)将一分子过剩的NADH转换成一分子NADPH[13],理论上看来该策略恰好解决了异丁醇合成途径中一分子NADPH短缺和一分子NADH过剩的不平衡问题。Ida等[20]的研究中利用该策略构建了酿酒酵母工程菌株,使异丁醇的产量达到了(224±5)mg/L,是出发菌株的11倍。
除了异丁醇生物合成途径中存在氧化还原辅因子不平衡的问题外,在异丁醇合成的竞争途径中,许多竞争代谢产物的合成途径也会影响到氧化还辅因子的平衡,如甘油、乙醇、2,3-丁二醇、异丁酸。3-磷酸甘油脱氢酶依赖一分子NADH催化葡萄糖生成甘油(糖异生途径);乙醇生成过程中醇醛脱氢酶会消耗一分子NADH;2,3-丁二醇生成过程中丁二醇脱氢酶催化的两步反应消耗两分子NADH;醛脱氢酶将异丁醛催化为异丁酸,伴随一分子NADH生成。因此阻断异丁醇合成的竞争途径不仅仅是增加中间代谢产物流向异丁醇的通量,同时也应该考虑到阻断竞争途径后对氧化还原辅因子平衡的影响。同样,仅增强异丁醇合成途径也会过度消耗氧化还原辅因子,可能会出现与预期相悖的结果。
4 重建异丁醇合成途径
Enrlich途径发生在细胞质,而从头合成途径部分发生在线粒体,这样的空间隔离阻碍了异丁醇的生成,以往的研究会采用两种不同的方法来打破这种空间隔离。第一种方法是通过在原定位于胞质的基因5'端添加一段编码Cox4p的DNA序列MLS(线粒体靶向序列),从而将Enrlich途径上的酶由细胞质定位至线粒体中;相反,第二种方法是通过去除原定位于线粒体基因上的MLS序列,使其由线粒体定位至胞质中。研究人员利用异丁醇重定位途径工程结合其他代谢策略都显著提高了异丁醇产量和产率,如Tan等[32]利用第一种途径定位方法,表达了靶向线粒体的α-酮酸脱羧酶和醇脱氢酶,工程酵母的异丁醇产量和产率相比野生型分别提高了35%和89%。Park等[33]则采用第二种方法通过敲除ILV2、ILV5、ILV3基因中的线粒体靶向序列MLS将Ilv2p、Ilv5p、Ilv3p蛋白重定位到细胞质中,将异丁醇产量提高到71.8 mg/L。最新一项研究发现,仅重新定位酿酒酵母中的异丁醇合成途径而不进行其他代谢改造,与定位细胞质合成途径的菌株相比,定位线粒体合成途径的菌株可以更有效地提高异丁醇产量[31]。这与Avalos等[34]的研究结果一致,定位线粒体合成途径的菌株其异丁醇产量增加了260%,而定位细胞质合成途径的菌株异丁醇产量仅提高了10%。该研究进一步利用蛋白质组学和代谢组学表明,定位细胞质合成途径的菌株是由于Fe-S簇(Ilv3p酶蛋白的辅基)供应不足导致异丁醇产量不能大幅提高[31]。
在代谢工程改造酿酒酵母合成异丁醇的研究中,研究者一直致力于解除异丁醇合成途径中的瓶颈问题,其中二羟基脱水酶Ilv3p(将2,3-二羟基异戊酸酯催化为2-酮异戊酸酯)的Fe-S辅基是定位细胞质合成途径菌株生产异丁醇的限制瓶颈。辅基Fe-S的初始组装发生在线粒体中。Avalos等[34]和Lee等[35]发现通过额外添加2-酮异戊酸酯可以显著提高异丁醇的产量,这是由于在细胞质中Ilv3p催化2,3-二羟基异戊酸酯生成2-酮异戊酸酯是异丁醇合成的限速步骤,原因可能是辅基Fe-S在线粒体中形成,但需经过一个复杂过程才能运输到细胞质中发挥作用(图2-a)。线粒体中的铁硫簇机制ISC会利用Fe2+和半胱氨酸生成Fe-S簇中间体,通过转运蛋白Atm1p被运输到细胞质中,Fe-S簇中间体在胞质中形成Fe-S簇并在Fe-S簇组装机制CIA作用下发挥作用。在Lee等[22]研究中,敲除了使低铁敏感转录激活因子失效的蛋白Grx3p的编码基因GRX3,并过表达了胞质中Fe-S蛋白成熟所必需的蛋白Cfd1p的编码基因CFD1,使工程菌株的异丁醇浓度相比野生型菌株提高了60%[36-37]。Gambacorta等[31]通过敲除编码Fra2p(转录激活因子Aft1/2p的抑制因子[38])的基因FRA2使异丁醇浓度显著提高(图2-a)。另外,Hammera等[39]研究发现Bat1p失活可以促进异丁醇合成,猜想敲除Bat1p抑制了Atm1p的活性,从而导致辅基Fe-S在线粒体中积累,增强了Ilv3p的活性。因此在结合异丁醇途径工程基础上进一步了解Ilv3p的作用机制对促进酿酒酵母中异丁醇的合成至关重要。
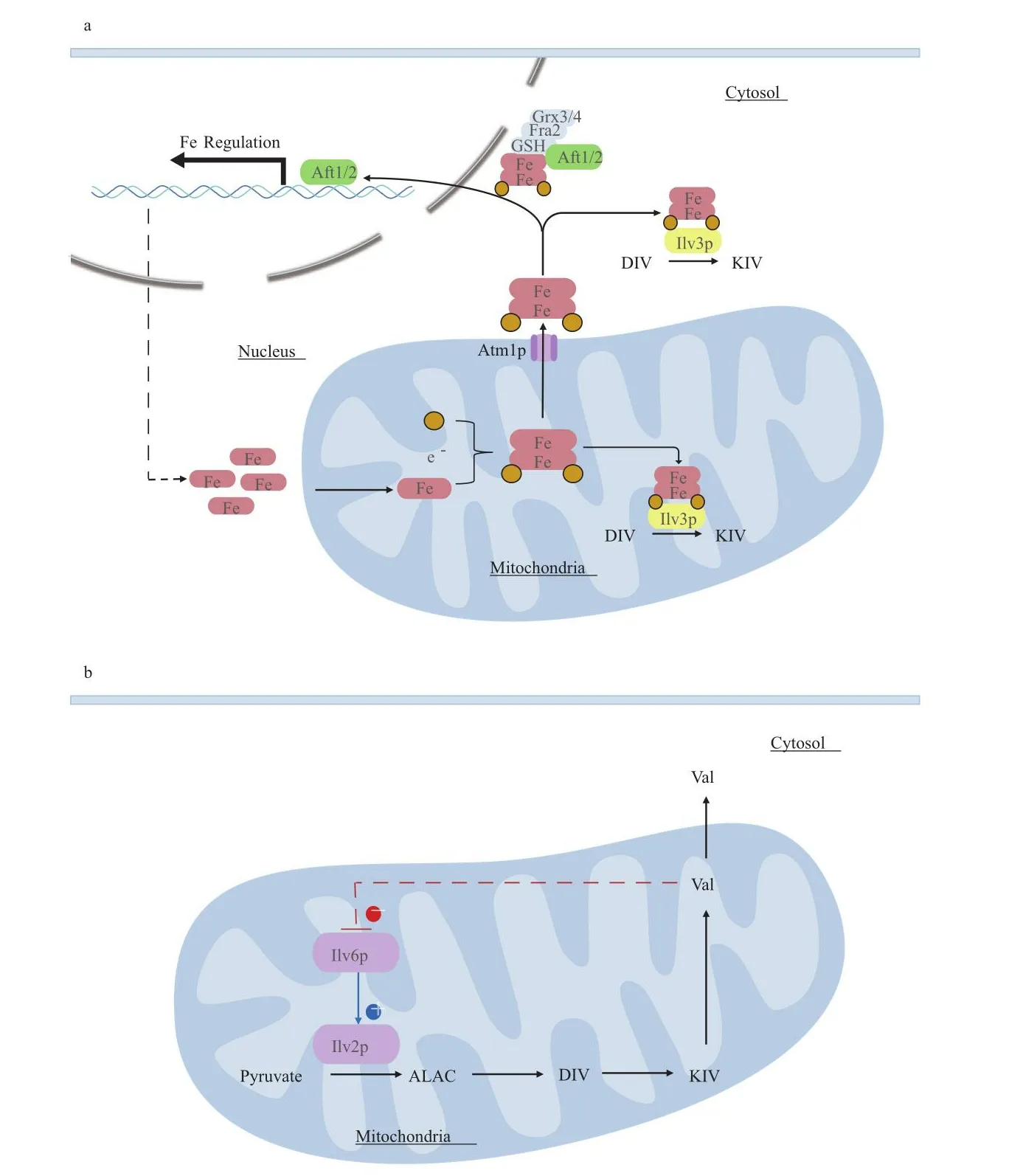
图2 酿酒酵母中异丁醇合成的分子调控机制Fig.2 Molecular regulatory mechanism of isobutanol synthesis in S.cerevisiae
5 异丁醇的调控与转录
传统的代谢调控策略往往只将某个代谢途径基因上调或下调,由于代谢途径的复杂性会导致工程菌株达不到预期效果。因此,对整个代谢途径进行全局调控对构建理想的酿酒酵母细胞工厂至关重要[40]。异丁醇生物合成过程中的关键调控蛋白Ilv6p(图2-b),是乙酰乳酸合酶Ilv2p的调控因子,也是其催化活性的激活剂。当缬氨酸存在时,Ilv6p受到底物反馈抑制,对Ilv2p的激活作用减弱,从而抑制异丁醇的生成[23,41]。Chen等[14]研究中发现,以过表达基因ILV2、ILV3和ILV5的菌株为出发菌株,进一步过表达基因ILV6后该菌株的异丁醇产量相比出发菌株降低了3倍。推测原因可能是过表达基因ILV6增强了Ilv2p对缬氨酸抑制的敏感性,使缬氨酸对Ilv2p的抑制作用大于过表达基因ILV2、ILV3和ILV5对异丁醇的促进作用。Hammer等[39]解除了Ilv6p的缬氨酸反馈抑制,但结果表明其对异丁醇产量的抑制作用并未完全消除。研究推测,改造后的Ilv6p仍具有部分反馈抑制作用或者还存在其他转录激活因子的调节。
转录因子是一类与特定序列结合,保证目的基因以特定强度在特定的时间与空间表达的蛋白质分子。转录因子组成的代谢调控系统具有全局、动态调控靶代谢途径的能力[40]。利用转录调控因子可以构建不同的调控工具,可以用来调控多基因的共表达、优化靶标性能、动态调控代谢通路等。在酿酒酵母中,高级醇的代谢与氨基酸和糖代谢紧密相连。与氨基酸和糖代谢调控相关的转录因子可能会间接调控高级醇的生成。氮代谢中Gat1p 和 Gln3p 为激活因子,在低氮条件下,会激活氮分解代谢抑制NCR敏感基因的表达,增强对支链氨基酸和芳香族氨基酸的利用,将Gat1p的靶基因GAP1敲除后发现酿酒酵母合成异丁醇的能力显著降低[42-43]。氨基酸饥饿响应转录因子Gcn4p在缺乏缬氨酸时会激活基因BAT1、BAT2、ILV2、ILV6和ILV3的转录[44];敲除编码Gcn4p的基因GCN4会影响到细胞生长,过表达则导致糖酵解途径的碳通量下降,而甘油含量上升[45]。而在糖代谢中Nrg1p是葡萄糖抑制基因的转录调控因子,介导一系列应激反应。研究发现该蛋白的编码基因NRG1的等位变异不仅影响了糖代谢,还影响了氮分解代谢抑制(NCR)和基因BAT1的表达,导致菌株吸收的缬氨酸、亮氨酸和异亮氨酸的转氨基率降低[46]。这些转录因子通过调控氨基酸和糖代谢,可能间接调控了酿酒酵母的高级醇生成。转录调控因子作为间接参与高级醇代谢的重要调控元件,在调控酿酒酵母异丁醇合成上应受到重视。对酿酒酵母合成异丁醇过程中转录因子调控机制的研究有利于进一步提高异丁醇产量,将成熟的代谢策略并结合转录因子的理性改造应用到酿酒酵母中,使工程菌株能够定向调控异丁醇的合成。人工转录调控是调节异丁醇代谢通路的有效策略,但直接敲除或过表达转录因子时,应该充分考虑到转录因子调控的靶基因(一个转录因子往往同时调控若干个基因)功能以及转录因子对基因转录的正负调控方向。
6 提高异丁醇耐受性
尽管上文的这些代谢策略显著提高了酿酒酵母合成异丁醇的能力,但利用酿酒酵母工程菌株生产异丁醇尚未实现工业化。在发酵过程中,代谢终产物异丁醇的逐渐积累可能会破坏菌体细胞膜和线粒体的功能、阻碍细胞生长[47]。因此酿酒酵母对异丁醇的低耐受性极大地限制了其合成异丁醇的能力,是实现工业化的主要瓶颈之一[48]。近年来,研究者为了提高酿酒酵母工程菌株生产异丁醇的工业实用性,利用EMS(甲基磺酸乙酯)诱变技术使酿酒酵母能够在异丁醇浓度为16 g/L的培养基中生长,并通过逆向工程试验表明,过表达基因CWP2和SRP4039可以提高酿酒酵母对异丁醇的耐受性[48]。同时Zhang等[47]研究发现,通过改造酿酒酵母的TATA结合蛋白Spt15p可以提高其异丁醇耐受性和产量。Promdonkoy等[4]利用适应性实验室进化(ALE)以及合理的代谢工程策略将异丁醇的浓度提高到了92.9 mg/L。
EMS和ALE技术都能够有效提高酿酒酵母的异丁醇耐受性,但这些诱变技术难以保证酿酒酵母性状的稳定遗传,之后的研究应该进一步通过基因工程改造稳定异丁醇耐受性的遗传[49-50]。然而,酿酒酵母的异丁醇耐受机制是一种复杂的表型,受到多个基因的调控,未来的研究应致力于解析与酿酒酵母异丁醇耐受性有关的调控机制,为酿酒酵母异丁醇的工业化生产奠定理论基础。
7 总结与展望
随着代谢调控策略和合成生物学技术的发展,利用工程酿酒酵母细胞生产新一代生物燃料异丁醇取得了一定的突破(表1)。在天然酿酒酵母细胞中,过表达异丁醇合成途径上的基因以及阻断异丁醇竞争途径,异丁醇产量可得到明显改善。为了进一步提高异丁醇产量,通过改变酶的辅因子依赖性和过表达吡啶核苷酸转氢酶解决代谢过程中氧化还原辅因子不平衡的问题,这在提高酿酒酵母异丁醇合成能力方面起着至关重要的作用。特别地,在酿酒酵母中重构异丁醇合成途径,解除胞质和线粒体的空间隔离阻碍,显著提高了异丁醇产量。转录调控因子作为异丁醇合成过程中的重要元件,对其进行调控不但可以消除一些对异丁醇合成途径上的反馈抑制,还能够动态地调控异丁醇的合成。基于上述一系列策略,工程酿酒酵母的异丁醇合成能力得到进一步提升。但随着异丁醇工业化的发展,高浓度异丁醇积累对酿酒酵母细胞的危害成为一个新的挑战。实验室适应性进化、EMS诱变技术、基因组重测序以及逆向工程试验等方法都有望提高工程酿酒酵母对异丁醇的耐受性。尽管利用这些代谢工程手段构建了生产异丁醇的工程菌株,但是高产异丁醇的瓶颈仍然存在,异丁醇的产量、转化率和产率还有很大的提升空间。
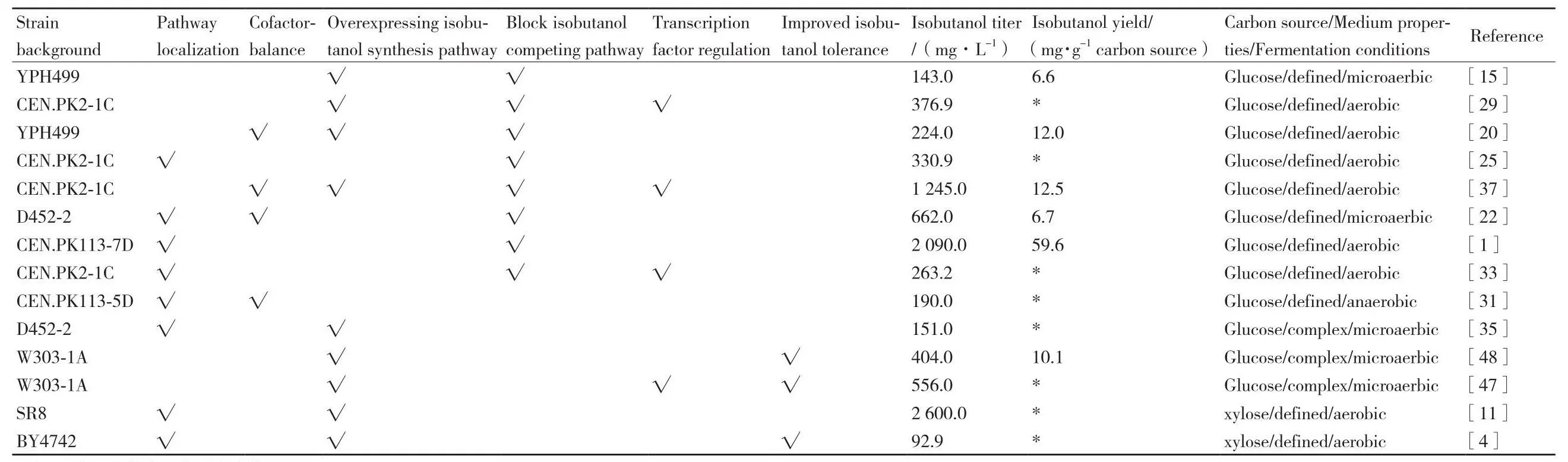
表1 酿酒酵母工程菌株生产异丁醇的代表性实例Table 1 Representative examples of isobutanol production by engineered S.cerevisiae
第一,大部分异丁醇的研究还是以葡萄糖为碳源,无法达到低成本的经济效益和可持续发展的生产目标。由于酿酒酵母具有成熟的异丁醇合成途径,又能够有效利用木质纤维素等生物质[3]。因此,未来的研究可以将酿酒酵母进一步改造,使其可以利用低成本的木糖作为原料合成异丁醇,而不是葡萄糖。Lane等[11]认为木糖的同化与高级醇的合成可能存在协同效应,这为将来木糖生物质转化为高价值生物燃料的研究提供参考。另外,酿酒酵母可以利用氨基酸作为氮源,通过Enrlich途径生产高级醇。因此工程酿酒酵母在利用生物炼制中的废料蛋白质生产生物燃料方面显示出了巨大的潜力。Ha等[51]通过连续高通量发酵,利用酿酒酵母将微藻生物质转化成生物燃料。这种利用废料蛋白质中的氨基酸来合成生物燃料的可持续生产方式,对实现全球氮循环从而最大限度地减少能源需求有重要意义[52]。
第二,由于酿酒酵母是一种复杂的真核生物,其代谢途径上还有许多的机制有待探索,如线粒体中的2-酮异戊酸酯跨膜运输到细胞质是否存在调控机制、Fe-S簇生物合成相关的调控机制尚不清晰等[53]。另一方面,即使基于合理的代谢调控策略对酿酒酵母进行改造,但还是会出现异丁醇产量不变或降低的现象。因此未来研究中对某个基因的功能解析,不应该单单仅基于表型,应进一步结合蛋白组学、代谢组学等整合组学方法进行全局分析,把握代谢改造过程中的全局变化,进一步发现并解决更多的未知瓶颈。
除了代谢改造以外,未来研究还可以尝试在酿酒酵母中将异丁醇与某种物质进行联合生产,通过该物质去降低异丁醇对酿酒酵母的危害,从而增加异丁醇产量[54]。另一有效手段是利用两种微生物协同代谢,克服宿主自身合成异丁醇的缺陷,有可能成为一种新的异丁醇合成策略。有研究发现将酵母与乳酸菌共培养进行协同发酵,两者的相互作用影响了阿魏酸的代谢。即酿酒酵母中阿魏酸的主要代谢产物从4-乙烯基愈创木酚变成二氢阿魏酸[55],该研究表明协同发酵会导致细胞外界条件的变化,从而改变了相关酶的活性。
综上所述,将多种代谢策略创新性组合使用显著提高了工程菌株中异丁醇的产量、转化率和产率,但在异丁醇工业化上仍存在很多瓶颈,并需要进一步探索。此外,这些代谢策略在以酿酒酵母为主的酿造行业上具有潜在的应用价值,通过合理运用这些逐渐成熟的高级醇代谢调控策略可实现对饮料酒中微量风味物质(如异丁醇)的精密调控,提高饮料酒的品质,从而在新时代满足人们对各式各样饮料酒的需求。