红酵母基因组和代谢工程改造研究进展
李雨真 梅天秀 李治文 王淇 李俊 邹岳 赵心清
(1.上海交通大学生命科学技术学院 微生物代谢国家重点实验室 教育部代谢与发育国际科学国际合作联合实验室,上海 200240;2.伽蓝(集团)股份有限公司,上海 200233)
红酵母是一类能产红色素酵母的总称[1-2],不是分类学的定义。红酵母包括锁掷酵母属(Sporidiobolus)、掷孢酵母属(Sporobolomyces)、红酵母属(Rhodotorula)和红冬孢酵母属(Rhodosporidiobolus)等不同属的菌株,其中研究得较深入的是红酵母属,目前其分类还存在一定的争议,有将其归为担子菌门(Basidiomycota)、锈菌纲(Urediniomycetes)、担孢目(Sporidiales)、锁掷酵母科(Sporidiobolaceae)[3],也有归为半知菌亚门(Deuteromycotina)、芽孢纲(Blastomycetes)、隐球酵母目(Cryptococcales)[4]。
特定环境有不同的红酵母分布。根据目前的研究报道,我国淡水水域红酵母主要有3个种,其中深红酵母(R.rubra)是中国淡水红酵母的优势种,黏红酵母(R.glutinis)次之,小红酵母(R.minuta)数量最少[5]。而在世界各大洋和我国黄、渤海沿岸中分离的红酵母主要有4个种,即深红酵母(R.rubra)、黏红酵母(R.glutinis)、小红酵母(R.minuta)和牧草红酵母(R.graminis),还报道从渤海海水中分离到了橙黄红酵母(R.aurantiaca),其中深红酵母是优势菌,数量大大超过其他几种红酵母[6]。
红酵母具有较强的环境适应力,广泛分布于陆地、海洋、江河、湖泊等各种生态环境,因具有生产多种营养物质和生物活性物质的能力而得到广泛研究,是具有很大潜力的工业生产菌株。红酵母在养殖、食品、医药和化妆品等领域也有非常多的应用,是一类重要的酵母菌。近年来对红酵母的研究逐渐深入,在基因组分析和关键酶研究、基因组编辑和遗传工程改造等方面取得了良好进展,对构建高效红酵母细胞工厂具有重要意义。本文对红酵母的应用和研究进展进行了综述,为未来更好利用红酵母进行活性物质生产和应用提供基础。
1 红酵母的用途及其生产的活性物质
1.1 红酵母的用途
红酵母广泛分布于海洋和海产动物体表及肠道内,因其易得、低成本的特点受到水产养殖者的青睐,被广泛选用为鱼、虾、蟹、贝、海参等水产动物幼体浮游期的鲜活诱饵。例如,从不同海产动物肠道中分离得到的红酵母RY4,经分子鉴定与胶红酵母(R.mucilaginous)同源性较高,与其模式菌株ITS和26S rRNA基因序列相似度均超99%,在对虾育苗期间多次添加高剂量或在幼体早期如无节Ⅳ期单次添加高剂量,可有效促进幼体变态与营养不足时的存活[7]。红酵母(Sporidiobolus pararoseus)可作为一种抗生素生长促进剂(AGPs)的替代品加入产蛋鸡的饮食中,有效改善蛋形指数、哈夫单位值(Haugh unit)和蛋黄颜色,减少蛋黄胆固醇含量[8]。小鼠灌胃实验证明,胶红酵母ZTHY2对小鼠免疫功能有增强作用[3]。在罗非鱼日粮中添加海洋源胶红酵母CYJ03,能有效提高罗非鱼的生长性能、提高血清和肝脏的总抗氧化能力(T-AOC)和抗氧化酶活性[9]。以上研究表明,红酵母可作为养殖饲料的添加剂,促进动物的生长发育,助力养殖经济的发展。
此外,红酵母在食品、医药、化妆品、环境治理等方面也有广泛应用。野生胶红酵母糖苷酶对制造媚丽葡萄酒具有良好的增香酿造应用潜力[10]。将胶红酵母和酿酒酵母依次接种,有助于降低发酵速率,增加胶红酵母生长时间,提升糖苷酶的活性[11]。红酵母红素(torularhodin)和多糖对急性肝损伤存在干预作用,为开发功能保健品提供了科学依据和理论支持[12]。酵母产的红色素还能抑制细胞中活性氧的积累,减少转基因果蝇脑中淀粉样乙型蛋白水平和神经变性的面积,在治疗神经退行性疾病方面具有较大潜力[13]。海洋真菌小红酵母(R.minuta)MNP100101A具有抗肿瘤活性,对肿瘤细胞HepG2(肝癌细胞)、PC-12(神经癌细胞)均具有一定细胞毒性,为新药筛选提供基础[14]。
酵母发酵物因含有丰富的活性成分被广泛应用于化妆品中,主要功效有美白、保湿、抗衰老、调理皮肤酸碱度并修复受损皮肤等。近年来,许多化妆品都使用了微生物发酵技术,其添加成分大致分为酵母提取物、酵母溶胞产物提取物、酵母发酵产物提取物和酵母发酵产物溶胞滤液4类,如海洋红酵母面膜以海洋红酵母提取液为主要成分,具有良好的抗衰老、修护、美白保湿功效[15];抗衰老眼霜中含有富番茄红素酵母提取物,具有提升皮肤含水量和弹性、降低经皮水分丢失、减少皱纹、改善皮肤暗黄的长效护肤作用[16]。
在环境治理方面,黏红酵母ARTP-17菌株能利用工业废水为底物进行油脂的生产,在处理废水的同时,还能降低微生物油脂生产的成本,因此在环境生物修复和生物炼制等领域具有重要意义[17]。
1.2 红酵母的活性物质
红酵母富含蛋白质、多糖等常规营养成分,可以生产类胡萝卜素、番茄红素、多不饱和脂肪酸、维生素E和核苷酸等生物活性物质[18],这些活性物质在不同领域有广泛的应用价值。
1.2.1 多肽和酶 酵母中含有丰富的多肽,其氨基酸组成合理,生产条件易于控制,且具有多种活性,如抗菌、抗病毒、降血压、降血脂、抗氧化等,在食品、医药、化妆品等领域都有广泛的应用。
从冰川中分离得到的红酵母(Rhodotorula)菌株至少产两种胞外酶,其中少部分产5种酶(纤维素酶、果胶酶、淀粉酶、脲酶蛋白酶、脂肪酶),绝大部分产纤维素酶和果胶酶,产蛋白酶和脂肪酶的菌株相对较少[19]。从土壤、奶制品、水果中筛选获得了3株高氨氮利用的酵母菌,分别是胶红酵母(R.mucilaginosa)SXAU-002、酿酒酵母(Saccharomyces cerevisiae)SXAU-001和戴尔有孢圆酵母(Torulaspora delbrueckii)SXAU-003。比较3株酵母菌的谷氨酸脱氢酶、谷氨酸合成酶、谷氨酰胺合成酶活性发现,酿酒酵母的酶活性最高,其次是胶红酵母。这两种优良菌株产生的酶应用在饲料中,可满足水产动物对营养物质的需求,是酵母类单细胞蛋白饲料发酵的优良菌株[20]。从胶红酵母中分离并纯化的醛缩酶,也可作为降解次生有毒代谢物棒曲霉素(patulin)的材料,为工业应用提供了理论基础[21]。在胶红酵母BEI29的胞外酶液中检测到了β-D-葡萄糖苷酶、α-L-阿拉伯糖苷酶、α-L-鼠李糖苷酶、β-D-半乳糖苷酶、β-D-木糖苷酶和酯酶,这些酶的添加能显著提升葡萄酒的香气质量,使所酿酒具有较好的果香和花香[22]。红酵母这种产胞外酶的特性可被广泛用于食品、化妆品、制药等领域中,具有广阔的应用前景。
1.2.2 多糖 采用四甲基偶氮唑蓝(MTT)法进行研究发现,胶红酵母胞外多糖组分(R.mucilaginosaexo-polysaccharide 2-A, REPS2-A)能有效抑制肝癌细胞HepG2的增殖,使肝癌细胞HepG2阻滞发生在G1/S期[23]。对R.mucilaginosaCM-1进行无机培养基分离,纯化得到了均一、纯度高的酵母胞外多糖组分 RmEPS-11[24]。进一步评估RmEPS-11对小鼠异烟肼(INH)和利福平(RIF)引起的肝脏毒性的影响,并对其作用机制进行研究。结果显示,与异烟肼和利福平处理的小鼠相比,RmEPS-11给药后各项指标均有所好转,证明多糖RmEPS-11对小鼠急性肝损伤有一定的保护作用[25]。这些结果表明,胶红酵母胞外多糖具有成为治疗肝癌或作为抗肿瘤药物的潜力,但对其抑制癌症的机制、毒性及产糖相关的基因方面仍不清楚,有待深入研究。
1.2.3 类胡萝卜素 类胡萝卜素是植物进行光合作用的重要色素,其中最有价值的是虾青素,是一类酮式类胡萝卜素,具有极强的抗氧化能力,可由多种红酵母来生产。多篇文献都报道了红酵母能合成虾青素,如担子菌酵母(basidiomycete yeast)中的红发夫酵母(Phaffia rhodozyma)[26]及其远缘菌种Xanthophyllomyces dendrorhous[27-28]。Dioszegiasp[29]还有红酵母属(Rhodotorula),掷孢酵母属(Sporobolomyces)和锁掷酵母属(Sporidiobolus)的少数物种也是类胡萝卜素的生产者[28]。
类胡萝卜素可通过非特异性反应或类胡萝卜素裂解加氧酶作用裂解产生去甲肾上腺素,从而产生花香、果香和甜香,改变食品风味[30],在食品、药品、化妆品方面有多种应用。
此外,类胡萝卜素作为天然食品着色剂,因其易获得性、非季节性、可扩展性和产量高而成为合成化合物的有效替代品[31]。1997年起,浙江工业大学、华南理工大学以及农业农村部(原农业部)饲料中心等科研单位对红发夫酵母高产虾青素突变株筛选和发酵代谢调控、虾青素的提取方法等方面进行了深入研究[18]。近几年,许多研究试图通过优化培养条件来提高几种胶红酵母产类胡萝卜素的产量。通过优化胶红酵母 ZTHY2 发酵培养基成分和培养条件明显提升了类胡萝卜素产量[3],对航天诱变胶红酵母突变株JH-R23胶红酵母突变株合成虾青素的培养基进行优化,并对其生长特性进行探究[32],将胶红酵母AJB01置于各种压力条件下,包括不同盐的渗透压力、紫外线的物理压力和使用不同光周期的光照压力,最终探究出产类胡萝卜素的最佳条件[33]。
以上研究工作为类胡萝卜素的工业化生产提供了条件和基础,未来有望实现更低成本的大规模生产。值得注意的是,天然色素也存在一定的问题,如对红酵母发酵时气味的去除、无毒和无致病性菌株的使用、环境中的稳定性和保质期问题,随着对红酵母的认识和代谢工程改造的发展,以上问题也将得到更好解决。
红酵母还能产生其他副产品,如油性酵母R.pacificaINDKK可通过利用未解毒的制糖工业废料生产生物柴油及其他具有商业价值的副产品(脂质、β-胡萝卜素和动物饲料),从甘蔗渣废弃的半纤维素部分生产木寡糖(XOS)可以进一步减少生物柴油的生产成本[34]。表1列出了红酵母的主要活性成分和用途。

表1 红酵母的活性成分及用途Table 1 Active ingredients and uses of red yeast
1.3 红酵母的基因组研究
随着研究手段不断进步,对红酵母基因组的研究变得更加深入和完善,目前,已完成了多种红酵母的基因组测序,主要包括胶红酵母(R.mucilaginosa)、圆红酵母(R.toruloides)和克氏红酵母(R.kratochvilovae)等种,其基因组大小及注释相关信息如表2所示。
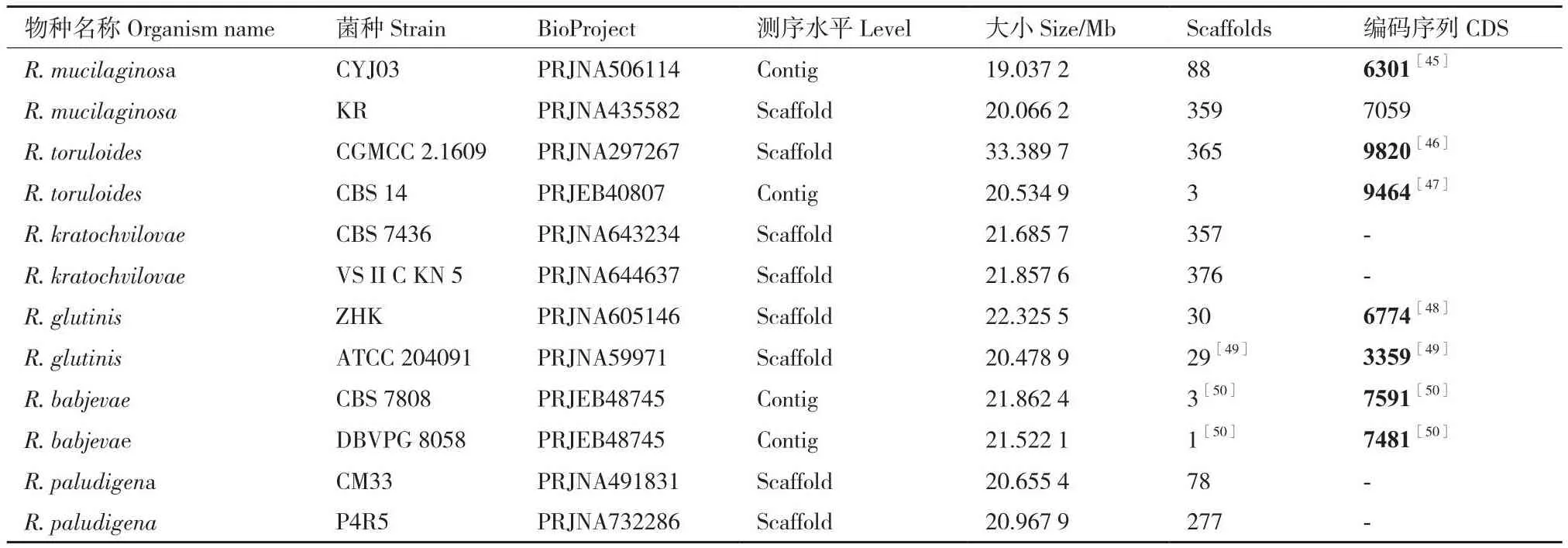
表2 红酵母属部分种基因组装和注释数据Table 2 Gene assembly and annotation data for selected species of the genus Rhodotorula
由表2可得,胶红酵母(R.mucilaginosa)是研究最多的种,其次是圆红酵母(R.toruloides)和克氏红酵母(R.kratochvilovae),其他菌种也有少部分有测序,但大部分测序水平都集中在contig和scaffold水平,未完成scaffold在染色体上的定位,因此没有完整全基因组序列。
对具有基因组信息的胶红酵母的101个菌株来源进行分析,结果见图1。绝大部分(91%)都来自于国际空间站(ISS),包括环境表面、餐桌、永久多用途舱、乘员补给车、废物和卫生隔间及零重力储存架等,还有少部分是从土壤(3%)、湿地(1%)、海洋(1%)、种子(1%)、Kefir(开菲尔)(1%)、血液(1%)和农贸市场(1%)中分离得到的。国际空间站来源的胶红酵母测序占主导,其原因是个别胶红酵母菌株被归为病原菌株,可在中心静脉血管上聚居,形成生物膜而引起真菌血症[51]。国际空间站微重力和辐射等极端条件能增强抗菌性和生物膜形成,对胶红酵母进行基因组测序为进一步研究消除这种威胁提供了基础。因此,基因组研究提示在红酵母应用中需要注意可能的病原菌的风险,进行合理的安全评价。
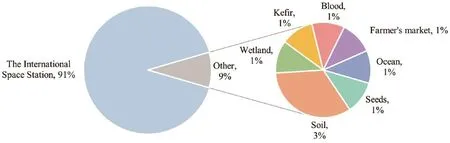
图1 有基因组序列的胶红酵母来源分析Fig.1 Analysis of the origin of R.mucilaginosa strains with sequenced genome information
通过对红酵母的基因组进行分析,发现了多个生物合成基因簇。例如,对胶红酵母CYJ03的基因组进行扫描时,发现了负责类胡萝卜素的生物合成基因簇[45],RIT389种中发现了生产类胡萝卜素关键基因的基因组区域[52],50-3-19/20B中发现了合成萜类化合物、非核糖体多肽合酶(NRPS)和脂肪酸的基因簇并鉴定了一种外源性胰岛素酶的基因位点(g1629.t1)[53]。对JGTA-S1进行测序、组装和注释发现,其拥有几个有利于内生生存的基因,如溶解磷酸盐和生产植物激素的基因。此外,还具有功能性抗冻基因g5846.t1和g5876.t1,在氮代谢方面十分独特,其硝酸盐同化途径被截断,可能导致与重氮内生菌的联系和维持,使得对其与植物的有益互作有了更深入了解[54]。这些基因组的研究为红酵母代谢和生物合成研究提供了基因组学见解。
新一代DNA测序技术的发展推动了高通量转录组测序(RNA-seq)及基因表达谱分析的成熟,动态的转录组比静态的基因组更加复杂,因而能对红酵母的遗传信息有更深入了解。对R.toruloidesNP 11进行基因组和转录组测序,结果表明,在氮限制条件下脂质积累与脂肪生成、含氮化合物回收、大分子代谢和自噬的诱导有关,这为设计脂质生产途径提供了宝贵资源[55]。此外,通过对NP11线粒体基因组进行重组和注释,并与其他菌种进行比较,表明交配类型互补品系的线粒体基因组之间存在明显的遗传差异,也补充了对圆红酵母遗传背景的理解,未来有望开启编辑线粒体基因组的大门,进行更合理的代谢工程和表型设计[56]。
利用YEASTRACT+门户网站及其数据设计了分析酵母基因组的序列工具,在预测圆红酵母转录因子RtHaa1对乙酸胁迫反应方面有应用,为在基因组尺度上预测发生在圆红酵母中的调节相互作用铺平了道路,有助于选择和设计出用于木质纤维素生物炼制的更强大菌株[57]。
在蛋白质组学方面,通过将不同蛋白质组学工作流程应用于胶红酵母以评估产蛋白质和功能信息方面的潜力,产生了大量关于胶红酵母代谢的信息[58]。根据生物化学分析和RNA测序,研究了糖酵解、三羧酸循环和氧化磷酸化3种关键途径,发现在Pb胁迫下R.mucilaginosa显示出对广泛的Pb2+浓度的耐受性,并根据转录组分析确定了参与碳水化合物和生物能量代谢的几个关键基因,这些基因对Pb2+压力有反应,揭示了红酵母关键代谢途径和重金属胁迫在RNA水平上的相关性[59]。
2 红酵母的遗传改造研究进展
为了更好利用红酵母生产所感兴趣的活性代谢物,需结合菌株的遗传改造和培养基及培养条件的优化。研究者对红酵母的代谢工程改造进行深入研究,确定了影响目标代谢的关键基因位点,再对菌株进行遗传改造,构建出更具有生产优势的红酵母菌种。红酵母代谢工程改造的技术路线,以及对关键的遗传改造方法见图2。

图2 红酵母的研究改造Fig.2 Research and modification of red yeast
2.1 红酵母的遗传转化系统
酵母菌株的遗传转化方法主要包括农杆菌介导的转化(Agrobacterium tumefaciens-mediated transformation, ATMT)、电转化和化学转化等。ATMT是目前在圆红冬孢酵母遗传改造比较常用的转化方法,对该方法进行优化,研究者发现了和圆红冬孢酵母色素合成相关的关键基因[60]。在另一项研究中,研究者利用序列条形码农杆菌T-DNA插入圆红冬孢酵母基因组获得突变体文库,发现了1 337个低T-DNA插入率的可能的必须基因。进一步分析研究突变体的遗传组成,利用基因敲除证明35个基因和脂肪酸分解和油脂积累有关,鉴定了高可信度的数据集,包含150个影响油脂积累的基因,包括和信号途径、蛋白修饰和自噬等相关的基因,以及未知功能的基因,证明了条形码突变(barcoded mutagenesis)对真菌功能基因组的影响[61]。红酵母的电转化和化学转化方法也获得了成功,例如我国学者建立了简单高效的R.toruloides电转化方法[62],利用原生质体转化也实现了R.glutinis的菌株改造[63]。值得注意的是,不同菌株其合适的遗传转化方法也可能不同,因此需要针对特定菌株进行优化。
2.2 红酵母基因编辑工具开发
基于CRISPR/Cas9的基因组编辑系统目前已经广泛用于多种酵母的菌株改造,有助于加速高效酵母细胞工厂的开发[64]。基于CRISPR-Cas9基因编辑主要针对圆红冬孢酵母R.toruloides展开,胶红酵母和黏红酵母等其他红酵母的相关研究较少,未来有待开发多种红酵母的高效基因组编辑工具。
启动子优化对基因编辑系统效率较为重要。研究证明,在CRISPR/Cas9系统用融合5S rRNA-tRNA的启动子表达引导RNA(gRNA)能够对R.toruloides基因进行高效敲除,利用这种方法还进行了双基因的高效敲除[65]。通过整合在GAP启动子下表达Cas9和在S.cerevisiaeSNR52启动子下表达gRNA的盒,使用基于CRISPR-Cas9的基因阻断成功对R.toruloides内源URA3基因进行了定向破坏,并应用优化的设计条件破坏了另一个参与类胡萝卜素生物合成的内源基因CAR2,最后在一次转化中实现同时破坏CAR2和URA3基因[66]。
另一个较成功的例子将含有密码子优化的Cas9基因的表达盒整合到R.toruloides基因组中,产生了具有足够产量的金黄色葡萄球菌来源的Cas9蛋白的菌株。同时,确定了两个U6基因,预测了两个U6启动子,并确认用U6b启动子更好地转录单向导物RNA(sgRNA)。接着设计了针对CRT1、CAR2和CLYBL基因的sgRNA盒,转化到Cas9表达的菌株中,发现超过60%的转化子成功发生了插入和删除突变[67]。
和模式酵母酿酒酵母相比,红酵母和其他非常规酵母的遗传转化效率还有待进一步提高,未来随着高效转化系统的建立,红酵母菌株的代谢工程改造效率也将大幅度提高。
3 红酵母的代谢工程研究
红酵母在最近的综述中都作为一种比较有价值的非常规酵母被讨论,具有许多工业生产相关的生理代谢优势和特性,吸引研究人员通过各种代谢工程策略从底物利用、前体供应、合成途径等多方面来提高其代谢性能[68-69],将其改造成为高效生产各种化学产品的细胞工厂。下面对近5年关键的红酵母代谢工程进展进行了总结。
3.1 利用红酵母的代谢工程改造生产天然产物和中间体
近年来利用多种非常规酵母生产植物来源天然产物及其他异源产物引起了国内外研究者的关注,以下为代表性的案例。
三乙酸内酯(triacetic acid lactone, TAL)可用于生产多种具有商业价值的化学中间体,如间苯三酚、乙酰丙酮和山梨酸。研究者将密码子优化过的来自非洲菊的2-吡喃酮合酶基因引入圆红冬孢酵母中,并过表达可能的限制性前体物质乙酰辅酶A相关的酶ACL1和ACC1,所获得的重组菌株通过补充醋酸盐的葡萄糖或甘蔗汁为底物进行发酵,TAL产量达到28 g/L和23 g/L,体积生产强度显著高于前期报道的利用解脂耶氏酵母的水平,这项研究也为利用圆红冬孢酵母生产聚酮或其他乙酰辅酶A的衍生物提供了参考[70]。
白藜芦醇(resveratrol)是来源于植物的具有多种生物活性的天然多酚类物质,广泛应用在食品、医药和化妆品等领域。研究者利用来自于拟南芥和美洲葡萄等植物的外源基因整合、外源和内源P450酶融合,以及改善辅酶供应等不同手段,首次实现了利用圆红冬孢酵母生产白藜芦醇[71]。
柠檬烯(limonene)为广泛应用于食品、药物以及先进生物燃料的单萜类化合物,由于红酵母可以利用木糖等多种碳源,且可天然产生多萜类物质类胡萝卜素,提示该酵母具有比较强的天然甲羟戊酸(mevalonate, MVA)途径碳流,因此推测红酵母具有比较好的潜力生产萜类化合物。通过对外源基因和内源基因的改造,研究者成功构建出类胡萝卜素生成缺陷的R.toruloides生产柠檬烯[72],后续可通过进一步强化前体供应提高产量。
由于类胡萝卜素和油脂等产物共用乙酰辅酶A和MVA途径,因此推测破坏类胡萝卜素合成有利于生产其他相关产物。筛选T-DNA随机插入失活的R.mucilaginosaC2.5t1突变体发现,突变体W4在八氢番茄红素去饱和酶基因CAR1内部存在插入失活,该突变体辅酶Q10和 甾醇等产量明显提高[73],提示可通过降低竞争途径的基因表达提高目标产物的产量。
以上研究不仅为利用红酵母生产多种异源天然活性产物提供了成功的范例,也为进一步开发利用红酵母细胞工厂进行动植物来源活性物质的可持续生产提供借鉴。
3.2 改造红酵母促进油脂及脂肪酸衍生物生产
多种红酵母是较好的微生物油脂生产菌,但是天然菌株油脂生产的效率还有待提高,因此有必要通过代谢工程改造,进一步提高油脂及脂肪酸衍生物的产量。
在圆红冬孢酵母IFO0880菌株中,通过基因缺失和过表达使脂酰-CoA还原酶的脂肪醇浓度明显提高,其中酰基转移酶LRO1的删除增加了脂质和脂肪醇的生产,为研究脂质代谢创造了可能的途径[74]。在NaOH催化下,R.toruloides细胞中的脂质可直接转化为脂肪酸甲酯(FAMEs),这种方法简单便捷,且具有更高的生物柴油转化率[75]。通过引入不同来源的蜡酯合酶基因,构建了R.toruloides的脂肪酸乙酯(FAEE)生物合成途径,并表达了来自不动杆菌(Acinetobacter baylyi)的双功能蜡酯合酶/酰基-CoA-二酰甘油转移酶(WS/DGAT)基因,培养生产了826 mg/L的FAEE,进一步对双功能酶进行突变,消除DGAT活性,将浓度提高到了1.02 g/L[76]。最终通过将菌株Δku70-AbWS*在反应器进行批式和补料培养,最高达到9.97 g/L FAEEs产量,而且绝大部分产物分泌到胞外,可显著降低下游处理破碎细胞的成本。在R.toruloides菌株中操纵4个与三酰甘油(DAG)和二酰甘油(TAG)间相互转化有关的基因,以促进DAG和游离脂肪酸(FFA)的产生。其中,3个与TAG合成相关的基因DGA1、LRO1和AREA1通过RNA干扰技术被连续下调,一个由TGL5编码的内源性TAG脂肪酶与LDP1融合并过度表达,将TAG转化为DAG和FFA。当在氮限制的培养基中培养时,DAG和FFA的含量分别提高了2倍和3倍[77]。另外,还有研究采用过表达乙酰辅酶A羧化酶(ACC1羧化酶)基因和抑制3-羟基3-甲基戊二酰还原酶(HMG-CoA还原酶)的双重策略来提高R.mucilaginosa的脂质生产[78]。
3.3 利用红酵母代谢工程改造促进类胡萝卜素生产
利用红酵母生产类胡萝卜素长久以来一直受到研究者的关注。随着红酵母的遗传改造系统不断成熟,利用重组菌株高效生产类胡萝卜素的研究也不断被报道。
改善类胡萝卜素合成的代谢工程,可通过过量表达内源生物合成途径中的基因、删除竞争途径中的基因,及异源表达外来基因超量生产目标化合物来实现。例如,通过使用强启动子和终止子过量表达来自X.dendrorhous的CRTE、CRTYB和CRTII,将代谢流更多导向β-胡萝卜素,结合培养基优化,工程菌株R.glutinisP4-10-9-63Y-14B产生27.13 mg/g细胞干重的β-胡萝卜素,比野生型菌株提高了129倍[63]。此外,研究通过筛选、组合不同来源的催化元件,调节模块表达水平等手段,提高了类胡萝卜素合成通量、降低了代谢中间体积累,达到构建类胡萝卜素合成细胞工厂的目的[79]。代谢工程改造策略也可以与随机诱变结合,得到高产类胡萝卜素的红酵母菌株[65]。
由于不同种酵母存在差异,在进行改造时也需要将一些环境适应性问题考虑在内,如逆境压力适应机制、潜在的代谢能力和灵活性等[80],得到更好的效果。
总之,通过对红酵母进行代谢工程改造能得到高产的菌株,其产生的代谢物不仅绿色环保,还具有巨大的经济价值,是生物燃料和其他高值商品的替代来源,在未来具有广阔的应用前景。表3为红酵母代谢工程改造的成功案例。
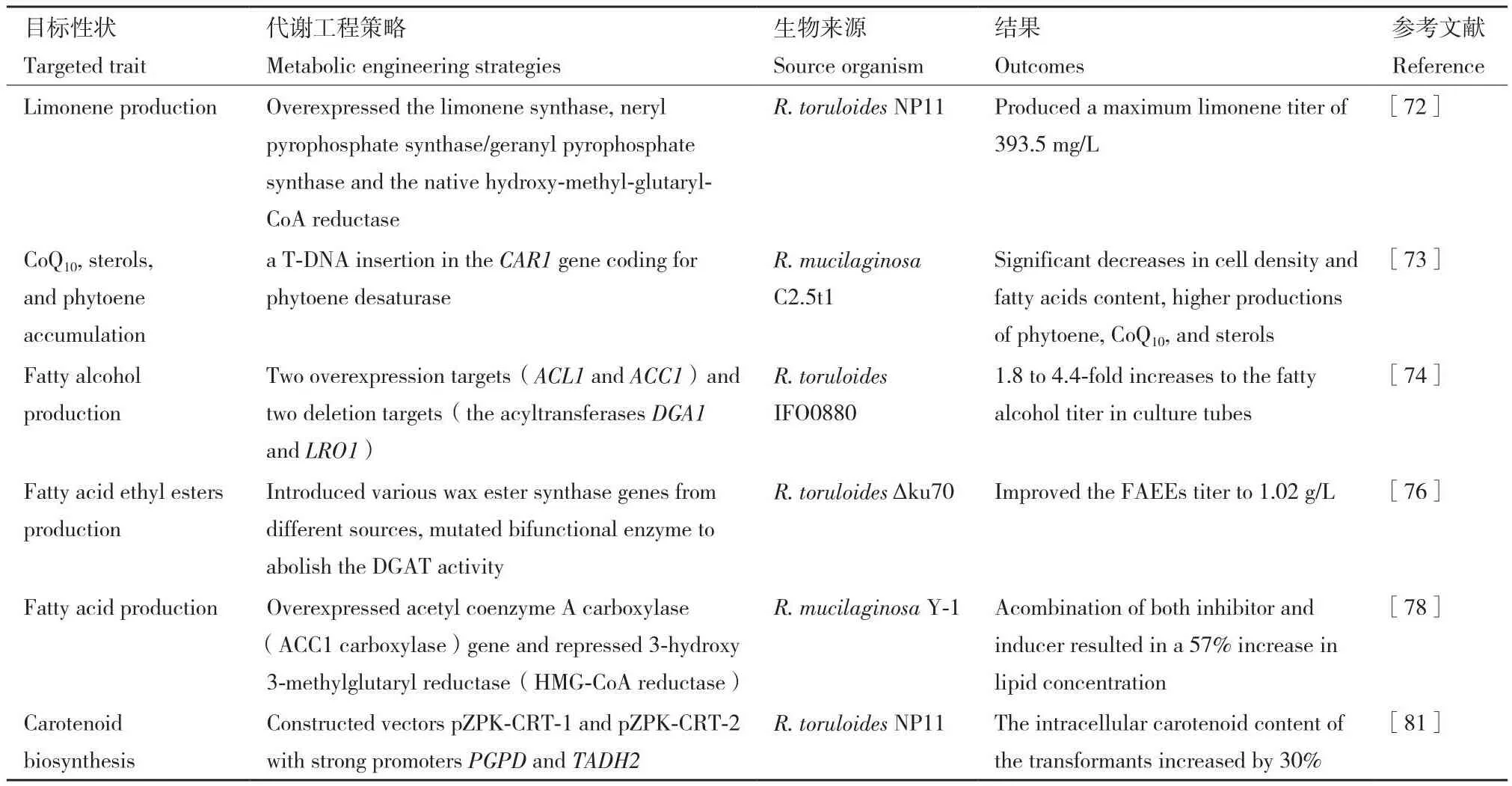
表3 对红酵母代谢工程改造总结Table 3 Summary of metabolic engineering modification of red yeast
4 存在的问题及未来发展趋势
红酵母的研究已引起了学术界和工业界的兴趣,生理学研究揭示了其具有优良特性,如高细胞密度和代谢不同碳源、氮源的能力,可利用这些特性转化低成本的原料生产高价值的代谢产物,如油脂、类胡萝卜素、酶等[82]。目前红酵母相关研究存在的问题如下。
首先,红酵母最大的问题在于精准编辑(包括精准基因整合和无痕敲除)的效率比较低。最新的报道中研究人员开发了新的基于CRISPR的基因编辑平台,命名为Lowered Indel Nuclease system Enabling Accurate Repair(LINEAR),实现了毕赤酵母、解脂耶氏酵母、马克斯克鲁维酵母和多型汉逊酵母等不同非常规酵母的高效改造。与传统的方法相比,该系统可以实现高达67%-100%的同源重组效率[83]。我国学者在毕赤酵母中强化了同源重组效率发现,高表达同源重组相关的关键基因RAD52和敲除MPH1可有效提升同源重组效率[84]。另一工作构建和优化了基于CRISPR/Cas9的基因编辑技术,通过优化Cas9蛋白和sgRNA,动态调控非同源末端连接关键基因KU80和增强表达同源重组修复蛋白等手段,有效提高同源重组效率,依托该系统成功在多形汉逊酵母(O.polymorpha)中实现基因无痕敲除、大片段整合以及多片段重组[85]。以上技术未来也有望在红酵母中得到应用,提高红酵母精准基因编辑的效率。
其次,与其他非常规酵母相比,红酵母的基因组水平的研究还相对较少,很多基因的功能未知,缺乏关于代谢网络相互作用和代谢平衡调控与应答等基础信息。此外,基于关键酶进行定向进化及理性设计以提高关键酶催化活性的策略应用也较少,这阻碍了红酵母关键途径催化效率的最大化提升。未来在建立高效红酵母基因组编辑技术的基础上,相关的代谢途径和分子调控机制也将快速深入,有希望能进一步提高利用红酵母生产多种活性物质的效率。
最后,在红酵母的工业应用方面还受到成本问题的限制,要实现大规模生产需考虑工艺优化和放大策略,整合和加强上、下游工艺,构建多功能的微生物细胞工厂,提高产量和效率。此外,利用廉价的来源丰富的可再生生物质资源,包括木质纤维素类生物质和厨余废弃物等,可实现变废为宝和可持续生产。但是,这些天然底物可能存在毒性的抑制物,比如酚类抑制物等,可通过研究红酵母对这些抑制物的耐受性和生物转化,提高其实际应用的效率[86]。
随着下一代测序技术的发展、基因组编辑工具的完善和全系统组学研究的发展,国内外研究者对非常规酵母独特代谢和生理特征的理解逐步加深[87],红酵母的相关研究也在不断完善。未来预计相关研究的不断深入,将更有助于在生理学和生物学方面对红酵母的理解,从而更好地利用红酵母资源,提高生物炼制效率。