莲生物碱生物合成途径及相关基因研究进展
王玲 卓燊,2 付学森 刘紫璇 刘笑蓉,3 王志辉,3 周日宝,3,4刘湘丹,3,4
(1.湖南中医药大学药学院,长沙 410208;2.广西科技大学医学部,柳州 545006;3.湘产大宗道地药材种质资源及规范化种植重点研究室,长沙 410208;4.湖南省普通高等学校中药现代化研究重点实验室,长沙 410208)
莲Nelumbo nuciferaGaertn.为莲科多年生水生植物[1],作为药用植物最早以藕实茎之名记载于东汉《神农本草经》、明代《本草纲目》中对莲各部位名称进行了详细的解释[2]。莲的叶、种子、种子中的幼叶和胚根、雄蕊、莲蓬等多个部位均可入药,其种子作莲子入药,有补脾止泻、止带、益肾涩精、养心安神之功效,为药食同源佳品;其干燥叶作荷叶入药,有清暑利湿、升发清阳、凉血止血等功效;其成熟种子中干燥的幼叶和胚根作莲子心入药,重在清心安神、交通心肾[3]等。莲子、荷叶、莲子心基原相同而因入药部位不同导致功效不同称“同源异效”即药效分化,其中荷叶、莲子心均含生物碱类和黄酮类成分而药效差异显著引起了笔者的关注。
现有认知物质基础不同可能导致功效和药理作用差异。现代化学成分研究表明,荷叶和莲子心均含有生物碱类和黄酮类成分,但两者生物碱类成分[4-8]差异明显。荷叶、莲子心所含生物碱均属于苄基异喹啉类生物碱(benzylisoquinoline alkaloids, BIAs)。但荷叶中生物碱主要是阿朴啡类(aporphines),药典将其中的荷叶碱(nuciferine)设为荷叶评价指标,规定其含量不得少于0.1%[3];此外番荔枝碱(anonaine)、O-去甲基荷叶碱(O-nornuciferine)、莲碱(roemerine)、N-去甲基荷叶碱(N-nornuciferine)在荷叶中含量也相对丰富;现代研究表明,阿朴啡类生物碱荷叶碱调脂减肥作用明显[9],与《本草纲目》记载“荷叶服之,令人瘦劣”的功效相符。莲子心生物碱主要为双苄基异喹啉类(bisbenzylisoquinolines),该类成分被认为是莲子心具有安神功效的主要药效物质,其中甲基莲心碱(neferine)具有抗心律失常、抗高血压、抗血栓等作用[10],药典将其作为莲子心质量评价指标,规定其含量不得少于0.7%[3];莲子心中还含具有降压作用的异莲心碱(isoliensinine)[11]及抗氧化作用的莲心碱(liensinine)等。
莲中生物碱类成分具有显著药理活性,而荷叶与莲子心的“同源异效”现象,激发越来越多研究工作者开展莲生物碱生源合成途径及关键酶研究。基于此,本文通过查阅文献对莲生物碱成分类型、莲生物碱合成途径及其关键酶基因进行了综述,并对莲中主要的生物碱合成途径进行归纳,以期为解析莲的生物碱合成途径及荷叶、莲子心的药效分化的分子机制提供参考。
1 莲的生物碱分类及主要成分
莲生物碱按母核连接的差异基团,分单苄基异喹啉类、双苄基异喹啉类、原阿朴啡类、阿朴啡类、氧化阿朴啡类、去氢阿朴啡类和其他类[12],以单苄基异喹宁类、双苄基异喹宁类和阿朴啡类这三类为主。荷叶中生物碱以阿朴啡类、单苄基异喹啉类为主,如荷叶碱、莲碱、O-去甲基荷叶碱、番荔枝碱、N-去甲基荷叶碱等。莲子心中生物碱以双、单苄基异喹啉类为主,主要包括莲心碱、异莲心碱、甲基莲心碱等。莲中常见生物碱见表1,化学结构见图1。
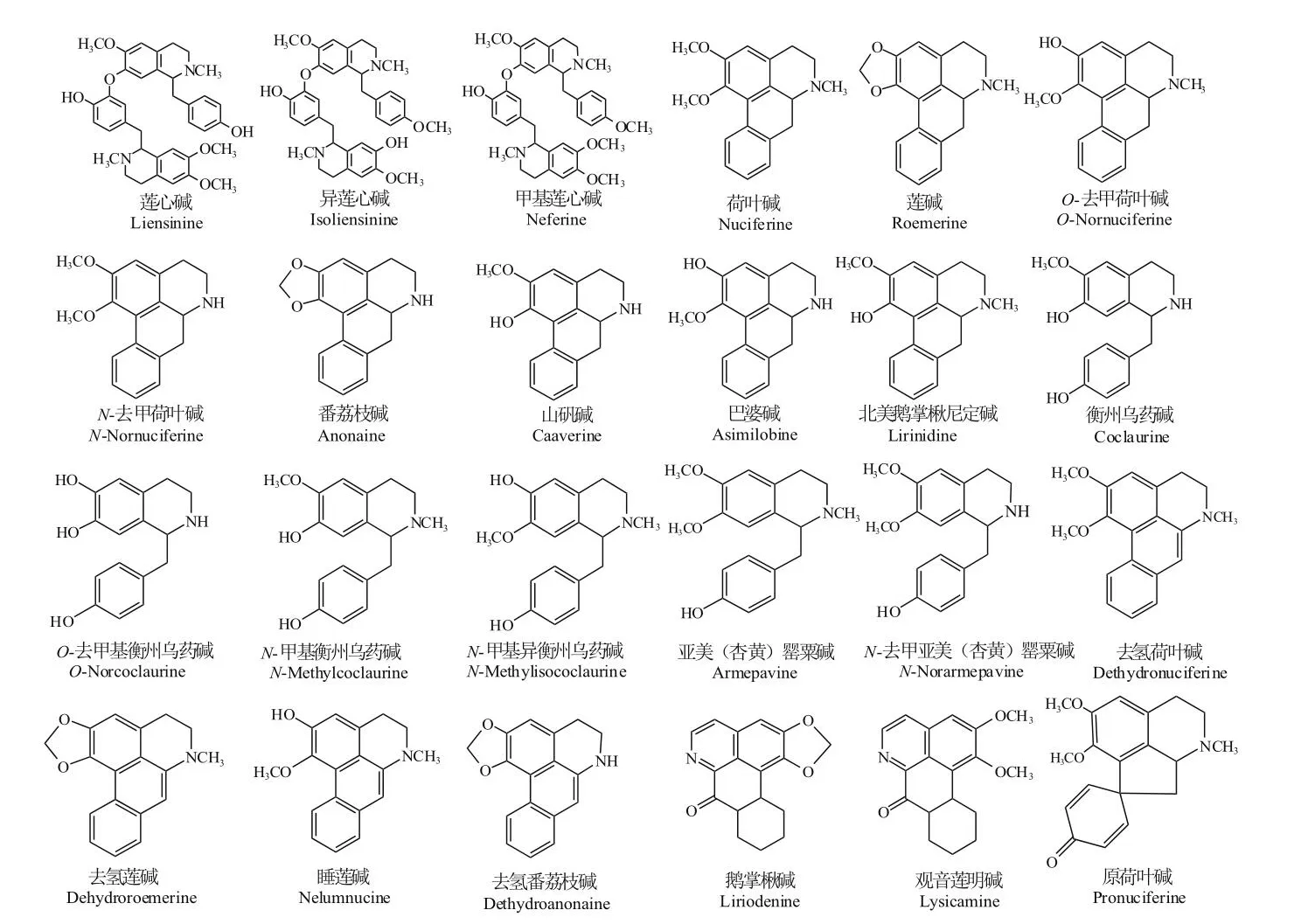
图1 莲中主要生物碱化学结构Fig.1 Chemical structure of main alkaloids in lotus(Nelumbo nucifera Gaertn.)

表1 荷叶、莲子心主要化学成分Table 1 Main chemical constituents of lotus leaf and lotus plumule
2 莲的生物碱生物合成途径
2.1 BIAs的分类及莲生物合成途径
2.1.1 BIAs的分类及其共有生物合成途径 BIAs按母核分类如下[30-31]:(1)苄基异喹啉生物碱(benzylisoquinoline),如罂粟碱;(2)双苄基异喹啉生物碱,如莲心碱、甲基莲心碱;(3)阿朴啡和异阿朴啡类生物碱,如荷叶碱、番荔枝碱;(4)小檗碱和原小檗碱类生物碱(protoberberine),如黄连碱、小檗碱;(5)苯并菲啶类生物碱(benzophenanthridines),如血根碱;(6)吗啡类生物碱(morphinane),如吗啡;(7)普罗托品类生物碱(protopine)。
BIAs具有共有合成途径,以氨基酸为生物合成起点,经一系列转移酶、还原酶及合成酶催化衍生出各类苄基异喹啉类生物碱。首先,酪氨酸(L-tyrosine)经反应分别形成L-多巴胺(L-dopamine)和4-羟基苯基乙醛(4-hydroxyphenylacrtaldehyde,4-HPAA),随后多巴胺和4-HPAA经去甲乌药碱合酶(norcoclaurine synthase,NCS)催化缩合形成(S)-去甲乌药碱,(S)-去甲乌药碱[32]再经(S)-去甲乌药碱6-O-甲基转移酶((S)-norcoclaurine-6-O-methyltransferase,6OMT)、乌药碱N-甲基转移酶(coclaurine-N-methyltransferase,CNMT)、3'-羟基-N-甲基乌药碱-4'-O-甲基转移酶(4'-O-methyltransferase, 4' OMT)3个甲基转移酶的甲基化和细胞色素P450氧化还原酶(N-methylcoclaurine-3'-hydroxylase,NMCH)的催化形成(S)-牛心果碱((S)-reticuline)[33]。以(S)-牛心果碱为前体,经异构、甲基化、去甲基化、偶联、重排等反应,可形成阿朴啡类、双苄基异喹啉类、小檗碱和原小檗碱类等大多数BIAs。其中(1)小檗碱类途径,小檗碱桥酶(berberine bridge enzyme,BBE)催化(S)-reticuline形成(S)-金黄紫堇碱((S)-scoulerine),在金黄紫堇碱9-O-甲基转移酶(scoulerine 9-O-methyltransferase,SOMT)、四氢小檗碱合酶(Canadine synthase,CAS)、四氢小檗碱氧化酶((S)-tetrahydroprotoberberine oxidase, STOX)催化下形成小檗碱等小檗碱类。(2)(S)-金黄紫堇碱也是苄基异喹啉类、苯并菲啶类、普罗托品类的共同起点[34-35],(S)-金黄紫堇碱经反应形成普罗托品类,苯并菲啶类再在普罗托品类基础上经反应形成[35]。(3)吗啡类途径,(S)-牛心果碱在异构酶(reticuline epimerase,REPI)异构作用下形成(R)-牛心果碱[36],再经P450 酶(salutaridine synthase)偶联作用形成吗啡烷的基本骨架,而后反应形成吗啡类生物碱[37]。(4)阿朴啡类途径,(S)-Reticuline经紫堇块茎碱合成酶(corytuberine synthase,CTS)催化发生分子内C-C苯酚偶联转化成紫堇块茎碱后进一步合成阿朴啡类[38]。(5)双苄基异喹啉类途径,由CYP80A催化(S)-N-甲基乌药碱反应产生双苄基异喹啉。目前,小檗碱、吗啡、血根碱、木兰花碱等成分合成途径已明确,而莲中的生物碱的合成途径并不清晰。共有合成途径如图2所示。
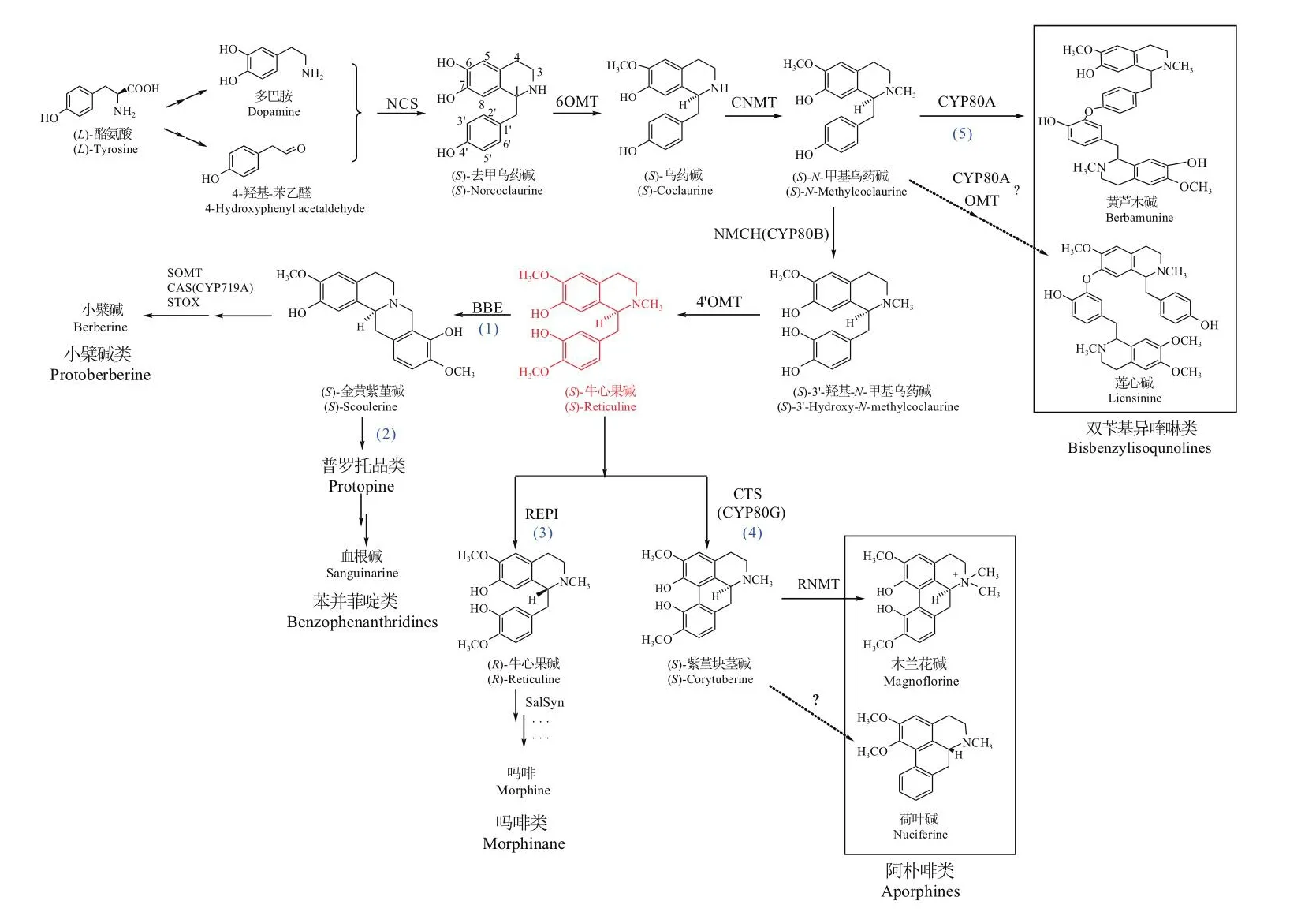
图2 苄基异喹啉类生物碱合成途径Fig.2 Synthesis pathways of benzylisoquinoline alkaloids
2.1.2 莲的生物碱生物合成途径 文献研究发现,莲中生物合成途径研究主要集中在阿朴啡类和双苄基异喹啉类生物碱,与大多数BIAs合成途径相似,莲生物碱也具有共同合成途径。目前,阿朴啡类途径存在较多争议,因荷叶所含阿朴啡类生物碱的C-3'和C-4'不含甲基或羟基,故有研究者认为该类成分应该是(S)-N-甲基乌药碱或者(S)-去甲乌药碱由CYP80G催化产生;但也有认为从(S)-牛心果碱处经CTS催化生成紫堇块茎碱再产生一系列的阿朴啡类。此外,莲碱可能是由北美鹅掌楸尼定碱在CYP719A的催化下生产,N-去甲荷叶碱、O-去甲荷叶碱可能是荷叶碱去甲基化修饰产生。荷叶中的荷叶碱、莲碱、番荔枝碱、N-去甲荷叶碱、O-去甲荷叶碱合成途径,如图3所示。

图3 荷叶阿朴啡类生物碱合成途径Fig.3 Synthesis pathways of apomorphine alkaloids in lotus leaf
莲中双苄基异喹啉类生物碱可能从(S)-N-甲基乌药碱处由CYP80A催化两个单苄基类生物碱的C-O之间发生C-O 苯酚偶联反应产生。从结构分析,莲心碱可能由亚美罂粟碱和(S)-N-甲基乌药碱反应生成,甲基莲心碱可能由莲心碱经甲基化修饰产生,异莲心碱可能由两种构型的N-甲基乌药碱反应生成norisoliensinine后经甲基化修饰而产生。莲子心中莲心碱、异莲心碱、甲基莲心碱合成途径如图4。
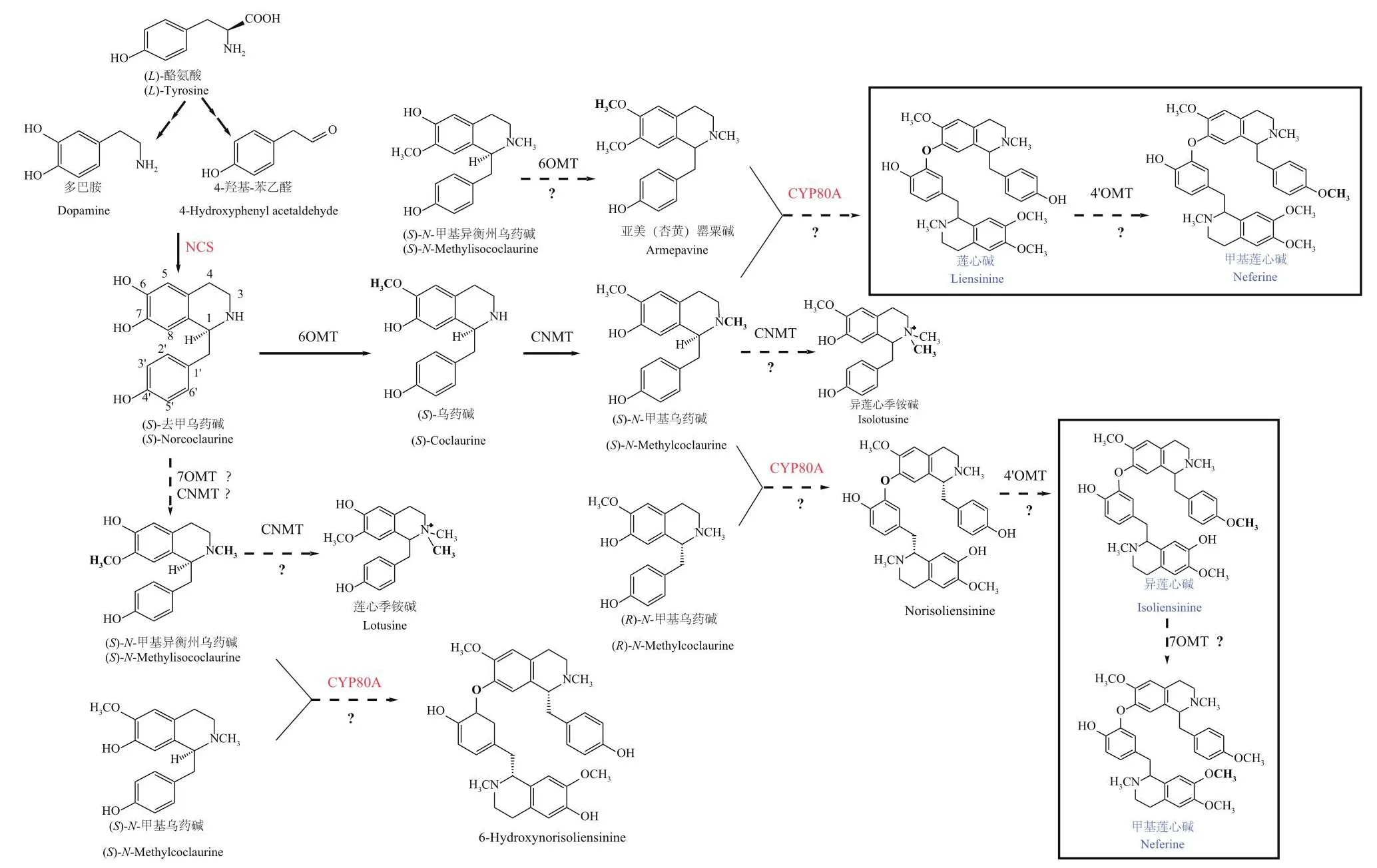
图4 莲子心双苄基异喹啉类生物碱合成途径Fig.4 Synthesis pathways of dibenzyl isoquinoline alkaloids in lotus plumule
2.2 莲生物碱合成途径中相关酶基因进展
文献研究发现,莲生物碱合成途径对NCS、6OMT、7OMT、NCMT、CYP80A、CYP80G、CYP80B酶基因研究较多,主要集中在莲不同组织不同发育阶段相关酶基因的表达模式与生物碱含量的变化关系研究,而相关酶功能研究较少。
2.2.1 去甲乌药碱合成酶基因 去甲乌药碱合成酶(NCS)是苄基异喹啉类生物碱共有合成途径中的第一个关键酶,属于裂合酶[35,39]。NCS催化多巴胺和4-羟基苯乙醛缩合生成BIAs合成路径中的第一个前体化合物去甲乌药碱,去甲乌药碱是生成阿朴啡类、吗啡类等生物碱的重要前体物质,NCS为以上生物碱生源合成途径中重要限速酶[40-41]。
Vimolmangkang等[39]鉴定出7个NCS候选基因,命名为NnCNS1-NnCNS7。基因NnCNS7被认为是参与莲叶生物碱合成途径中的关键基因,在莲叶中显著表达且表达水平与生物碱含量相关;当生物碱含量较高时可通过反馈机制抑制NnNCS7的表达,水平低时则反之。赵力[42]进一步研究基因NnNCS7在‘Luming’(高BIAs品种)和‘WD40’(低BIAs品种)两个品种叶片的7个发育阶段(S1-S7)表达模式发现,该基因在两个品种的发育阶段表达模式相似,S4阶段的表达水平达到极值,且生物碱合成途径中基因的表达峰值先于生物碱积累峰值。7个CNS基因中,基因NnCNS4的表达缺乏不会抑制莲叶生物碱的积累,与莲中生物碱的积累无显著相关性;此外,在莲叶、花、叶柄中未检测到基因NnCNS6的转录本,认为其为一假基因[39]。
此外,朱玲平[43]根据“中国古代莲”基因组注释信息,筛选出3个与罂粟高度同源的NCS候选基因,命名为NnCNS1、NnCNS2、NnCNS3。对候选基因在‘露茗莲’(高荷叶碱品种)和‘10-48’(低荷叶碱品种)两个品种叶片进行表达分析研究发现,基因NnCNS1、NnCNS2在两个品种叶片中的表达差异可能导致了两个品种叶片中总生物碱含量差异,其可能参与莲叶片中含量较高的荷叶碱、O-去甲基荷叶碱的合成;而NnCNS3表达差异对两个品种叶片荷叶总生物碱含量差异的影响不明显,可能参与叶片中含量较低的番荔枝碱、莲碱、N-去甲基荷叶碱的合成[43]。
2.2.2 甲基转移酶基因 甲基转移酶包括O-甲基转移酶(OMT)和N-甲基转移酶(NMT)两类,多数甲基转移酶具有底物专一性,有的可以同时催化多个位点发生甲基化[44]。甲基化可以发生在含有羟基的C-6、C-7、C-4'以及含氢的N,催化反应发生的酶主要有6OMT、7OMT(7-O-甲基转移酶)、4'OMT、CNMT[45]。
6OMT主要使(S)-去甲乌药碱C-6位的羟基发生甲基化生成(S)-乌药碱,也可催化其他苄基喹啉结构的C-6位发生甲基化,可能在莲BIAs生成中发挥了重要的修饰作用。单锋[4]发现3个6OMT的同源基因(Nn6OMT1、Nn6OMT2、Nn6OMT3)在莲叶、莲子心不同发育时期的表达与生物碱成分的积累呈正相关。在莲叶发育早期三者表达水平达峰值,中后期表达下降,生物碱成分的积累趋势与之相同。在莲子心4个发育时期(LP0-LP3)的表达呈先升高后降低的趋势,LP2期达峰值;生物碱积累在LP0期极少,LP1-LP2期逐渐增加,LP3期不在增加。
7OMT催化双苄基异喹啉或阿朴啡类的C-7甲基化反应,Deng等[46]在莲中鉴定出3个7OMT基因(Nn7OMT1、Nn7OMT2、Nn7OMT3)在莲叶中显著表达。4'OMT可催化(S)-甲基乌药碱甲基化生成(S)-番荔枝碱,其过表达对生物碱含量没有影响[47]。系统进化分析表明6OMT与7OMT同处于一个分支,4'OMT与它们不在同一基因簇。
CNMT可以使(S)-乌药碱发生N-甲基化生成(S)-N-甲基乌药碱,具有底物的多样性。单锋[4]研究发现基因NnCNMT1在莲叶中显著表达,但是在莲子心中表达极低,在荷叶中的表达随荷叶的生长发育而升高。其他研究发现3个基因NnCNMT1、NnCNMT2、NnCNMT3,基因NnCNMT2被认定为假基因,通过机械损伤模型研究时发现CNMT可能是荷叶生物碱合成途径中的一个关键酶,在荷叶碱合成中发挥了重要作用[48]。
2.2.3 细胞色素P450酶基因 细胞色素P450(cytochrome P450 monooxygenas,CYP450)属于氧化酶,可催化亚甲基双氧桥结构的形成,也可使底物发生羟基化、去甲基化反应,具有底物专一性[49]。参与莲BIAs合成途径的CYP450可能有CYP80和CYP719两个家族[50],其中CYP80主要包含CYP80G、CYP80A和CYP80B。
CYP80G可催化(S)-番荔枝碱分子内C-C苯酚偶联转化成紫堇块碱进一步合成阿朴啡类[36],可能参与莲阿朴啡类生物碱合成。单锋[4]对不同发育时期荷叶、莲子心BIAs候选基因表达与化学成分相关性开展研究,发现基因NnCYP80G在荷叶中显著表达。该基因在荷叶不同发育阶段的表达趋势与化学成分的积累趋势一致,其在荷叶发育早期高表达,中后期表达下降;阿朴啡类成分在荷叶发育早期大量积累,中期增加不明显,后期出现下降[4]。Meelaph等[48]也发现基因NnCYP80G在荷叶中高水平表达,机械损伤可以诱导该基因在荷叶中的表达和苄基异喹啉生物碱的积累。
CYP80A可能催化单苄基异喹啉类生物碱C-O之间发生C-O苯酚偶联反应参与莲双苄基异喹啉生物碱合成。赵力[42]研究发现基因NnCYP80A在莲子心中高度表达但叶片中表达量非常低,检测到双苄基异喹啉类生物碱在莲子心中积累而叶片中积累量较少。单锋[4]发现该基因的表达规律与莲子心中双苄基异喹啉生物碱的变化规律呈正相关,双苄基异喹啉类成分积累随NnCYP80A的表达而增加,发育后期其不表达,双苄基类成分的积累也不再增加。同时也发现在不同组织中具有表达差异(莲子心中高表达)。
CYP80B负责C-3'的羟基化、甲基化。可能有3个CYP80B候选基因(CYP80B1、CYP80B2、CYP80B3)与莲生物碱合成有关,CYP80B1、CYP80B3可能参与荷叶中的荷叶碱合成;CYP80B2可能参与番荔枝碱的合成[43]。
CYP719A亚族可催化亚甲基二氧基桥结构的形成,该家族基因NnCYP719A22可能涉及莲阿朴啡类生物碱合成,与番荔枝碱、莲碱的形成相关[42,50]。
2.2.4 其他酶基因 Yang 等[47]在莲中发现编码SOMT、CODM(可待因脱氧甲基化酶,CodeineO-demethylase)和T6ODM(蒂巴因6-去氧甲基化酶,thebaine 6-O-demethylaseT)的同源物,它们具有去甲基化的作用。其中有3个编码SOMT的基因与原小檗碱生物碱途径相关,1个编码CODM的基因和2个编码T6ODM的基因参与吗啡类生物碱途径。目前没有从莲中分离出有相关的吗啡类化学成分[51],故需要更多的研究来阐明以上酶是否参与莲生物碱的合成。
3 结论与展望
文献研究发现,莲生物碱生源合成研究主要集中在酶基因在莲不同组织的表达量与生物碱含量相关性研究方面。目前,NCS、6OMT、7OMT、NCMT、CYP80A、CYP80G、CYP80B酶基因已从莲BIAs生物碱合成途径中被发现,其中同源基因NnCYP80A和NnCYP80G功能分化且在荷叶和莲子心中差异表达,NnCYP80A在莲子心中显著表达,可能与双苄基类生物碱产生相关,而NnCYP80G则可能与阿朴啡类合成相关。此外,甲基转移酶的修饰在丰富莲BIAs的方面发挥了重要作用。随着莲不同部位和不同发育时期化学成分的逐步解析,以及越来越多生物合成途径相关酶及基因的发现,推进莲生物碱生物合成途径的阐析、开发高生物碱含量新品种,尚有几个关键问题待进一步研究和解决。
首先,莲中生物碱合成途径中相关酶基因具体功能不明确。阐明莲中BIAs生物合成途径,进行关键酶基因功能分析非常必要,而现阶段仅有3个参与莲生物碱合成的O-甲基转移酶功能被表征[52-53]。值得注意的是甲基化对BIAs结构和功能的多样性至关重要,甲基转移酶(6OMT、7OMT、NCMT)的甲基化修饰和一些酶的去甲基化作用丰富了莲中BIAs的种类,因此莲甲基转移酶的具体功能研究是莲关键酶基因功能研究的一个重点。目前,基因过表达、基因敲除技术、RNA干扰和反义技术等在植物基因功能验证技术非常成熟并已得到广泛应用[54],后续可运用以上相关技术对莲生物碱合成途径中的相关酶及基因进行功能验证分析,为阐明莲生物碱生物合成途径提供研究基础。第二,有研究表明生物碱的生物合成和积累发生在植物的所有器官中,目前对莲生物碱生物合成细胞定位研究关注较少。Deng等[55]推测莲中双苄基异喹啉类生物碱主要在荷叶中合成后通过韧皮部易位作用经乳汁转移到莲子心中。由于植物中不同酶的作用以及不同外在环境的差异,植物不同部位合成的生物碱具有不同的结构,因此,多组学联合对莲生物碱生物合成进行细胞定位研究有助于解析其合成机制。第三,转录因子可以调控生物碱的生物合成,研究表明转录因子对莲中BIAs的积累具有调控作用[42,56],目前在莲中已发现了WRKY、bHLH等转录因子[42],但尚不能解析莲生物碱生物合成途径中的转录调控机制,需进一步研究调控莲生物碱生物合成的关键调控因子,以实现目标次生代谢产物(如荷叶碱)的大量合成与积累。最后,荷叶、莲子心的“同源异效”现象的生物合成分子机制有待深入研究,进一步对NnCYP80A、NnCYP80G酶基因进行功能验证;同时通过代谢组学、转录组学等多组学方法分析挖掘荷叶、莲子心生物碱合成途径中差异成分的其他关键基因,从分子角度揭示荷叶、莲子心生物碱成分差异的原因。