稻田稗草对五氟磺草胺的抗性机制及其防治药剂筛选
张丽雅,李奇,史珊珊,马雨梦,刘亚琪,赵超伟,王鹤如,操海群,廖敏,赵宁
稻田稗草对五氟磺草胺的抗性机制及其防治药剂筛选
张丽雅1,李奇1,史珊珊1,马雨梦1,刘亚琪1,赵超伟1,王鹤如2,操海群1,廖敏1,赵宁1
1安徽农业大学植物保护学院/作物有害生物综合治理安徽省重点实验室,合肥 230036;2天长市农业科技中心植保站,安徽天长 239300
【目的】稗草()是我国水稻田主要恶性杂草之一,五氟磺草胺等乙酰乳酸合成酶(acetolactate synthase,ALS)抑制剂类除草剂是防治稻田稗草的主要除草剂种类。本研究团队前期在安徽省天长市水稻主产区发现疑似五氟磺草胺抗性稗草种群AHTC-01,明确其对稻田不同种类除草剂的抗性水平及可能的抗性分子机制,为抗性稗草有效防治、延缓其抗药性进一步发展提供理论依据。【方法】采用温室盆栽法在整株水平上测定稗草种群AHTC-01对五氟磺草胺的抗性水平及对不同除草剂的抗性模式,并通过靶标基因测序和实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)分析探索其靶标抗性分子机制。【结果】相比敏感稗草种群AHFY-01,疑似抗性稗草种群AHTC-01已对五氟磺草胺产生高水平抗性,抗性倍数(resistance index,RI)为620。靶标抗性机制分析表明,AHTC-01种群基因拷贝2()第574位氨基酸由色氨酸(Trp)突变为亮氨酸(Leu),其种群突变频率为100%;在五氟磺草胺处理后12 h,抗性稗草种群AHTC-01相对表达量为敏感稗草种群AHFY-01的2.26倍。AHTC-01同时对其他3种ALS抑制剂类除草剂双草醚、嘧啶肟草醚、甲氧咪草烟产生不同水平交互抗性,抗性倍数分别为8.24、13.36、20.36;但是对乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)抑制剂氰氟草酯、精噁唑禾草灵和烯草酮,4-羟基苯基丙酮酸双氧化酶(4-hydroxyphenylpyruvate dioxygenase,HPPD)抑制剂三唑磺草酮,合成生长素类(synthetic auxin mimic)氯氟吡啶酯等其他作用机制除草剂依旧较为敏感。【结论】稗草种群AHTC-01靶标基因第574位氨基酸突变和过量表达是其对五氟磺草胺产生抗性的主要原因之一,该抗性机制同时赋予其对不同ALS抑制剂的交互抗性。农田生产实际中,可轮换使用其他作用机制除草剂对其进行有效防治。
稗草;五氟磺草胺;乙酰乳酸合成酶;基因突变;基因过量表达;抗性模式
0 引言
【研究意义】稗草()是世界性恶性禾本科杂草之一,广泛分布在全球各水稻生产区[1]。在我国,稗草主要危害水稻()、玉米()等秋熟作物,严重发生时可导致显著减产。有研究表明,9株/m2稗草发生密度可导致水稻减产57%左右[2-4]。乙酰乳酸合成酶(acetolactate synthase,ALS)抑制剂类除草剂是水稻田常用除草剂类别之一,其主要通过抑制靶标杂草体内ALS活性,影响支链氨基酸合成并干扰有丝分裂,进而导致植物死亡[5]。目前,ALS抑制剂类除草剂主要包括5大类别:磺酰脲类(sulfonylurea,SU)、咪唑啉酮类(imidazolinone,IMI)、三唑并嘧啶磺酰胺类(triazolopyrimidine sulfonanilide,TP)、嘧啶硫代苯甲酸酯类(pyrimidinyl thiobenzoate,PTB)、磺酰胺基羰基三唑啉酮类(sulfonylaminocarbonyl- triazolinone,SCT)[6],其中五氟磺草胺(penoxsulam)是TP类除草剂的典型代表[7],其于2008年在我国首次登记,主要用于水稻田防除稗草、莎草和阔叶类等一年生恶性杂草。然而已有研究表明,作用位点单一的除草剂长期、频繁、超量使用极易诱导杂草产生抗性[8]。在其登记过后仅7年,王琼等就报道采集自黑龙江、安徽、江苏、宁夏等地水稻田的稗草种群对五氟磺草胺产生了不同水平的抗性[9],随后我国水稻主产区五氟磺草胺抗性稗草案例频发[10-17],给水稻安全生产构成严重威胁。明确稗草抗性发展情况及其内在抗性分子机制,对于科学防治抗性稗草以及缓解稗草抗性发展具有重要意义。【前人研究进展】靶标抗性(target-site based resistance,TSR)和非靶标抗性(non-target-site based resistance,NTSR)是杂草对除草剂产生抗性的两个主要机制[18]。靶标抗性主要涉及靶标基因突变和过量表达,二者分别通过改变靶标蛋白构象或者增加靶标蛋白含量而赋予杂草对除草剂的抗性[19]。目前已证实,不同杂草物种存在Domain A—E 5个高度保守区,其中在与ALS抑制剂结合过程中,有8个具有关键作用的氨基酸位点可能发生突变,分别为Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653和Gly654,而且这些氨基酸位点的突变通常导致杂草对同一作用机制的药剂产生交互抗性[20]。针对ALS抗性稗草,多数案例是由于靶标基因一个或者多个决定ALS蛋白构象的关键氨基酸发生了非同义突变[21]。此外,靶标基因过量表达也是某些杂草产生ALS抗性的分子机制之一。比如,Sen等[22]发现过量表达可能是贫育雀麦()对啶磺草胺产生抗性的原因之一,Zhao等[23]也报道了抗甲基二磺隆的看麦娘()发生过量表达。黄启超等[24]发现抗性稗草种群18-WJJ-Ec表达量是敏感稗草种群18-NJ的8.72倍,进而推测过量表达参与了稗草的抗药性表型。相比之下,非靶标抗性则几乎包括所有可以影响除草剂到达靶标作用位点的机制,比如减少对除草剂吸收或转运、增加对除草剂屏蔽和隔离、增强对除草剂解毒代谢等[25]。其中,代谢抗性也是多种杂草对ALS抑制剂类除草剂产生抗性的主要原因之一,其一般会赋予杂草不可预测的除草剂抗性模式。研究表明代谢抗性是多个超基因家族协同作用的结果,通常涉及到几个主要的除草剂解毒酶家族,如细胞色素P450单加氧酶系(cytochrome P450 monooxygenases,CytP450s)、谷胱甘肽S-转移酶系(glutathione S-transferases,GSTs)、UDP-糖基转移酶系(UDP-glucosyltransferases,UDP-GTs)和ABC转运体(ATP-binding cassette transporters,ABC transporters)等,其中某些能够赋予杂草抗药性的关键基因近年来也得到鉴定,比如CYP81A家族基因广泛参与稗草、菵草()等多种杂草对不同除草剂的代谢抗性等[26-27]。稗草P450s活性增强参与针对ALS抑制剂抗性的案例也在逐年增加[28-29]。【本研究切入点】安徽省是我国长江中下游水稻主产省份之一。前期田间调查表明,该省各地市水稻田稗草、千金子()等禾本科杂草发生较为严重[30-31],其中安徽省天长市等地区农户近年来普遍反映,五氟磺草胺等稻田常用除草剂在大田推荐剂量下防治效果较差,推测稗草等杂草已经对其产生了抗药性。2020年10月,本课题组于该地区水稻田采集到一个稗草疑似抗性种群AHTC-01,然而其具体抗性发生情况以及内在抗性机制如何,目前尚不清楚。【拟解决的关键问题】针对AHTC-01稗草种群,首先采用整株生物测定明确该种群对五氟磺草胺的敏感性和抗性水平,随后探索其潜在的靶标抗性分子机理,同时测定目标抗性机制所赋予该种群的交互抗性模式,以及其对不同作用机制除草剂的敏感性和抗性水平。预期研究结果将明确AHTC-01稗草种群对五氟磺草胺的抗性水平和靶标抗性分子机制,同时筛选可用于防治该稗草种群的有效药剂,为抗性稗草科学防治、延缓其抗药性发展提供依据。
1 材料与方法
1.1 杂草种子采集
2020年10月,于安徽省天长市万寿镇石庄村水稻田(119.09°E,32.73°N)采集到疑似抗五氟磺草胺稗草种群AHTC-01,据当地农户反映,该田块已连续至少10年使用ALS抑制剂五氟磺草胺防除稗草、千金子等恶性杂草,且种子采集当季以大田推荐剂量(30 g a.i.·hm-2)于水稻苗后早期、稗草3叶期左右施用过五氟磺草胺;同期于安徽省滁州市凤阳县赵家圩子村非耕地(117.68°E,32.83°N)采集到敏感稗草种群AHFY-01,该地块近20年来未使用过任何除草剂。各种群种子均随机采集自至少200株稗草成熟穗,于室温下风干后分别装入牛皮纸袋,保存于4 ℃备用。
1.2 药剂、试剂及仪器
主要供试药剂:25 g·L-1五氟磺草胺可分散油悬浮剂(OD)、30%氰氟草酯(cyhalofop-butyl)乳油(EC)、3%氯氟吡啶酯(florpyrauxifen-benzyl)EC,美国陶氏益农公司;69 g·L-1精噁唑禾草灵(fenoxaprop-- ethyl)水乳剂(EW),拜耳作物科学(中国)有限公司;4%甲氧咪草烟(imazamox)水剂(AS)、240 g·L-1烯草酮(clethodim)EC,山东奥坤作物科学股份有限公司;10%双草醚(bispyribac-sodium)悬浮剂(SC),安徽久易农业股份有限公司;5%嘧啶肟草醚(pyribenzoxim)微乳剂(ME),山东青岛奥迪斯生物科技有限公司;6%三唑磺草酮(tripyrasulfone)OD,江苏清原农冠杂草防治有限公司。
主要供试试剂:Nuclean Plant Genomic DNA Kit、HiFiScript gDNA Removal cDNA Synthesis Kit,北京康为世纪生物科技股份有限公司;ChamQ SYBR qPCR Master Mix、DNA凝胶回收试剂盒,南京诺唯赞生物科技股份有限公司;Quick RNA Isolation RNA Kit,北京华越洋生物科技有限公司;LA Taq DNA Polymerase with GC Buffer,北京宝日医生物技术有限公司。
主要供试仪器:BIC-400型人工气候箱,上海博迅实业有限公司医疗设备厂;FA/B系列万分之一天平,上海越平科学仪器(苏州)制造有限公司;3WP-2000型行走式喷雾塔,农业农村部南京农业机械化研究所;T100型梯度PCR仪,美国Bio-Rad公司;ERS 200型电泳仪,北京原平皓生物技术有限公司;ZF-288型凝胶成像分析系统,上海金鹏分析仪器有限公司;Nanodrop 2000型分光光度计,美国Thermo Scientific公司。
1.3 方法
1.3.1 稗草对五氟磺草胺的敏感性和抗性水平测定 参照《农药室内生物测定试验准则除草剂第4部分:活性测定试验茎叶喷雾法》(NY/T 1155.4—2006)进行,种子催芽和植株培养[30]后采用五氟磺草胺大田推荐剂量初筛进行预试验(数据未展示),据此设定其梯度施药剂量,以清水处理作为空白对照(表1)。使用3WP-2000型行走式喷雾塔进行茎叶喷雾处理,喷雾时扇形喷头距离稗草叶片约50 cm,喷液压力0.275 mPa,喷液量450 L·hm-2。施药后继续培养3周,第21天时称量植株地上部鲜重。每个处理至少重复3次,整个试验重复2次。
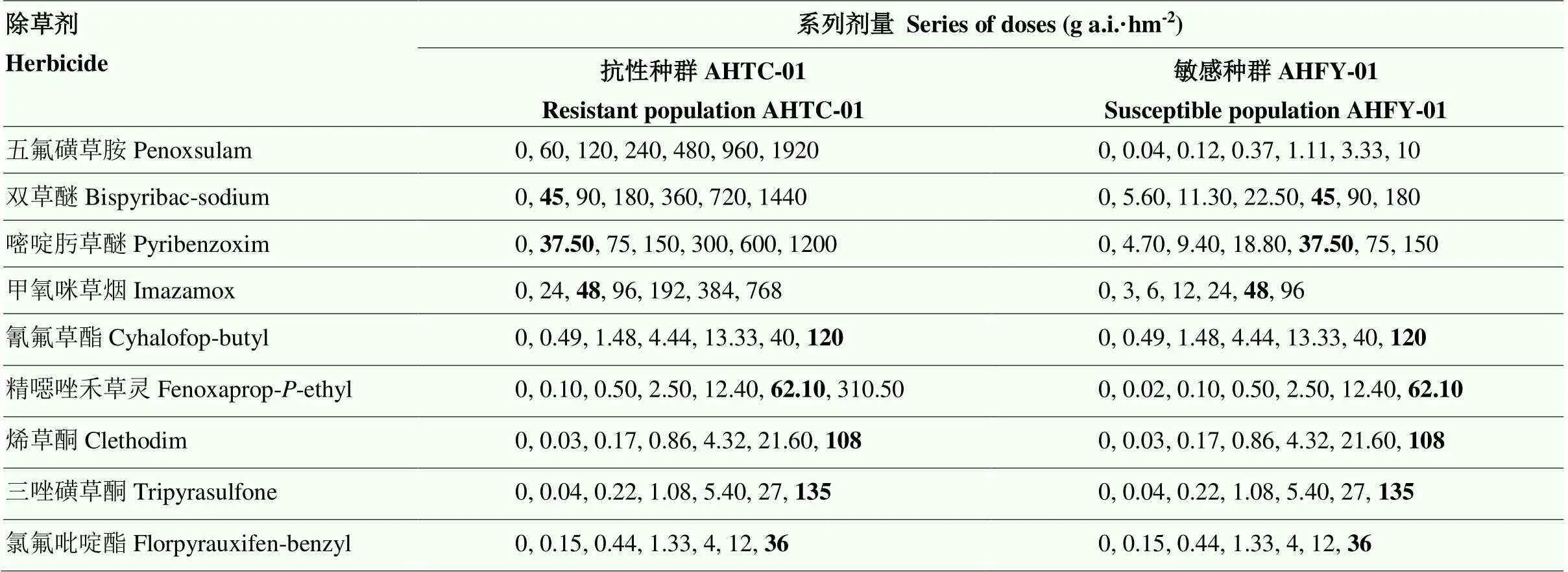
表1 整株剂量响应试验所用除草剂处理详细信息
本研究所使用各除草剂田间推荐剂量以粗体显示,其中五氟磺草胺田间推荐剂量为30 g a.i.·hm-2
The field-recommended doses for each herbicide used in this study are marked in bold, among which the field-recommended dose for penoxsulam is 30 g a.i.·hm-2
1.3.2 稗草靶标基因序列扩增和比对 DNA提取和引物信息:稗草种子萌发和生长条件同1.3.1。待稗草生长至3—4叶期,分别于抗性、敏感种群中随机选择10个单株,每株剪取约50 mg幼嫩叶片组织,采用Nuclean Plant Genomic DNA Kit提取其基因组DNA(genomic DNA,gDNA),具体操作步骤参照试剂盒说明书进行,最终样品保存于-20 ℃冰箱备用。稗草具有3个拷贝(、、),参照Iwakami等[32]报道的3对引物分别扩增每个拷贝全长序列,所得序列均包含目前已报道的8个突变位点,各引物均由南京擎科生物科技有限公司进行合成。
序列扩增和比对:以不同种群稗草单株gDNA为模板,采用 LA Taq DNA Polymerase with GC Buffer进行PCR扩增。PCR反应体系:LA Taq 0.5 μL、2×GC Buffer I 25 μL、dNTP Mixture 8 μL,Forward Primer 1 μL、Reverse Primer 1 μL、gDNA 2 μL、ddH2O 12.5 μL。参照试剂盒说明书设置PCR循环条件,其中退火温度为59 ℃,待反应结束后,于1%琼脂糖凝胶中进行电泳检测,切取目标条带并采用DNA凝胶回收试剂盒进行回收,送至南京擎科生物科技有限公司测序。以拟南芥()(GenBank登录号:AJ310767)氨基酸序列全长为基准,使用DNAMAN v6.0(Lynnon Biosoft,Montreal,QC,Canada)软件对不同稗草种群测序结果进行比对。
1.3.3 稗草相对表达差异分析 RNA提取和cDNA合成:稗草种子萌发和生长条件同1.3.1。待抗性、敏感稗草植株生长至3—4叶期,同时以田间推荐剂量(30 g a.i.·hm-2)喷施五氟磺草胺。施药前0 h和施药后12、24、48 h分别剪取各植株幼嫩叶片组织,采用Quick RNA Isolation RNA Kit提取其RNA,采用1%琼脂糖凝胶电泳测定RNA质量,采用Nanodrop 2000型分光光度计测定RNA浓度,保存于-80 ℃冰箱备用。使用HiFiScript gDNA Removal cDNA Synthesis Kit合成互补DNA(complementary DNA,cDNA),用于相对表达量分析。及内参基因引物参照Fang等[29]的报道,由南京擎科生物科技有限公司进行合成。
相对表达量测定:以五氟磺草胺处理前后不同时间点的稗草叶片cDNA为模板,采用ChamQ SYBR qPCR Master Mix进行实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)分析,具体PCR体系和循环条件均参照试剂盒说明书进行。以稗草作为内参基因对表达进行归一化,采用2-ΔΔCT法计算在不同时间点的相对表达量。在本研究中,每个时间点样品包含6个生物学重复(1株/重复),各生物学重复同时包括3个技术重复。采用SPSS v.26.0(IBM,Armonk,NY,USA)软件一般线性模型对试验数据进行ANOVA分析,当fold change>2且<0.05时判定为具有显著差异。
1.3.4 稗草抗性种群交互抗性和多抗性模式测定 稗草种子萌发和生长条件同1.3.1。待抗性、敏感稗草植株生长至3—4叶期,采用温室盆栽法在整株水平上分别测定其对3种ALS抑制剂、3种乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)抑制剂、1种4-羟基苯基丙酮酸双氧化酶(4-hydroxyphenylpyruvate dioxygenase,HPPD)抑制剂、1种合成生长素类除草剂(synthetic auxin mimic)的抗性水平(表1)。采用各除草剂大田推荐剂量初筛进行预试验(结果未展示),以明确其具体施用剂量(表1)。茎叶喷雾处理方式和结果调查方法均同1.3.1。每个处理至少重复3次,整个试验重复2次。
1.3.5 数据处理 针对所有整株剂量响应试验,以清水处理为空白对照,将各处理鲜重数据表示为空白对照相对鲜重(%)。使用SPSS v.26.0(IBM,Armonk,NY,USA)对重复试验间相同处理下的数据进行ANOVA分析,由于两组数据间无显著差异(>0.05),采用SigmaPlot v.12.3(Systat Software,Chicago,IL,USA)按照公式=+{(-)/[1+(/GR50)]^}对合并后的数据进行四参数双逻辑非线性回归分析,计算抑制50%植物生长所需除草剂剂量(GR50)。式中,为特定除草剂用量,为处理下杂草相对鲜重,为响应下限,为响应上限,为GR50处曲线斜率。
以敏感稗草种群AHFY-01为对照,计算抗性稗草种群AHTC-01对不同除草剂的抗性倍数(resistance index,RI):RI=抗性种群GR50/敏感种群GR50。根据以下标准对种群的抗药性水平进行分级:RI≥10,高抗;5≤RI<10,中抗;2≤RI<5,低抗;RI<2,敏感[33]。
2 结果
2.1 不同稗草种群对五氟磺草胺的抗性水平
五氟磺草胺田间推荐剂量(30 g a.i.·hm-2)处理后,疑似抗性稗草种群AHTC-01各植株仍然存活,其GR50为155.00 g a.i.·hm-2;敏感稗草种群AHFY-01各植株均枯萎死亡,其GR50为0.25 g a.i.·hm-2。相比AHFY-01,AHTC-01稗草种群已对五氟磺草胺产生高水平抗性,抗性倍数为620(表2)。
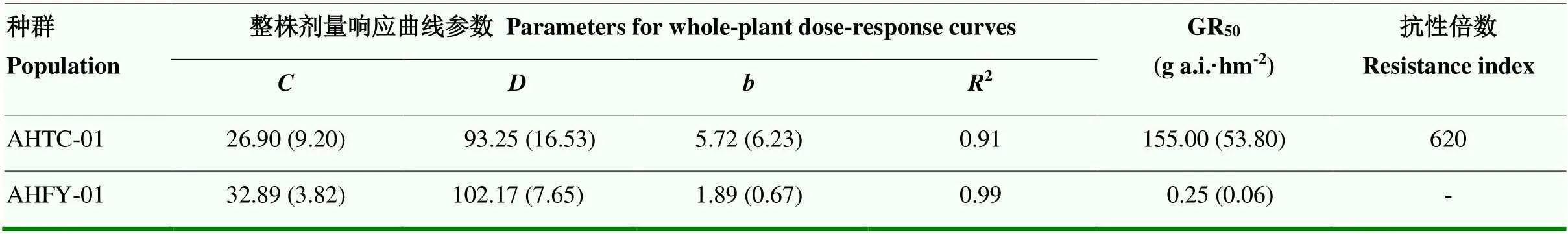
表2 不同稗草种群对五氟磺草胺的抗性水平
2.2 稗草抗性和敏感种群ALS基因序列差异
序列比对结果显示,AHFY-01种群各单株、、均未发生氨基酸突变,而AHTC-01种群各单株第574位氨基酸密码子均由色氨酸(TGG)突变为亮氨酸(TTG)(图1),其余位点均未发生突变(表3),种群单株抗性突变频率为100%。
2.3 稗草抗性和敏感种群ALS表达差异
以五氟磺草胺田间推荐剂量(30 g a.i.·hm-2)分别对稗草种群AHTC-01和AHFY-01进行茎叶处理,通过RT-qPCR分析相对表达量。结果表明在五氟磺草胺处理前(0 h)和处理后12、24、48 h,相对于敏感稗草种群AHFY-01,抗性稗草种群AHTC-01在各时间点的相对表达倍数分别为0.24、2.26、0.71、0.87(图2)。AHTC-01稗草种群在药剂处理后12 h时相对表达量为敏感种群AHFY-01的2.26倍,说明靶标基因过量表达可能是其对五氟磺草胺产生抗性的分子机制之一。
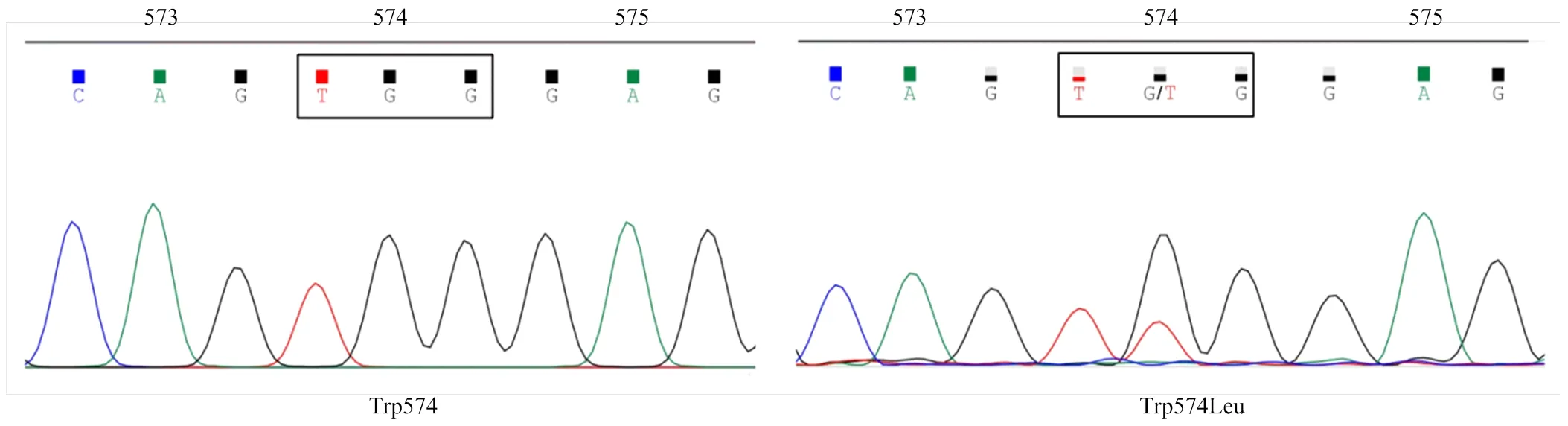
图1 稗草敏感(AHFY-01,左)和抗性(AHTC-01,右)种群靶标基因ALS2的Trp574位密码子
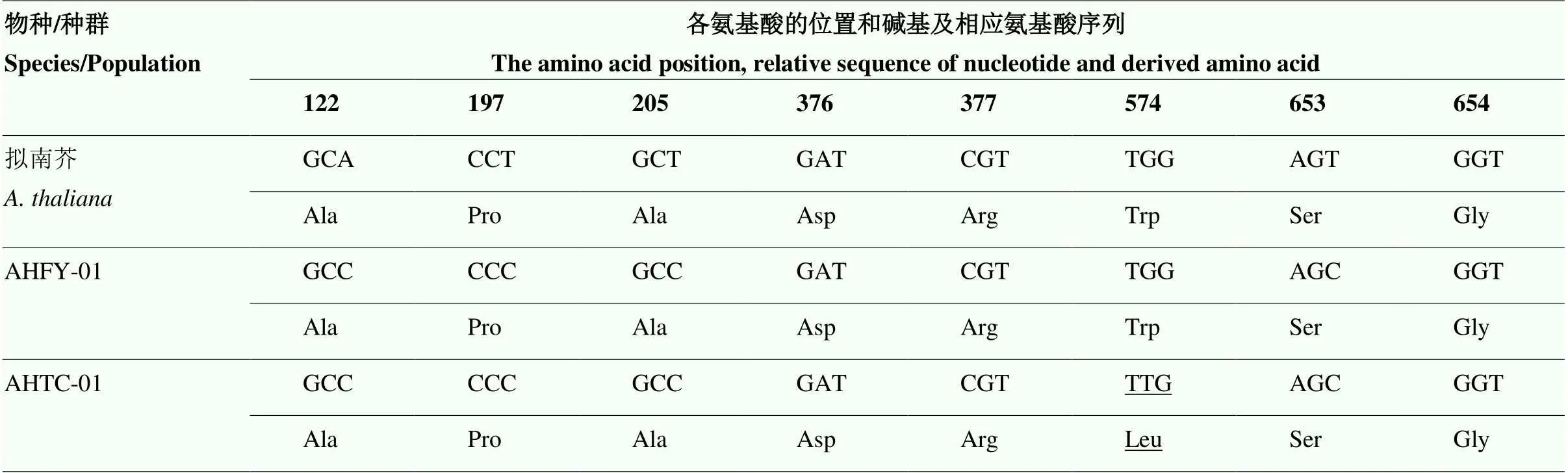
表3 稗草敏感和抗性种群ALS2序列比对
粗体表示已知可以发生抗性氨基酸的突变位点;下划线表示该种群在该位点发生氨基酸替换
All known mutation sites inare shown in bold; amino acid substitutions in specific sites are underlined
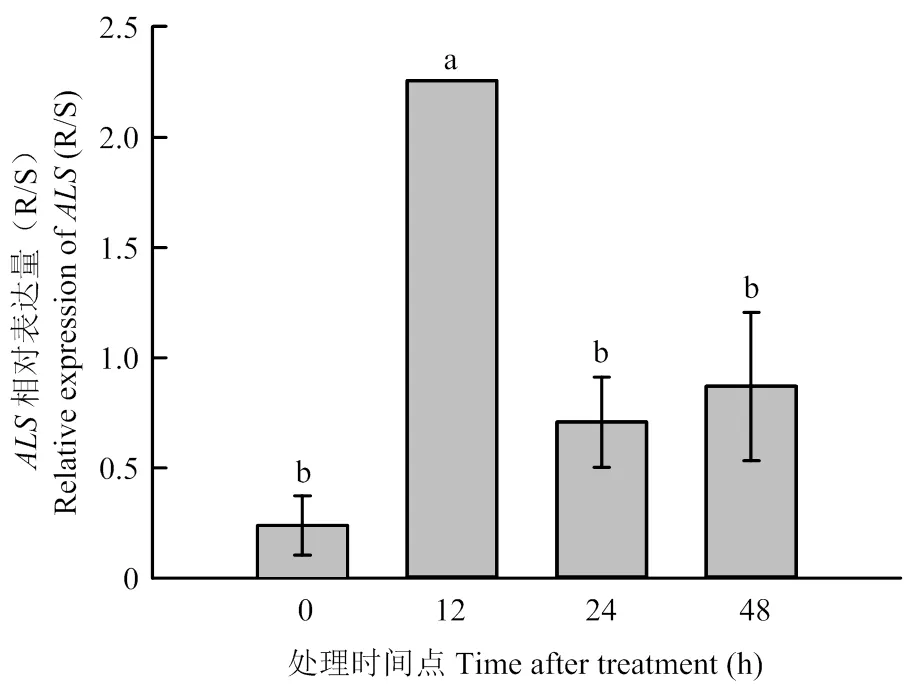
图2 稗草抗性种群ALS在五氟磺草胺处理前后相对于敏感种群的表达倍数
2.4 稗草抗性种群对其他除草剂的敏感性
整株剂量响应试验表明,稗草种群AHFY-01对所测试的8种除草剂同样较为敏感,其植株在各药剂田间剂量处理下均枯萎死亡(图3)。相比之下,抗五氟磺草胺稗草种群AHTC-01对其他3种ALS抑制剂产生交互抗性,其中对双草醚产生中等水平抗性,抗性倍数为8.24;对嘧啶肟草醚、甲氧咪草烟均产生高水平抗性,抗性倍数分别为13.36、20.36(表4)。
同时选用其他3种作用机制的5种除草剂对抗性稗草种群AHTC-01进行多抗性模式测定,结果表明AHTC-01稗草种群对ACCase抑制剂氰氟草酯、精噁唑禾草灵、烯草酮,HPPD抑制剂三唑磺草酮,以及合成生长素类除草剂氯氟吡啶酯均较为敏感(图3),其抗性倍数均低于2.00(表4)。
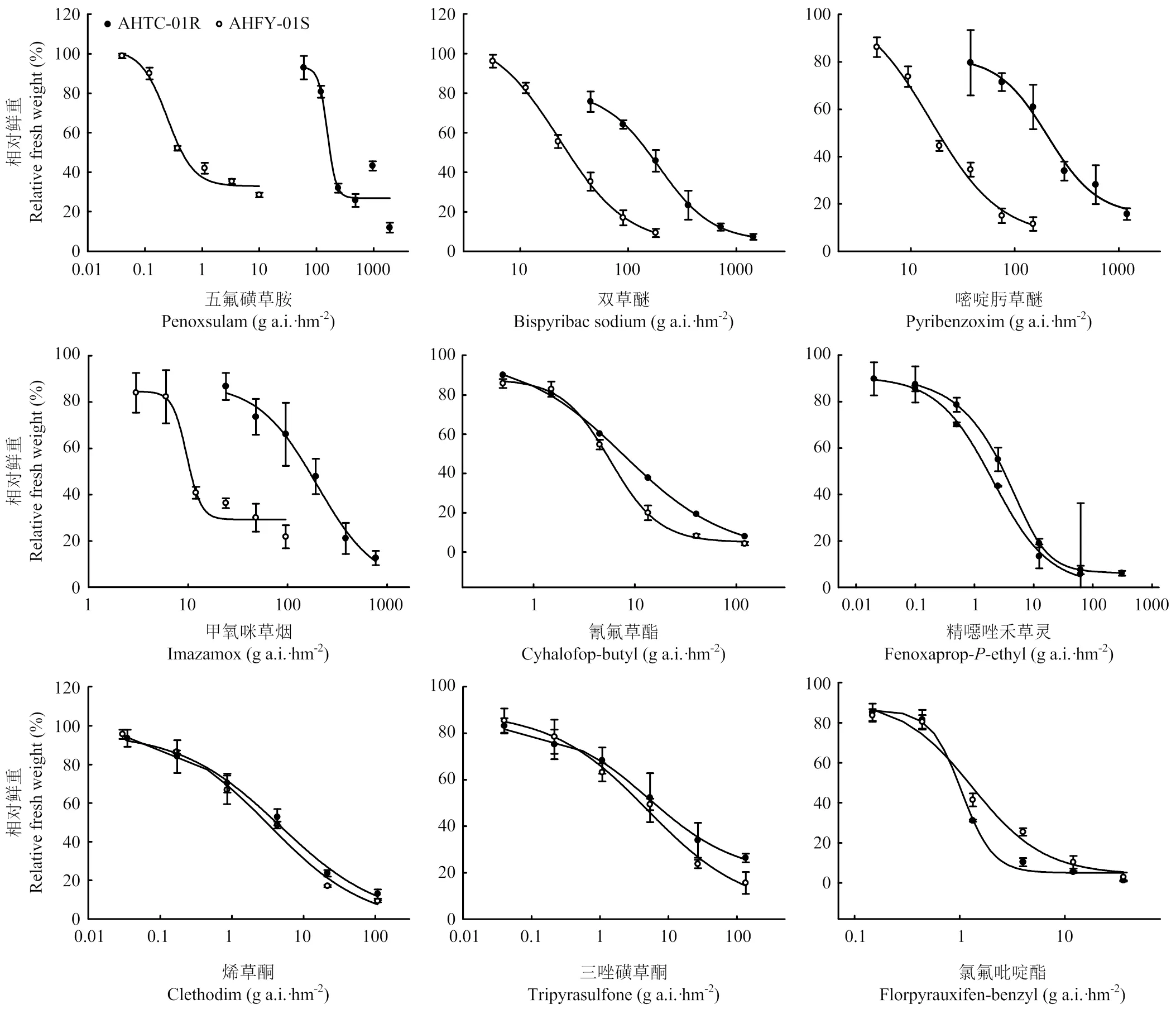
图3 稗草抗性(AHTC-01)和敏感(AHFY-01)种群相对鲜重对不同除草剂的剂量响应曲线
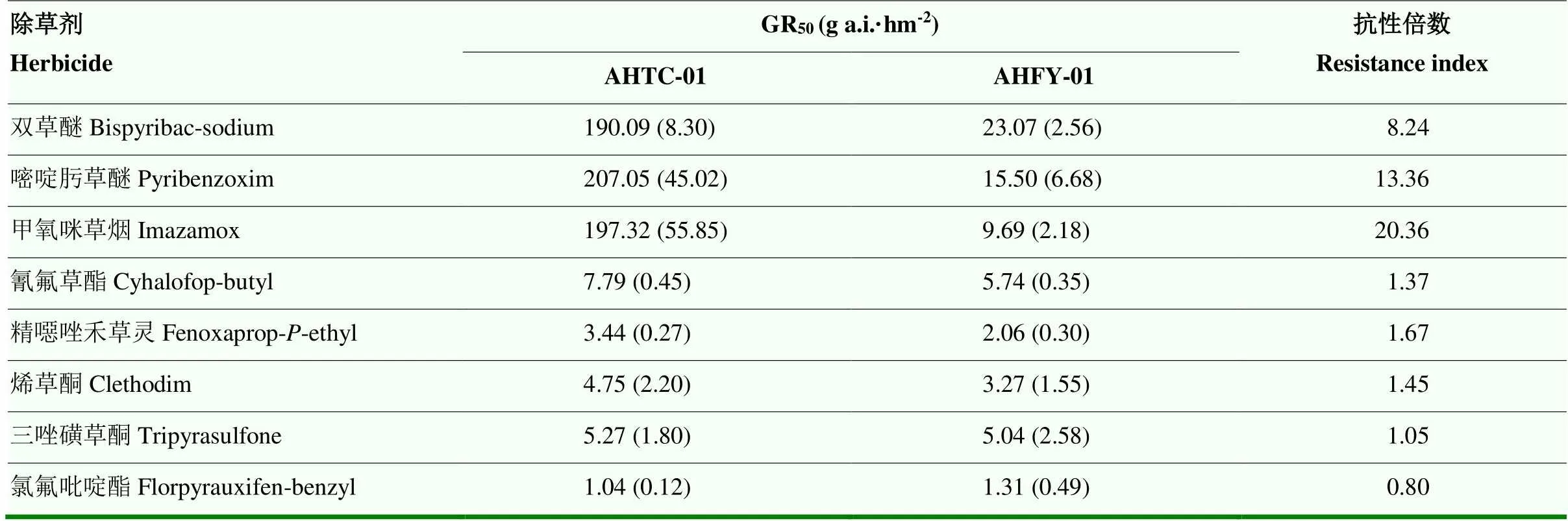
表4 稗草抗性种群AHTC-01对其他除草剂的抗性水平
3 讨论
3.1 水稻田稗草对五氟磺草胺的抗性
目前我国东北、长江中下游、华南等水稻主产区均有五氟磺草胺抗性稗草案例发生[16,34-35]。已有研究表明,作用机制单一的除草剂长期、频繁、超量使用容易诱导杂草产生抗药性[8],而ALS抑制剂类除草剂至少连续使用10次即可诱导杂草产生抗性[33]。截至2023年4月,全球已有至少171种杂草对ALS抑制剂类除草剂产生抗性,这些抗性杂草广泛分布于72个国家的97种作物田中[20]。本研究整株剂量响应试验表明,采集自安徽省天长市水稻田的稗草种群AHTC-01已对五氟磺草胺产生约620倍的高水平抗性。据前期田间调查,该种群所在田块五氟磺草胺已经连续使用超过10年,这再一次印证单一除草剂连续重复使用可以诱导杂草的抗药性发展。
3.2 稗草对五氟磺草胺的靶标抗性机理
靶标基因突变是杂草对除草剂产生抗性的主要靶标分子机制之一[19]。针对ALS抑制类除草剂,靶标基因关键氨基酸位点突变以后可以改变ALS构象,进而影响除草剂与之结合[5]。目前,已经报道了8个基因突变位点,每个位点发生的不同氨基酸替换形式均有可能导致杂草对不同ALS抑制剂产生抗性。其中,Pro197位点在不同ALS抗性杂草中突变频率最高,其次是Trp574位点和Ser653位点[36]。比如,Pro197位点发生5种突变形式和Trp574位点Leu突变是硬直黑麦草()对甲嘧磺隆和咪唑乙烟酸产生抗性的主要原因之一[37];Trp574位点Leu突变可以赋予荠菜()对苯磺隆的高水平抗性[38],也可以导致反枝苋()对烟嘧磺隆产生抗性[39]。在本研究中,稗草种群AHTC-01所检测的10个单株拷贝Trp574位点均发生了Leu突变,表明第574位突变是AHTC-01稗草种群对五氟磺草胺产生高水平抗性的重要靶标分子机制之一。
靶标基因过量表达也能够导致杂草对除草剂产生靶标抗性。以往研究表明,该类抗性机制通常导致杂草对草甘膦等灭生性除草剂产生靶标抗性[40-41]。然而目前已有研究证实,靶标基因过量表达也可以导致杂草对选择性除草剂产生抗性[42]。例如,Sen等报道过表达是贫育雀麦对啶磺草胺产生抗性的原因之一[22],Zhao等在抗甲基二磺隆的看麦娘中也鉴定到过量表达[23]。本研究中,在五氟磺草胺处理后12 h,抗性稗草种群AHTC-01相对表达量为敏感稗草种群AHFY-01的2.26倍,表明过量表达可能是AHTC-01稗草种群对五氟磺草胺产生抗性的另一主要原因。目前,仅有少数案例报道过量表达可能参与了稗草对ALS抑制剂类除草剂的抗性[24],本研究结果进一步印证了该观点。
3.3 稗草靶标基因变化导致的交互抗性模式
据报道,杂草基因Ala122、Ser653和Gly654位点发生突变后一般会对SU和IMI类除草剂产生交互抗性,Pro197位点突变以后则通常对SU和TP类除草剂产生抗性,而Ala205、Asp376和Trp574位点突变会导致杂草对ALS抑制剂5种类别除草剂均产生抗性,不过具体交互抗性模式会受到杂草种类、种群用药历史以及靶标基因是否发生过量表达等因素影响[19,33]。比如,麦田杂草麦家公()和播娘蒿()发生Trp574Leu突变以后,均能够对SU、TP、SCT、IMI和PTB产生广谱交互抗性[43-44];小飞蓬()发生Pro197Ala突变以后仅对SU类除草剂产生抗性[45],而携带Pro197Ala突变的看麦娘则对ALS抑制剂不同类别除草剂产生广谱抗性[46]。本研究中,稗草种群AHTC-01各植株均发生了Trp574Leu突变,并且对所测试的3种ALS抑制剂双草醚、嘧啶肟草醚、甲氧咪草烟均产生了中高水平交互抗性,这与相关研究结果相似[15]。Trp574位点突变能够对ALS构象产生较为显著的影响,进而容易导致杂草对ALS抑制剂类除草剂产生广谱交互抗性[5]。
3.4 ALS抗性稗草的科学防治
水稻作为半数以上世界人口的重要粮食作物,其稳收稳产关系重大。杂草是影响水稻产量的重要威胁因素之一,其中稗草危害尤为突出。本研究采集到的抗性稗草种群AHTC-01对测定的其他3种ALS抑制剂均产生了中高水平抗性,说明目前水稻田常用ALS抑制剂类除草剂已经不能有效防除该类抗性稗草。为了筛选有效的抗性稗草防治药剂,本研究选用ACCase抑制剂、HPPD抑制剂、合成激素类3种作用机制的5种除草剂,对抗性稗草种群AHTC-01进行敏感性测定。结果表明,AHTC-01稗草种群对上述5种除草剂均较为敏感。因此在水稻生产中,可以选用ACCase抑制剂氰氟草酯、HPPD抑制剂三唑磺草酮、激素类除草剂氯氟吡啶酯进行药剂复配或轮换使用,以实现对具有ALS抑制剂类除草剂交互抗性机制稗草的科学有效防除。结合土地深翻耕、作物轮作等农业措施,进一步延缓稗草抗药性的产生和发展[47-48]。
4 结论
采集自安徽省天长市水稻田疑似抗性稗草种群AHTC-01已对ALS抑制剂类除草剂五氟磺草胺产生了高达620倍的抗性,且对其他3种ALS抑制剂类除草剂产生了中高水平交互抗性。靶标基因Trp574位Leu突变和过量表达是该稗草种群对五氟磺草胺产生高水平抗性的重要分子机制之一。针对基因突变导致的抗性稗草,应尽量选择对水稻较为安全的其他作用机制除草剂,如氰氟草酯、三唑磺草酮、氯氟吡啶酯等进行科学轮换使用,实现对抗性稗草的科学治理,延缓稗草抗药性发展。
[1] GUO L, QIU J, YE C. Jin G, Mao L, Zhang H, Yang X, Peng Q, Wang Y, Jia L,.genome analysis provides insight into its adaptation and invasiveness as a weed.Nature Communications, 2017, 8(1): 1031.
[2] MAUN M A, BARRETT S C H. The biology of Canadian weeds. 77.(L.) Beauv. Canadian Journal of Plant Science, 1986, 66(3): 739-759.
[3] BAJWA A A, JABRAN K, SHAHID M, ALI H H, CHAUHAN B S. Eco-biology and management of. Crop Protection, 2015, 75: 151-162.
[4] CHAUHAN B S, JOHNSON D E. Implications of narrow crop row spacing and delayedandemergence for weed growth and crop yield loss in aerobic rice. Field Crops Research, 2010, 117(2/3): 177-182.
[5] LONHIENNE T, CHENG Y, GARCIA M D, HU S H, LOW Y S, SCHENK G, WILLIAMS C M, GUDDAT L W. Structural basis of resistance to herbicides that target acetohydroxyacid synthase. Nature Communications, 2022, 13(1): 3368.
[6] MCCOURT J A, PANG S S, KING-SCOTT J, GUDDAT L W, DUGGLEBY R G. Herbicide-binding sites revealed in the structure of plant acetohydroxyacid synthase. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 569-573.
[7] JABUSCH T W, TJEERDEMA R S. Partitioning of penoxsulam, a new sulfonamide herbicide. Journal of Agricultural and Food Chemistry, 2005, 53(18): 7179-7183.
[8] NORSWORTHY J K, WARD S M, SHAW D R, LLEWELLYN R S, NICHOLS R L, WEBSTER T M, Bradley K W, FRISVOLD G, POWLES S B, BURGOS N R, WITT W W, BARRETT M. Reducing the risks of herbicide resistance: best management practices and recommendations. Weed Science, 2012,60(SP1): 31-62.
[9] 王琼, 陈国奇, 姜英, 王庆亚, 姚振威, 董立尧. 水稻田稗属 (spp.) 杂草对稻田常用除草剂的敏感性. 南京农业大学学报, 2015, 38(5): 804-809.
WANG Q, CHEN G Q, JIANG Y, WANG Q Y, YAO Z W, DONG L Y. Sensitivity ofspecies to frequently used herbicides in paddy rice field. Journal of Nanjing Agricultural University, 2015, 38(5): 804-809. (in Chinese)
[10] 王晓琳, 牛利川, 蒋翊宸, 张卓亚, 李贵. 不同稗草种群对五氟磺草胺的敏感性差异. 杂草学报, 2017, 35(1): 8-14.
WANG X L, NIU L C, JIANG Y C, ZHANG Z Y, Li G. The sensitivity of different-populations to penoxsulam. Journal of Weed Science, 2017, 35(1): 8-14. (in Chinese)
[11] 仵奎. 硬稃稗 ()对五氟磺草胺的抗药性机理研究[D]. 南京: 南京农业大学, 2017.
WU K. Study on resistance ofto penoxsulam[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
[12] FANG J P, YANG D C, ZHAO Z R, CHEN J Y, DONG L Y. A novel Phe-206-Leu mutation in acetolactate synthase confers resistance to penoxsulam in barnyardgrass (-(L.) P. Beauv). Pest Management Science, 2022, 78(6): 2560-2570.
[13] CHEN G Q, WANG Q, YAO Z W, ZHU L F, DONG L Y. Penoxsulam-resistant barnyardgrass (-) in rice fields in China. Weed Biology and Management, 2016, 16(1): 16-23.
[14] CHEN G Q, ZHANG W, FANG J P, DONG L Y. Identification of massive molecular markers inusing a restriction-site associated DNA approach. Plant Diversity, 2017, 39(5): 287-293.
[15] FENG T Q, PENG Q, WANG L, XIE Y, OUYANG K, LI F, ZHOU H Z, MA H J. Multiple resistance mechanisms to penoxsulam infrom China. Pesticide Biochemistry and Physiology, 2022, 187: 105211.
[16] 马国兰, 刘都才, 张帅, 李新文, 刘雪源, 彭亚军, 李巳夫, 柏连阳. 稻田稗属杂草田间种群对五氟磺草胺的抗性监测. 农药学学报, 2021, 23(5): 905-914.
MA G L, LIU D C, ZHANG S, LI X W, LIU X Y, PENG Y J, LI S F, BAI L Y. Resistance detection of field populations ofspp. to penoxsulam. Chinese Journal of Pesticide Science, 2021, 23(5): 905-914. (in Chinese)
[17] 刘庆虎, 陈国奇, 张玉华, 孙仲华, 董立尧. 不同叶龄千金子、稗和马唐对氰氟草酯和五氟磺草胺的敏感性. 南京农业大学学报, 2016, 39(5): 771-776.
LIU Q H, CHEN G Q, ZHANG Y H, SUN Z H, DONG L Y. Sensitivities of,andat different leaf stages to cyhalofop-butyl and penoxsulam. Journal of Nanjing Agricultural University, 2016, 39(5): 771-776. (in Chinese)
[18] GAINES T A, DUKE S O, MORRAN S, RIGON C A, TRANEL P J, KÜPPER A, DAYAN F E. Mechanisms of evolved herbicide resistance. Journal of Biological Chemistry, 2020, 295(30): 10307-10330.
[19] POWLES S B, YU Q. Evolution in action: plants resistant to herbicides. Annual Review of Plant Biology, 2010, 61: 317-347.
[20] HEAP I. The International Herbicide-Resistant Weed Database. http:// www.weedscience.org.
[21] TRANEL P J, WRIGHT T R. Resistance of weeds to ALS-inhibiting herbicides: what have we learned?. Weed Science, 2002, 50(6): 700-712.
[22] SEN M K, HAMOUZOVÁ K, MIKULKA J, BHARATI R, KOŠNAROVÁ P, HAMOUZ P, ROY A, SOUKUP J. Enhanced metabolism and target gene overexpression confer resistance against acetolactate synthase-inhibiting herbicides in. Pest Management Science, 2021, 77(4): 2122-2128.
[23] ZHAO N, YAN Y Y, WANG H Z, BAI S, WANG Q, LIU W T, WANG J X. Acetolactate synthase overexpression in mesosulfuron- methyl-resistant shortawn foxtail (Sobol.): Reference gene selection and herbicide target gene expression analysis. Journal of Agricultural and Food Chemistry, 2018, 66(37): 9624-9634.
[24] 黄启超, 顾琼楠, 褚世海, 陈安安, 李林, 李儒海, 孙正祥. 稗18-WJJ-Ec种群对五氟磺草胺的靶标抗性机制. 江苏农业科学, 2022, 50(19): 104-110.
HUANG Q C, GU Q N, CHU S H, CHEN A A, LI L, LI R H, SUN Z X. Target-site resistance mechanism of barnyardgrass () population 18-WJJ-Ec to penoxsulam. Jiangsu Agricultural Sciences, 2022, 50(19): 104-110. (in Chinese)
[25] RIGON C A, GAINES T A, KÜPPER A, DAYAN F E. Metabolism- based herbicide resistance, the major threat among the non-target site resistance mechanisms. Outlooks on Pest Management, 2020, 31(4): 162-168.
[26] DIMAANO N G, IWAKAMI S. Cytochrome P450-mediated herbicide metabolism in plants: current understanding and prospects. Pest Management Science, 2021, 77(1): 22-32.
[27] PAN L, GUO Q S, WANG J Z, SHI L, YANG X, ZHOU Y Y, YU Q, BAI L Y. CYP81A68 confers metabolic resistance to ALS and ACCase-inhibiting herbicides and its epigenetic regulation in. Journal of Hazardous Materials, 2022, 428: 128225.
[28] YAN B, ZHANG Y H, LI J, FANG J P, LIU T T, DONG L Y. Transcriptome profiling to identify cytochrome P450 genes involved in penoxsulam resistance in. Pesticide Biochemistry and Physiology, 2019, 158: 112-120.
[29] FANG J P, ZHANG Y H, LIU T T, YAN B J, LI J, DONG L Y. Target-site and metabolic resistance mechanisms to penoxsulam in barnyardgrass ((L.) P. Beauv). Journal of Agricultural and Food Chemistry, 2019, 67(29): 8085-8095.
[30] LI Q, ZHAO N, JIANG M H, WANG M L, Zhang J X, Cao H Q, LIAO M. Metamifop resistance invia glutathione S-transferases-involved enhanced metabolism. Pest Management Science, 2023, doi: 10.1002/ps.7453.
[31] JIANG M H, WANG Y F, LI W, LI Q, ZHANG J X, LIAO M, ZHAO N, CAO H Q. Investigating resistance levels to cyhalofop-butyl and mechanisms involved in Chinese sprangletop (L.) from Anhui Province, China. Pesticide Biochemistry and Physiology, 2022, 186: 105165.
[32] IWAKAMI S, HASHIMOTO M, MATSUSHIMA K I, WATANABE H, HAMAMURA K, UCHINO A. Multiple-herbicide resistance invar., an allohexaploid weed species, in dry-seeded rice. Pesticide Biochemistry and Physiology, 2015, 119: 1-8.
[33] BECKIE H J, TARDIF F J. Herbicide cross resistance in weeds. Crop Protection, 2012, 35: 15-28.
[34] 郭文磊, 冯莉, 张纯, 张泰劼, 吴丹丹, 田兴山. 广东省水稻田稗对五氟磺草胺的抗性分析. 植物保护学报, 2020, 47(5): 1131-1138.
GUO W L, FENG L, ZHANG C, ZHANG T J, WU D D, TIAN X S. Resistance of barnyard grassto penoxsulam in rice fields in Guangdong Province. Journal of Plant Protection, 2020, 47(5): 1131-1138. (in Chinese)
[35] LIU J, FANG J P, HE Z Z, LI J, DONG L Y. Target site-based resistance to penoxsulam in late watergrass () from China. Weed Science, 2019, 67(4): 380-388.
[36] NTOANIDOU S, MADESIS P, DIAMANTIDIS G, ELEFTHEROHORINOS I. Trp574 substitution in the acetolactate synthase ofconfers cross-resistance to tribenuron and imazamox. Pesticide Biochemistry and Physiology, 2017, 142: 9-14.
[37] YU Q, HAN H, Powles S B. Mutations of thegene endowing resistance to ALS-inhibiting herbicides inpopulations. Pest Management Science, 2008, 64(12): 1229-1236.
[38] 张乐乐, 郭文磊, 李伟, 赵宁, 刘伟堂, 王金信. 荠菜对乙酰乳酸合成酶抑制剂类除草剂的抗性水平及其分子机制. 农药学学报, 2016, 18(6): 717-723.
ZHANG L L, GUO W L, LI W, ZHAO N, LIU W T, WANG J X. Resistance to acetolactate synthase-inhibiting herbicides inand its molecular resistance mechanism. Chinese Journal of Pesticide Science, 2016, 18(6): 717-723. (in Chinese)
[39] HUANG Z F, HUANG H J, CHEN J Y, CHEN J C, WEI S H, ZHANG C X. Nicosulfuron-resistantL. in Northeast China. Crop Protection, 2019, 122: 79-83.
[40] SALAS R A, DAYAN F E, PAN Z Q, WATSON S B, DICKSON J W, SCOTT R C, BURGOS N R.gene amplification in glyphosate-resistant Italian ryegrass (ssp.) from Arkansas. Pest Management Science, 2012, 68(9): 1223-1230.
[41] LORENTZ L, GAINES T A, NISSEN S J, WESTRA P, STREK H J, DEHNE H W, RUIZ-SANTAELLA J P, BEFFA R. Characterization of glyphosate resistance inpopulations. Journal of Agricultural and Food Chemistry, 2014, 62(32): 8134-8142.
[42] TRANEL P J. Herbicide-resistance mechanisms: gene amplification is not just for glyphosate. Pest Management Science, 2017, 73(11): 2225-2226.
[43] WANG Q, GE L A, ZHAO N, ZHANG L L, YOU L D, WANG D D, LIU W T, WANG J X. A Trp-574-Leu mutation in the acetolactate synthase (ALS) gene ofL. confers broad-spectrum resistance to ALS inhibitors. Pesticide Biochemistry and Physiology, 2019, 158: 12-17.
[44] DENG W, YANG Q, ZHANG Y Z, JIAO H T, MEI Y, LI X F, ZHENG M Q. Cross-resistance patterns to acetolactate synthase (ALS)-inhibiting herbicides of flixweed (L.) conferred by different combinations of ALS isozymes with a Pro-197-Thr mutation or a novel Trp-574-Leu mutation. Pesticide Biochemistry and Physiology, 2017, 136: 41-45.
[45] ZHENG D, KRUGER G R, SINGH S, DAVIS V M, TRANEL P J, WELLER S C, JOHNSON W G. Cross-resistance of horseweed () populations with three differentmutations. Pest Management Science, 2011, 67(12): 1486-1492.
[46] TANG Z, WANG Z L, WANG M L, YIN F, LIAO M, CAO H Q, ZHAO N. Molecular mechanism of resistance to mesosulfuron-methyl in shortawn foxtail () from China. Weed Science, 2023, doi: 10.1017/wsc.2023.23.
[47] COLBACH N, CHAUVEL B, DARMENCY H, DELYE C, LE CORRE V. Choosing the best cropping systems to target pleiotropic effects when managing single-gene herbicide resistance in grass weeds. A blackgrass simulation study. Pest Management Science, 2016, 72(10): 1910-1925.
[48] OSIPITAN O A, DILLE J A, ASSEFA Y, RADICETTI E, AYENI A, KNEZEVIC S Z. Impact of cover crop management on level of weed suppression: a meta-analysis. Crop Science, 2019, 59(3): 833-842.
Resistance Mechanism of Barnyard Grass () to Penoxsulam and Screening Herbicides for Its Control in Rice Fields
ZHANG LiYa1, LI Qi1, SHI ShanShan1, MA YuMeng1, LIU YaQi1, ZHAO ChaoWei1, WANG HeRu2, CAO HaiQun1, LIAO Min1, ZHAO Ning1
1School of Plant Protection, Anhui Agricultural University/Anhui Province Key Laboratory of Crop Integrated Pest Management, Hefei 230036;2Tianchang Agricultural Science and Technology Center Plant Protection Station, Tianchang 239300, Anhui
【Objective】Barnyard grass () is one of the main malignant weeds in rice fields in China. Acetolactate synthase (ALS) inhibitors, such as penoxsulam, are the main herbicides for controllingin rice fields. Previously, our research team identified a suspected penoxsulam-resistantpopulation, AHTC-01, in the main rice production area of Tianchang City, Anhui Province, China. The objective of this study is to clarify its resistance levels to major herbicides, investigate the possible resistance molecular mechanisms, and to provide a theoretical basis for the effective control of resistantand the delay of further development of herbicide resistance.【Method】Using the greenhouse potting method, the resistance levels of AHTC-01 to penoxsulam and its resistance patterns to different herbicides were determined at the whole-plant level. The target resistance molecular mechanism was explored through target gene sequencing and real-time quantitative PCR (RT-qPCR) analysis.【Result】Compared with the susceptiblepopulation AHFY-01, the suspected resistant population AHTC-01 had developed high-level resistance to penoxsulam, with a resistance index (RI) of 620. Analysis of the target-site based resistance mechanisms showed that thegene copy in the AHTC-01 population had a mutation from tryptophan (Trp) to leucine (Leu) at codon position 574, with a population mutation frequency of 100%. At 12 h after penoxsulam treatment, the relative expression level ofin the resistantpopulation AHTC-01 was 2.26 times of that in the susceptiblepopulation AHFY-01. AHTC-01 also exhibited varying levels of cross-resistance to three other ALS inhibitors, bispyribac sodium, pyribenzoxim, and imazamox, with RIs of 8.24, 13.36, and 20.36, respectively. However, it remained susceptible to other herbicides with different modes of action (MOAs), including the acetyl-CoA carboxylase (ACCase) inhibitors cyhalofop-butyl, fenoxaprop--ethyl, and clethodim, the 4-hydroxyphenylpyruvate dioxygenase (HPPD) inhibitor tripyrasulfone, and the synthetic auxin mimic florpyrauxifen-benzyl.【Conclusion】Mutation of theat amino acid position 574 andoverexpression are one of the main reasons for the resistance ofpopulation AHTC-01 to penoxsulam, which also confers cross-resistance to different ALS inhibitors. In actual agricultural production, effective control of this type of resistantcan still be achieved by rotating the use of other herbicides with different MOAs.
; penoxsulam; acetolactate synthase (ALS); gene mutation; gene overexpression; resistance pattern

10.3864/j.issn.0578-1752.2023.14.007
2023-04-11;
2023-05-14
安徽省科技重大专项(201903a06020033)、安徽农业大学人才引进科研启动项目(rc342004)、安徽农业大学大学生创新训练项目(X202210364248)
张丽雅,E-mail:3012596087@qq.com。李奇,E-mail:qigi12345@163.com。张丽雅和李奇为同等贡献作者。通信作者赵宁,E-mail:zhaon@ahau.edu.cn
(责任编辑 岳梅)

