围手术期困难气道管理的进展
朱明珠 陶 磊 张富军 罗 艳
气道管理是麻醉科日常工作的重要内容之一,困难气道管理更是麻醉科医师需掌握的核心技能之一,如何敏锐地判断困难气道的危险因素,如何有效地从设备、药品、人员到管理方案和预案的制订、组织落实,都需要有扎实的基础理论知识、熟练的临床操作技能,更重要的是理论结合实践的临床思辨能力、组织管理能力和应变能力。为此,本文将从困难气道的定义、管理思路、处理方案、管理培训等方面进行简述,以期为确保患者的围手术期安全,提升麻醉管理品质提供参考依据。
1 困难气道的定义
传统困难气道的定义是经过专业训练、有5年以上临床麻醉经验的麻醉科医师发生面罩通气困难或气管插管困难,或两者兼具的临床情况[1]。这个定义在一定程度上带有很强的医师主观性。
根据2022版ASA的《困难气道管理实践指南》[2](以下简称2022版ASA指南),困难气道指经过麻醉学培训的医师面临预期或意外的气道管理困难或失败的临床情况,包括但不限于以下情况中的1种或多种:面罩通气困难、喉镜显露困难、声门上气道通气困难、气管插管困难或失败、拔管困难或失败、有创气道建立困难或失败。
1.1 面罩通气困难 有经验的麻醉科医师在无他人帮助的情况下,经过多次或超过1 min的尝试,患者仍不能获得有效的面罩通气。根据通气的难易程度将面罩通气分为4级:1或2级为可获得良好的通气,3或4级为面罩通气困难。上述定义的医师主观性更强,且未涉及具体的麻醉方案,如是否使用肌肉松弛药(简称肌松药),使用快速起效(<60 s)或慢起效的肌松药;其中“无他人帮助”是否包括不使用任何辅助通气工具,如口咽通气道或鼻咽通气道。
1.2 喉镜显露困难 麻醉科医师于直接喉镜下经过3次以上努力仍不能看到声带的任何部分。随着可视化技术在临床中的应用和推广,越来越多的可视喉镜被用于临床常规工作中,不同设计曲度的可视喉镜亦相继问世,使喉镜显露困难的发生率大大降低。可视气管导管、可视喉罩、可视气管插管导引管的推陈出新,将医师的“眼睛”不断前移,声门暴露困难、声带暴露困难的概念也需要与时俱进地更新。
1.3 声门上气道通气困难 由于以下原因导致无法使用声门上气道工具有效通气:声门上气道工具置入困难,多次尝试置入声门上气道工具,声门上气道密闭性不佳,气体泄漏,气道阻力过高引起通气障碍。
1.4 气管插管困难或失败 无论存在或不存在气道病理改变,有经验的麻醉科医师完成气管插管均需要3次以上努力。“有经验”的定义模糊,麻醉科医师的能力与临床工作年限并不完全成正相关,而困难插管的处理经验更为重要。此外,单人连续进行3次及以上同一操作,屡败屡战、反复尝试的做法不被提倡;从减少患者气道黏膜损伤的角度考虑,麻醉科医师在临床操作中,若“二次”尝试不成功,即建议改由更高年资的医师进行后续操作。
1.5 有创气道建立困难或失败 有创气道的建立可采用切开技术或穿刺技术,其定位困难或建立困难均构成有创气道建立困难。
根据有无面罩通气困难将困难气道又分为非紧急气道和紧急气道。非紧急气道定义为仅有气管插管困难而无面罩通气困难;患者能够维持满意的通气和氧合,麻醉科医师有充分的时间考虑其他建立气道的方法。紧急气道定义为只要存在面罩通气困难,无论是否合并困难气管插管,均属紧急气道;患者极易陷入缺氧状态,必须紧急建立气道;其中少数患者“既不能插管也不能氧合(can’t intubation, can’t oxygenation, CICO)”,是目前临床上最紧急且直接影响患者生命安全的困难气道,若不能在有效时间内建立有创气道或应用体外膜肺氧合(extracorporeal membrane oxygeneration, ECMO)治疗,将导致脑损伤和(或)死亡等严重后果发生。
1.6 拔管困难或失败 术后不能在符合质量控制要求的麻醉后恢复室(PACU)停留时间内拔除气管导管,患者需带管返回ICU或病房,或建立有创气道(拔管尝试失败、非预期的二次插管),均属于拔管困难。将拔管困难纳入困难气道的概念中,是对整个围手术期气道管理认识的进步。然而,拔管困难并不仅由困难气道所致,亦有可能与气道解剖结构因素之外的手术或患者病理条件相关,故这部分内容更需要辩证分析。
2 困难气道的管理思路(将困难的变成不困难的,将非预期的变成预期的)
任何事情,预则立,不预则废,在困难气道方面更是如此。如何通过术前评估,敏锐地排查出困难气道的危险因素,在思想和实践方面做好充分的准备工作和预案,是成功应对困难气道的关键,也是对患者生命和医疗质量最基本的保障。有数据显示,面罩通气困难的发生率为1.40%~5.00%,面罩通气失败的发生率为0.07%~0.16%,插管困难的发生率为5.00%~8.00%,插管失败的发生率为0.05%~0.35%[3]。“英国皇家麻醉医师学院和困难气道协会的第四次国家审计项目”的数据显示,133例发生气道相关事件的患者中有16例死亡[4]。因此,困难气道的处理是麻醉科医师面临的挑战。
2.1 气道评估 气道评估的内容包括病史资料、体格检查和辅助检查。
2.1.1 病史资料 应了解患者的人口学特征(性别、年龄、身高、体重)和基础疾病。肥胖患者气道内外过多的脂肪组织可导致气道梗阻及气道操作困难,且肥胖患者对缺氧的耐受能力下降[5]。孕产妇的上呼吸道血运丰富,易发生出血和水肿,从而导致气道损伤;同时,孕产妇反流误吸的发生风险增加,功能残气量下降和需氧量上升,使得麻醉科医师建立气道的尝试次数受限(气道黏膜易发生出血和水肿等损伤)、建立气道的时间受限(需氧量上升,不耐受建立气道过程的窒息和缺氧)、气道工具选择受限(因存在反流误吸的风险,不适合声门上工具)[6]。阻塞性睡眠呼吸暂停的发生与气管插管困难和面罩通气困难相关[7]。糖尿病患者困难气道发生风险增加的影响因素包括肥胖、颈围大和关节僵硬[8]。各种原因引起的气道狭窄、气道内异物或肿瘤阻塞、气道外组织压迫均为麻醉科医师进行气道管理面临的严峻考验[9-10]。颞下颌关节功能紊乱、强直性脊柱炎、退行性骨关节炎、头面部或颈部外伤引起的下颌关节或颈部活动度受限可导致困难气道[11-12]。此外,一些医源性因素也对气道管理造成困难,如头面部放射治疗(简称放疗)和化学治疗(简称化疗)可导致气道解剖结构异常,神经外科使用的头部定位支架可影响患者的颈部活动度及医师的气道操作空间等。见图1。
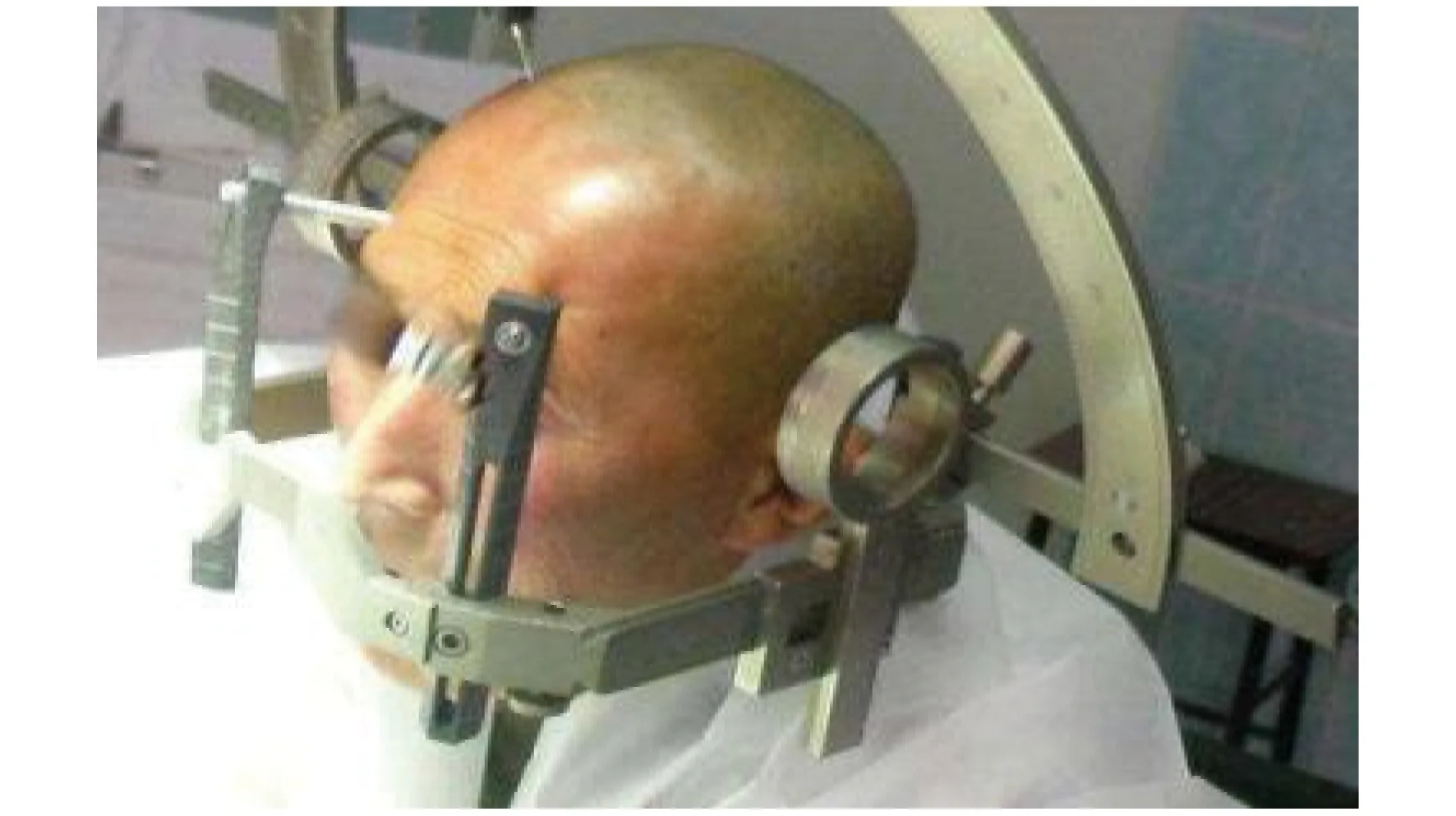
图1 头部定位支架外观图
2.1.2 体格检查 体格检查项目包括面部特征(张口度、凸颌、头颈部活动度、上门齿突出、络腮胡、咬上唇试验)和测量体表标志(甲颌间距、胸颌间距、舌颏间距、上下门齿间距、颈围等)。2019年Detsky等[13]的研究结果显示:咬上唇试验、舌颏间距过短、下颌后缩和多项体格检查的综合Wilson评分与困难气道的阳性似然比分别为14.0、6.5、6.0和9.1,而改良马氏分级≥Ⅲ级的阳性似然比为4.1。此前2018年Roth等[14]的一项Cochrane系统综述同样显示,在马氏分级、改良马氏分级、Wilson风险评分、甲颌间距、胸颌间距、张口度和咬上唇试验中,咬上唇试验对困难气道具有最佳诊断价值。此外,头面部的畸形亦提示可能存在困难气道。
2.1.3 辅助检查 X线摄片、CT和MRI检查可显示气道及其比邻结构的解剖学特征。超声作为一种无创的诊断工具,可用于测量气道相关参数,从而预测困难气道危险性,指导并选择气道工具的尺寸,在气道评估中的作用逐渐突显[15]。2022年Carsetti等[16]的一项关于气道超声对困难气道预测价值的荟萃分析结果显示,直视喉镜显露困难患者的皮肤至会厌的距离(DSE)、皮肤至舌骨的距离(DSHB)和皮肤至声带的距离(DSVC)均较大,其灵敏度分别为0.82、0.71和0.75,特异度分别为0.79、0.71和0.72。另一项研究[17]结果表明,舌基底部厚度>50 mm对于面罩通气困难具有预测价值。此外,可视喉镜、纤维支气管镜、三维(3D)打印技术在气道评估中应用亦有报道,但其获益尚不明确[2]。
2.2 困难气道的预测因素 2021年Heidegger[3]的一篇关于困难气道的综述对不同类型困难气道的预测因素予以归纳。面罩通气困难的危险因素:络腮胡或其他影响面罩气密性的因素、男性、缺牙、年龄>50岁、下颌前伸受限、改良马氏分级Ⅲ或Ⅳ级、BMI>26 kg/m2、酣症或阻塞性呼吸暂停睡眠通气障碍、颈部放疗史和困难插管史。可视喉镜气管插管困难的危险因素:张口度受限、口腔内有血液或呕吐物、下颌前伸受限、甲颌间距过短、有颈部放疗史或手术史、颈部疾病、颈部活动度受限、颈粗、肥胖、直视喉镜下Cormack-Lehane分级3或4级,以及医师缺乏可视喉镜的操作经验。声门上工具置入困难的危险因素:张口度受限、上气道阻塞或畸形、颈部活动度异常、施行环状软骨加压、BMI>29 kg/m2。颈前气道困难的危险因素:女性、年龄<8岁、颈粗、肥胖、气管移位、重叠异常(放射损伤或组织硬化)和颈部活动度异常。
3 困难气道的处理方案(从设备到药品, 从人员到团队,从方案到预案)
困难气道可分为预期和非预期。对于预期的困难气道,应做好充分的处理预案,面临面罩通气困难、气管插管困难、有创气道建立困难等情况时,需做好预充氧、清醒插管、无创气道、复合技术、有创气道及唤醒患者等准备。对于非预期的困难气道,应及时寻求帮助,努力维持通气和氧合是关键。可利用低流量或高流量鼻导管为预期或非预期困难气道患者供氧。见图2。

图2 困难气道处理流程[1]
2022版ASA指南为麻醉科医师提供了困难气道处理流程,并对2013版指南进行了更新。两版指南中均包括清醒插管流程和麻醉诱导后气道管理流程。而关于两者之间如何选择,其中2022版指南增加了决策流程图:若患者存在面罩通气困难、声门上气道通气困难、反流误吸风险或氧饱和度快速下降的发生风险中的任何1项,应选择清醒插管,其他情况可在麻醉诱导后进行气道管理。两版指南在清醒插管的流程中均提及清醒无创插管和有创气道插管,2022版指南对有创气道插管的时机进行了区分,即直接选择择期有创气道插管,或清醒插管失败且患者情况不稳定时选择紧急有创气道插管。
在麻醉诱导后气道管理的流程中,2022版指南更加强调了评估通气的重要性,并将2013版指南中的“面罩通气是否足够”更新为“通气是否足够(任何气道技术)”。2022版指南取消了2013版指南中先尝试面罩通气,再尝试声门上工具通气的顺序,改为不同气道技术可交替尝试,但是强调每种技术的尝试次数不应超过3+1次(+1指由气道管理技术更优的医师再尝试1次),期间应关注建立气道所消耗的时间和患者的氧合情况。若通气能够维持,考虑寻求帮助,三大方案为替代气道方案、有创气道或唤醒患者;若通气难以维持,应立即寻求帮助,建立紧急气道,力争恢复通气,三大方案为面罩通气、声门上气道通气和气管插管。在通气失败的情况下,两版指南均将有创气道作为最终选择,2022版指南补充了使用硬质支气管镜和ECMO[2,18]。
根据2018年《成人重症患者气管插管管理指南》建议,成人重症患者困难气道插管的准备内容包括患者的准备,设备和(或)药品的准备,人员团队的准备、方案的准备。①患者的准备,取得患者充分的理解,消除其焦虑恐惧情绪,使清醒插管具有可行性。若患者无法理解和配合,建议采用麻醉镇静,安全可靠。②设备和(或)药品的准备, 设备包括常规设备和特殊设备,如可视化设备、有创穿刺包、硬质支气管镜和ECMO等;药品与麻醉方案无法分割,必须充分明确所采用的麻醉镇静方案中使用哪一类药物,建议选择药代动力学方面具有快速起效、快速消退特性的药品。此外,需准备好急救药、拮抗药,对于采用肌松药诱导插管的患者,建议给予罗库溴铵,同时备好舒更葡糖钠,以备紧急逆转肌肉松弛(简称肌松)。③人员团队的准备,明确第一插管操作者、第二插管操作者(辅助者)、现场协调者等,分工明确,各司其职,统一指挥,团队协作。④方案的准备,包括麻醉方案、插管方案,以及预案,即如设定的首选方案未成功,能立即启用其他方案。成人重症患者困难气道插管需由整个团队来实施[19],插管核对清单见表1。

表1 成人重症患者困难气道插管核对清单[19]
4 困难气道管理的培训(最熟悉的是最安全的)
从团队人员培训角度出发,需要常态化进行包括困难气道等在内的相关培训课程,只有将这些基本理念植根于日常工作,才能第一时间发现困难气道的潜在风险,并加以规避。在困难气道管理方面,很多操作技能、新型设备和设施需要每一位团队人员从日常工作和培训中熟悉并达到操作熟练的程度,在关键的时候发挥作用。对于从未进行过纤维支气管镜操作的医师,在面对困难气道的紧急情况下,可能无法顺利完成操作。对于麻醉科医师而言,使用最熟悉的操作技术是最安全、有效的。
在使用众多的困难气道处理工具(如视可尼可视喉镜、纤维支气管镜等)时,需要针对不同疾病的特点,充分发挥建立气道工具的优点,化繁为简,因势利导。神经外科使用的头部定位支架,因解剖定位存在差异,头架固定后,有的患者口唇上部几乎无面罩可置入的空间。对于这类情况,可在麻醉诱导后先置入插管型喉罩,解决通气问题,待诱导药物完全起效后,在最大限度地确保患者氧供的前提下,行喉罩引导下的气管导管置入术[20]。见图3。
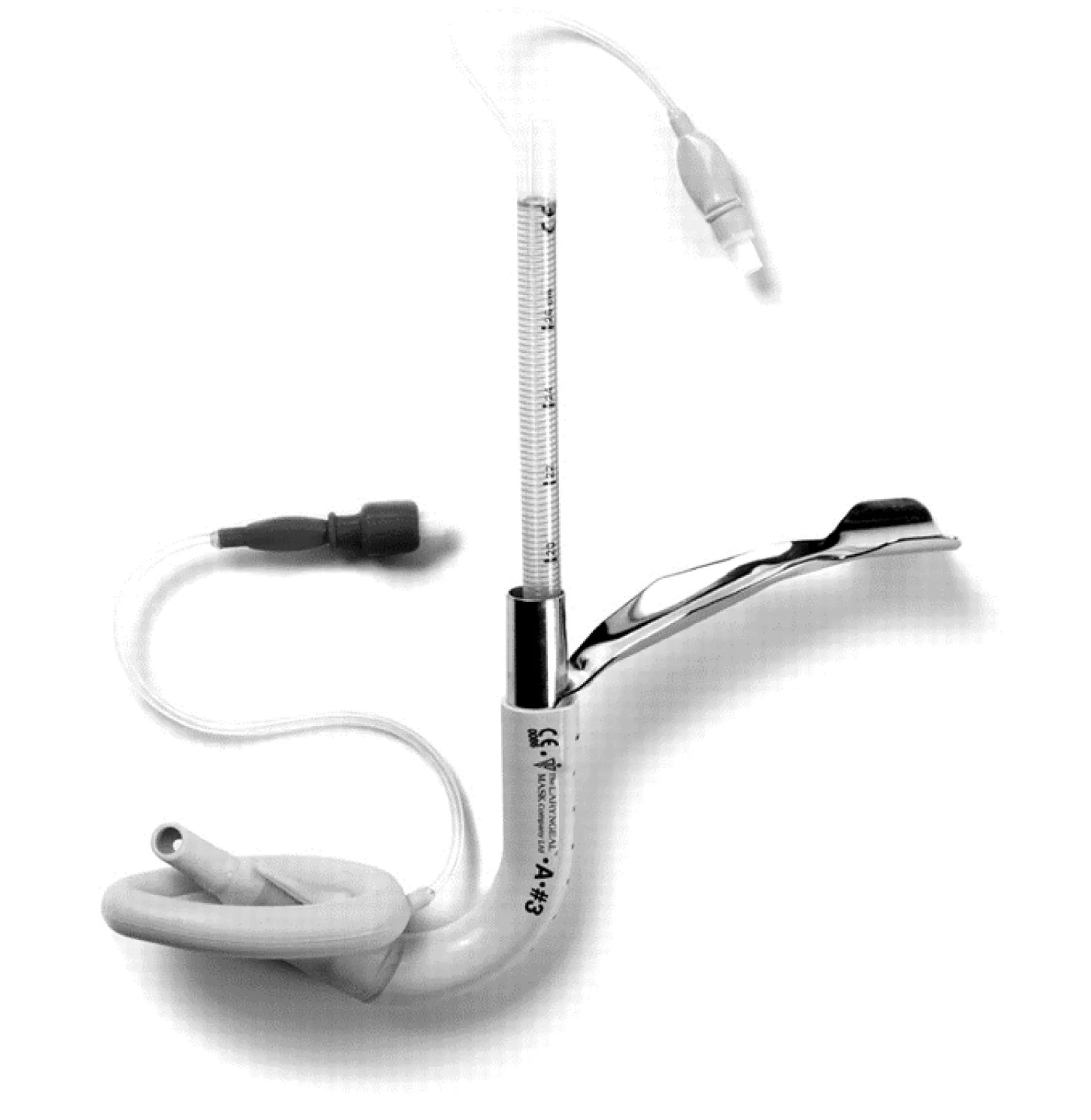
图3 插管型喉罩
培训内容还应包括如何辨析困难气道的危险因素,敏锐地排查危险因素,将非预期困难气道变为预期困难气道,以提升患者安全保障系数。
5 人工智能在困难气道管理中的应用
随着人工智能技术和系统的发展,其在困难气道管理中发挥越来越重要的作用,具体如下。①预测气道难度:人工智能可通过分析病历资料、影像学检查结果、生理参数等,预测患者的气道难度,帮助麻醉科医师进行充分的准备并制订处理方案。②辅助气管插管:人工智能可通过分析图像数据,辅助医师进行插管操作,减少操作过程中建立气道失败(可致窒息和缺氧)和并发症(如呼吸道损伤)的发生风险,缩短插管时间。③气道管理:人工智能可通过分析患者的生理参数、呼吸模式等信息,自动调节呼吸机参数,提供气道管理建议,辅助医师进行气道管理,以达到最佳的呼吸支持效果。④模拟培训:人工智能可提供虚拟模拟环境,帮助医师练习对困难气道的处理和管理,提高其应对突发情况的能力。
综上所述,困难气道是麻醉科医师面临的挑战,通过细致入微的术前评估,充分的术前准备,有效发挥团队协作能力,创新探索,提高困难气道处理的成功率,减轻患者的痛苦,减少缺氧所致死亡或永久性脑损伤、气道损伤等发生,提高医疗质量和安全性,为患者提供最佳的安全保障和转归。

