福建省牡蛎疱疹病毒(OsHV-1)的检测与分析
贾圆圆
(平潭综合实验区农业农村发展服务中心,福建 福州 350400)
牡蛎享有“海中牛奶”之美称,其肉质鲜美、营养丰富,是一种高蛋白、低脂肪的健康海洋贝类[1]。牡蛎已成为中国乃至世界重要的水产养殖贝类,据2022年《中国渔业统计年鉴》,中国牡蛎2021年养殖产量高达581.9×104t,占海水贝类养殖产量的三分之一以上,其中福建省牡蛎养殖产量为211.2×104t,约占全国的36.29%,居全国首位[2]。随着牡蛎养殖产业的不断扩大,牡蛎养殖病害问题日益严重。近年来,由牡蛎疱疹病毒1型 (Ostreid herpesvirus- 1,OsHV-1)引起的贝类大规模死亡事件给贝类养殖业带来重大经济损失[3]。
OsHV-1通称牡蛎疱疹病毒,隶属疱疹病毒目(Herpesvirales)、软体动物疱疹病毒科(Malacoherpesviridae)、牡蛎疱疹病毒属(Ostreavirus),是首个被发现的能够感染无脊椎动物的疱疹病毒[4]。OsHV-1的感染宿主范围较广,能够引起牡蛎、扇贝、蛤仔、蚶类等双壳贝类的感染和死亡,其中牡蛎是受OsHV-1危害最严重的贝类[3],研究[5]发现OsHV-1会感染牡蛎从贝苗到成贝的各个阶段,通常幼贝的发病率和死亡率高于成贝。被OsHV-1感染发病的贝苗表现为活力减弱和食欲降低,症状出现5~6 d后开始死亡,通常于10 d内全部死亡[6]。成贝发病后表现为食欲下降、闭壳肌收缩缓慢、黏液分泌增加等,死亡率较幼贝略低[7]。牡蛎疱疹病毒感染牡蛎各生长阶段的感染部位差别不大,病变组织主要集中在外套膜、生殖腺等器官的结缔组织上[8]。
OsHV-1的检测方法一般分为形态学检测和分子学检测两种。形态学检测主要通过光镜和透射电镜观察样本的组织病理变化和病毒粒子形态结构,1972年,Farley C A等[4]通过电镜首次发现了牡蛎疱疹病毒。形态学检测方法具有操作难度大、技术要求高及低病毒量时不易检出等特点,一般需结合分子学技术确诊[3,9]。分子学检测方法主要包括PCR技术、原位杂交技术、环介导等温扩增(Loop-mediated isothermal amplification,LAMP)技术等。PCR诊断技术具有特异性强、灵敏度高和检测速度快等特点,已成为牡蛎以及其他水产动物疫病的主要检测手段,且普通PCR、实时荧光定量PCR已成为OsHV-1的常用检测方法。与普通PCR相比,实时荧光定量PCR能够精确检测病毒的感染量,因而被越来越多地应用到OsHV-1的检测中。本文通过普通PCR和实时荧光定量PCR等分子生物学手段对福建省具有一定代表性的牡蛎育苗场和主要成贝养殖海区的牡蛎开展检测,以期为牡蛎疱疹病毒的分子学检测及其防控方法的建立提供参考。
1 材料与方法
1.1 实验材料
样品采集于2020年3—5月,在福建省漳浦、诏安和莆田地区分别采集A育苗场长牡蛎(Crassostreagigas)苗5个样本,编号1~5;B育苗场长牡蛎苗样本5个,编号6~10;C育苗场福建牡蛎(C.angulata)苗样品5个,编号11~15;D育苗场福建牡蛎苗样品5个,编号16~20;E育苗场福建牡蛎5个,编号21~25;F育苗场福建牡蛎样品5个,编号26~30。成贝采集于平潭海区、深沪湾海区和漳浦海区,每个海区采集牡蛎样品20个。样品取回后,于实验室-80 ℃冰箱冻存(表1)。
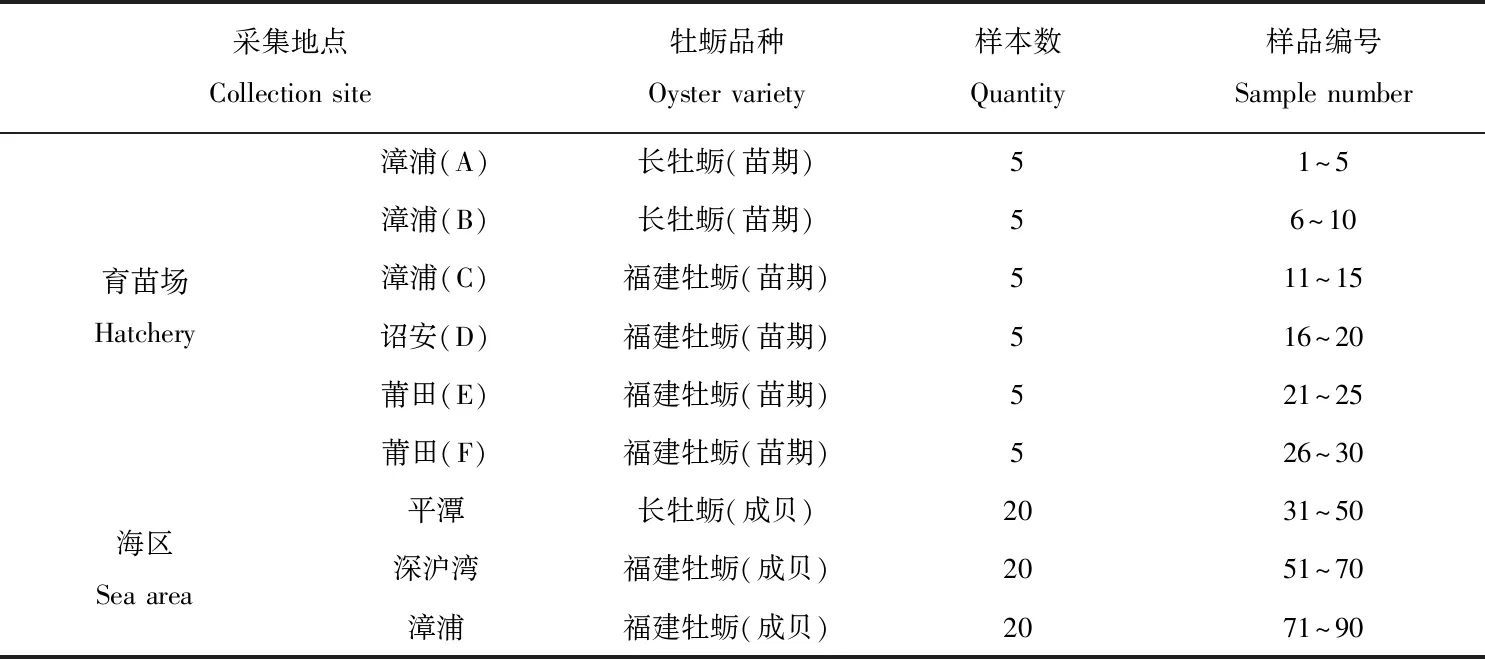
表1 样品采集信息表
1.2 引物合成
普通PCR引物的选取根据世界动物卫生组织水生动物诊断手册推荐使用的C2/C6特异性引物,该引物在普通PCR检测OsHV-1中应用最早、最广泛,其扩增目的片段大小约700 bp,由上海美吉生物公司合成(表2)。
实时荧光定量PCR引物的选取根据世界动物卫生组织推荐,借鉴Martenot C等[10]在TaqMan探针实时荧光定量PCR反应中使用的BF/B4引物及B-P探针。
1.3 DNA模板的提取
称取30 mg牡蛎样本于1.5 mL无菌离心管中;加入Buffer ML1 350 μL、Pro K 25 μL,涡旋震荡30 s,60 °C温育1 h;加入氯仿∶异戊醇=24∶1的混合液350 μL,涡旋震荡20 s,高速离心2 min(10 000 g),取上清液250 μL至新的1.5 mL无菌离心管中;加入Buffer MBL 250 μL,涡旋震荡15 s,70 °C温育10 min;加入无水乙醇250 μL,涡旋震荡15 s;取混合液700 μL转移至柱子+2 mL收集器的组合中,高速离心1 min(10 000 g),弃液体,收集管重复利用;加入HB Buffer 500 μL,高速离心30 s(10 000 g),弃滤液;加入DNA Wash Buffer 700 μL,高速离心1 min(10 000 g),弃滤液;加入DNA Wash Buffer 700 μL,高速离心2 min(15 000 g),弃滤液;将柱子放入1.5 mL无菌离心管中,加入60 °C预热的Elution Buffer 50 μL于柱子底部,室温静置2 min,高速离心1 min(10 000 g),收集洗脱液;重复上一步,收集的洗脱液即为提取的DNA模板,立即用于实时定量PCR或保存于-20 ℃冰箱中待用。

表2 合成的引物序列
1.4 普通PCR反应和电泳检测
从冰箱中取出冻存的待检测的DNA样品1~90为模板,加入水样为空白对照,通过普通PCR反应扩增OsHV-1基因,反应体系如表3所示。在PCR仪上通过如下程序进行扩增:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环。通过1%琼脂糖凝胶电泳(电压120 V、20 min)对得到的PCR产物进行检测,凝胶成像仪中观察结果。
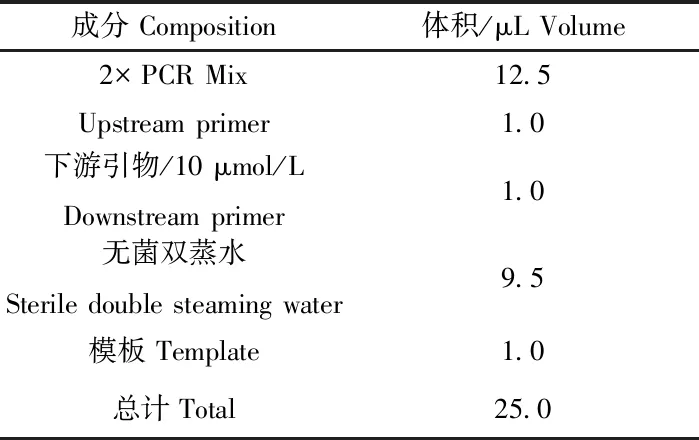
表3 普通PCR反应体系
1.5 实时荧光定量PCR检测
由于实时荧光定量PCR对低病毒载量的检测不敏感[11],本文根据普通PCR电泳结果,选取A、B、C育种场中电泳条带最亮的3个阳性样本进行实时荧光定量PCR检测。在PCR仪上通过如下程序进行扩增:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 20 s,40个循环。反应体系见表4。
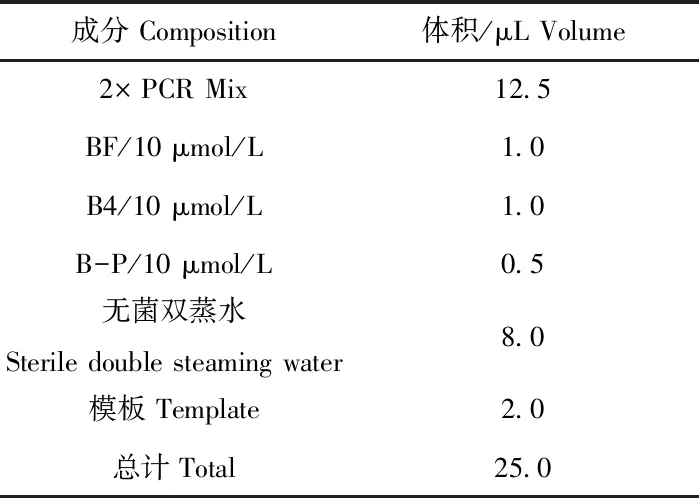
表4 实时荧光定量PCR反应体系
2 结果与分析
2.1 普通PCR电泳检测结果
将提取的OsHV-1片段通过普通PCR扩增、1%琼脂糖凝胶电泳,结果如表5、图1所示。电泳结果显示,1~3、8~9、11~12、86~88样本均在700 bp处出现电泳条带,与目的条带大小一致。其中1~3、8~9、11样本中目的条带较亮,12、86~88样本出现微弱的电泳条带,与目的条带大小一致,其他样本中未检测出目的电泳条带(图1)。由表5可知,A、B、C育苗场和漳浦海区均检测出OsHV-1,A育苗场阳性检出率高达60%,B、C育苗场阳性检出率均为40%,漳浦海区阳性检出率为15%。此次检测的90个样本中,阳性检出约10个,平均阳性检出率为11.11%,其中幼苗样本30个,平均阳性检出率为23.33%,高于成贝5%的平均阳性检出率。
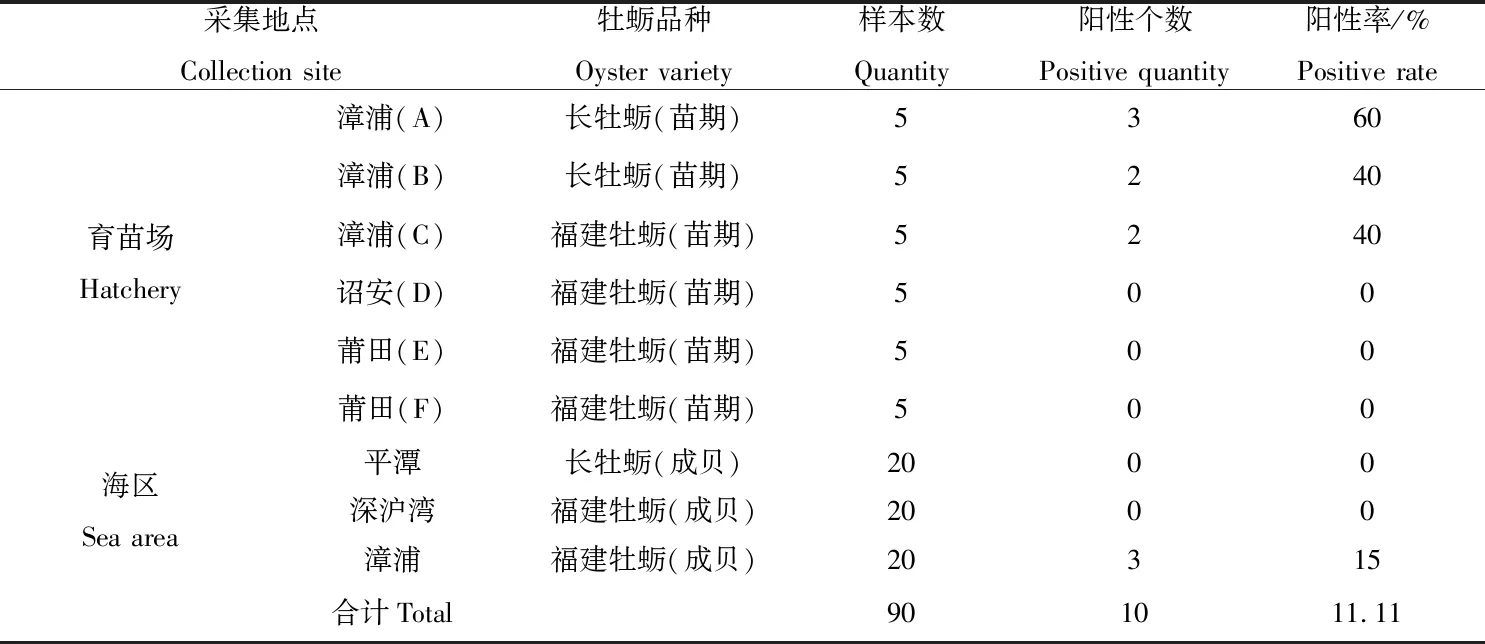
表5 普通PCR电泳检测结果
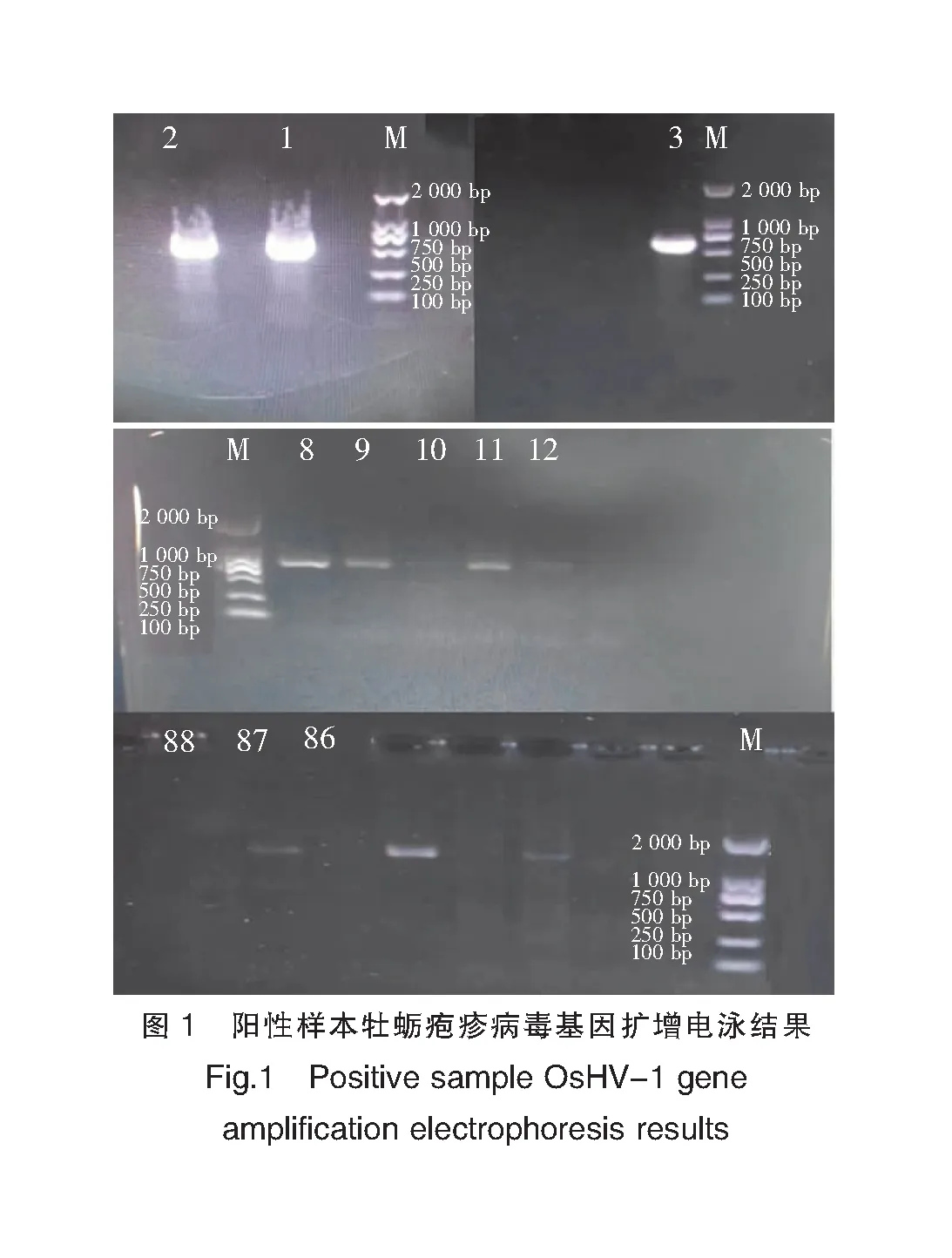
注:M为Marker;1~5为漳浦A育苗场长牡蛎样品;8~10为漳浦B育苗场长牡蛎样品;11~15为漳浦C育苗场福建牡蛎样品;86~88为漳浦海区福建牡蛎成贝样品。
2.2 实时荧光定量PCR结果
选取A、B、C育苗场中电泳条带最亮的2、8、11三个阳性样本进行实时荧光定量PCR检测,检测其取样点的病毒最大拷贝数,结果如表6所示,2、8样品长牡蛎的OsHV-1病毒感染量分别约为6.1×107、3.5×102copies/mg,11样品福建牡蛎的OsHV-1病毒感染量约为3.7×102copies/mg。

表6 实时荧光定量PCR检测结果
3 讨论
琼脂糖凝胶电泳是通过琼脂凝胶的分子筛作用,分子量或分子形状不同的核酸片段在电泳过程因移动速度不同而分离,通过电泳结果中产生的条带强度可大致了解样品中DNA的数量[12]。彭桂庄等[13]实验发现电泳中条带的明亮度与所测目的基因的浓度有关,电泳条带的亮度随着浓度的增大而增大。本研究结果显示1~3、8~9、11样本的牡蛎感染了OsHV-1,12、86~88样本条带微弱,因此上述牡蛎样本虽然感染了OsHV-1,但其感染量相对较低。Oden E等[11]研究结果显示,OsHV-1感染引起的宿主发病和死亡状态主要与病毒在宿主内的感染量相关,当病毒感染量低于8.8×103个/mg组织时,宿主通常保持无症状感染状态,当感染量继续增加,宿主则会发病或死亡。本文检测结果显示,2样本感染的OsHV-1病毒感染量高达6.1×107copies/mg,8、11样品的病毒感染量较低,分别为347.9、368.9 copies/mg。因此A育苗场1~3样品长牡蛎苗种的死亡可能由OsHV-1感染引起发病所造成的,OsHV-1感染不是造成B、C育苗场牡蛎苗种死亡的主要原因。
此次检测的90个样本中,阳性检出10个,平均阳性检出率为11.11%。其中牡蛎幼苗样本30个,平均阳性检出率为23.33%,高于牡蛎成贝5%的平均阳性检出率,这与于江南[14]的研究结果类似。漳浦海区的福建牡蛎成贝虽然有部分检测出OsHV-1病毒,但电泳条带极其微弱,电泳条带亮度远低于A、B、C 三个育苗场的阳性样本亮度,成贝中OsHV-1含量均很低。Barbosa V等[15]和Lopez M等[16]对长牡蛎和福建牡蛎的流行病学调查也显示,成贝往往无临床症状,其病毒含量大多在103copies/mg以下,因此漳浦海区的牡蛎虽然感染了OsHV-1,但其不会对牡蛎的生长造成影响。本研究检测的牡蛎样本取自漳浦、诏安、泉州、莆田、平潭5个地区,结果显示牡蛎阳性检出点均位于漳浦地区,这可能与漳浦地区为福建主要的牡蛎苗种生产地有关,牡蛎苗种生产企业较多,一旦出现OsHV-1感染,则容易发生交叉感染;其次阳性感染也可能与亲本携带有关,三家阳性检出育苗场的亲本来自不同地区。
4 牡蛎疱疹病毒的防控与建议
由于贝类多在开放海域养殖,这给贝类相关疾病的防控带来了难度。OsHV-1的防控主要有以下几点建议:1)开展育苗前的消毒工作。可通过海水加热(50 ℃、5 min)、紫外线照射(10 min)、次氯酸钠(0.05 g/L、15 min)、福尔马林(40 g/L、30 min)等物理和化学方式杀灭海水中的OsHV-1。2)对育苗海水进行处理。海水中的浮游生物、组织碎片也能成为病毒的携带者,5 μm滤孔过滤海水可有效防止贝类感染[7]。Hick P等[17]研究发现,OsHV-1可以在海水中存活2 d,因此抽取的海区海水在育苗场静置2 d可有效降低病毒的存活率。3)开展亲贝的检测。随机选取待使用的亲贝或者对亲本热应激(21 ℃、2~3周)后[18],进行PCR检测,选取不携带病毒的亲本可有效降低苗种感染率。4)干露可降低已感染的海区养殖贝类的死亡率。尤其能提高成贝的成活率,但对幼贝效果不明显[7]。5)选育抗OsHV-1的新品系。De Lorgeril J等[19]对15个长牡蛎家系开展人工感染实验,结果显示家系之间的感染率(0%~97.4%)差别较大,这为病毒的选育提供了可能。Bai C M等[20]也在自然海区中发现了对OsHV-1不敏感的长牡蛎。因此建议牡蛎育苗企业在购买亲本或苗种时,选购健康的亲本进行育苗,育苗前开展相应的OsHV-1检测及处理;牡蛎养殖户选购已开展OsHV-1检疫的生产厂家苗种,为牡蛎育苗及养殖做好保障工作。
——漳浦小记者参观黄道周纪念馆

