盐碱胁迫下产ACC 脱氨酶促生菌对绿豆插条生根的作用
李 鑫,张美珍,郑翘楚,刘 权,黄玉兰,殷奎德
(1.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319)
土壤盐碱化是目前农业面临的主要问题之一。到2050年,预计超过50%的耕地将受到土壤盐碱化的影响[1]。盐碱胁迫是导致作物减产的主要原因之一[2]。土壤中的高浓度盐和高pH 值会引发渗透胁迫、离子胁迫和氧化胁迫,从而影响植物生产力。由于土壤的高渗条件,植物细胞内会积累有毒离子,影响水分平衡和离子稳态[3]。盐碱胁迫的另一个后果是产生活性氧(ROS),活性氧会导致二次DNA 损伤,如碱基缺失、DNA-蛋白质交联和双链DNA 断裂[4]。除此之外,盐碱胁迫还可以诱导植物产生过量的乙烯,抑制叶片生长、细胞分裂和根伸长,导致植物提前衰老或死亡[5]。
近年来,通过接种植物根际促生菌(PGPR)来帮助植物抵御盐碱胁迫逐渐成为研究热点。多项研究表明,PGPR 可以参与诱导植物提高抗氧化水平、调节Na+流出、提高光合效率等多种植物生理活动来缓解盐碱胁迫给植物带来的伤害[6-8]。PGPR 通常具有多种促生功能,如固氮、产铁载体、溶磷、产植物激素[如吲哚乙酸(IAA)]和合成1-氨基环丙烷1-羧酸(ACC)脱氨酶等[9]。ACC 脱氨酶产生菌可以将乙烯前体ACC 分解成α-酮丁酸盐和氨,降低植物根内的乙烯浓度,从而缓解胁迫乙烯对植物生长的不利影响[10-11]。另外,有研究表明,接种产ACC 脱氨酶的PGPR也可以通过调节植物根中ACC合成酶(ACS)和ACC氧化酶(ACO)的活性降低乙烯对植物的伤害[12]。ACS 和ACO 在植物乙烯的合成过程中起重要作用,ACS 是植物内源乙烯合成的限速酶,ACO 则是组成型的,不构成乙烯生物合成的限速酶[13]。
目前,关于产ACC 脱氨酶的PGPR 促进盐碱胁迫下绿豆生长的研究已有报道[14-15],其主要关注的是绿豆植株地上部分的变化,对根系的研究较少,特别是接种产ACC 脱氨酶的促生菌后绿豆生根与乙烯合成相关酶的研究还未见报道。鉴于此,将产ACC 脱氨酶的促生菌接种到绿豆插条基部,通过检测绿豆插条在盐碱胁迫条件下的生根数及根中ACC含量以及ACC合成酶和ACC氧化酶活性,明确产ACC脱氨酶的PGPR对盐碱胁迫条件下绿豆插条生根的作用机制,为PGPR 促进植物生根、提高植物耐盐碱能力的研究提供参考。
1 材料和方法
1.1 材料
供试土壤样品采自大庆市盐碱草原碱草根际,用以筛选产ACC 脱氨酶促生菌;绿豆种子为国家杂粮工程技术中心赠送,品种为小明绿。
1.2 方法
1.2.1 产ACC 脱氨酶菌株的筛选及其产ACC 脱氨酶能力检测 产ACC 脱氨酶菌株筛选参照PENROSE 等[16]和张国壮等[17]的方法。产ACC 脱氨酶能力检测具体步骤参考黄天姿等[18]的方法。蛋白质含量测定选用考马斯亮蓝法。酶活的计算方式以每分钟产出1 µmol α-丁酮酸的量为1 个酶活力单位(U),计算方式参考姬文秀等[19]的方法。
1.2.2 菌株耐盐碱范围测定 耐碱试验:将筛选出的菌株按1%的接种量分别接种到pH 值为8、9、10、11的LB液体培养基中,于28 ℃、170 r∕min振荡培养24 h,检测OD600值。耐盐碱试验:根据耐碱试验中测定的OD600值选择菌株生长较好的最高pH 值,按1%的接种量分别接种到NaCl 含量为0、2%、4%、6%、8%、10%、12%的LB 液体培养基中,于28 ℃、170 r∕min振荡培养24 h,测定OD600值。
1.2.3 菌株生理生化鉴定和分子鉴定 菌株的生理生化鉴定参考《微生物学实验》[20]和《常见细菌系统鉴定手册》[21]上有关细菌的生理生化鉴定部分,主要包括甲基红试验、唯一碳源试验、唯一氮源试验、革兰氏染色、需氧性试验、接触酶试验、氧化酶试验、硝酸盐还原试验。同时检测菌株产植物激素IAA 功能,参照常慧萍等[22]与王西祥等[23]的方法进行。
将菌株样品送至吉林美吉生物公司进行16S rDNA 测序,测序结果在NCBI 上进行BLAST 比对,并从NCBI 上找到相应模式菌株的16S rDNA 序列,之后利用MEGA 7 软件构建系统发育树,确定其种属关系。
菌株acdS基因鉴定参考秦媛等[24]的方法,用引物acdSf3∕acdSr4 扩增菌株acdS基因片段,acdSf3 和acdSr4的序列分别为ATCGGCGGCATCCAGWSNAAYCANAC 和GGCACGCCGCCCARRTGNRCRTA,片段大小为760 bp,退火温度为58 ℃。
1.2.4 绿豆插条下胚轴不定根促生试验 插条培养:参考龚月桦等[25]的方法培养绿豆插条,绿豆种子用无菌水清洗3 次后37 ℃催芽,发芽后种植于已灭菌的蛭石中,待幼苗长至7~9 cm 时,切除子叶以下5 cm部位,得扦插条。
最适盐碱胁迫浓度筛选:将绿豆插条分别置于0、10、14、16、18 mmol∕L NaHCO3溶液中,7 d 后统计不定根数目。最适菌液处理浓度筛选:将3 株促生菌接种在TSB 培养基中,28 ℃、180 r∕min 培养24 h,4 ℃、18 000 r∕min 离心5 min,去上清后用ADF 培养基重悬,再培养24 h,诱导菌株产ACC 脱氨酶活性,18 000 r∕min 离心5 min,去上清后用无菌水重悬,将重悬后的菌液分别稀释到106、107、108cfu∕L。将3种不同浓度的菌液置于10 mL 灭菌离心管中,将绿豆插条下胚轴部分分别置于3 种浓度的菌液中,每个离心管放5 根绿豆插条,24 h 后转入无菌水中,7 d后统计不定根数目。
插条处理及生根统计:将绿豆插条的下胚轴分别置于无菌水(CK)或菌悬液中浸泡24 h,浸没插条底部2 cm。处理24 h 后,将绿豆插条分别转移至无菌水(正常条件)或NaHCO3溶液(盐碱胁迫)中,每个处理5 株插条,3 次重复,每隔24 h 更换无菌水或NaHCO3溶液,7 d后统计扦插条大于1 mm的不定根数目,并称量根鲜质量,采用SPSS 18.0 进行统计分析,Origin 8.5 作图。将新生根剪下来用液氮速冻,转至-80 ℃保存,用于检测ACC含量、ACC合成酶活性和ACC氧化酶活性。
插条根中ACC 含量、ACC 合成酶、ACC 氧化酶检测:利用气相色谱法检测ACC 含量、ACC 合成酶活性、ACC 氧化酶活性。气相色谱仪型号为北分瑞利3420A,进样口温度60 ℃,检测器温度150 ℃,柱温箱温度60 ℃,待仪器3 个温度都达到设定值,进行仪器点火,开始监控基线,待基线平稳30 min 后,开始进样。根据公式计算ACC 含量、ACC 成合酶活性、ACC 氧化酶活性,ACC 含量计算公式为N∕S×C×n×V×1∕22.4W,单位nmol∕g;ACC 合成酶活性和ACC氧化酶活性在不同前处理下计算公式均为N∕S×n×V×1∕t×1∕22.4W,单位为nmol∕(h·g)。式中,N为样本乙烯的峰面积;S为标准乙烯的峰面积;n为提取液的稀释倍数;C为标准乙烯的浓度;V为反应容器体积;W为测试样本的鲜质量;t为密闭时间。
2 结果与分析
2.1 产ACC脱氨酶促生菌的筛选及鉴定
用ADF 固体培养基从大庆碱草植物根际土中定性分离出了30 株具有产ACC 脱氨酶能力的促生菌,编号DQJC1—DQJC30,从中选取3 株产ACC 脱氨酶能力较强的菌株DQJC1、DQJC5、DQJC6作为后续试验的供试菌株,3 株菌产ACC 脱氨酶能力分别为8.147、7.282、7.906 U∕mg。对3 株菌进行耐盐碱能力鉴定,发现3 株菌均能在pH 值11 且NaCl 含量10%的LB 培养基中生长,均具有较强的耐盐碱能力。定量检测了DQJC1、DQJC5、DQJC6 的产IAA 能力,分别为64.33、10.45、12.05 mg∕mL。
对3 株产ACC 脱氨酶的促生菌进行生理生化鉴定,结果表明,3 株促生菌均为革兰氏阴性菌,都可以利用唯一碳源(葡萄糖、蔗糖),都是需氧性菌;接触酶、氧化酶、硝酸盐还原均为阳性,DQJC1 和DQJC6 甲基红试验呈阳性,DQJC5 甲基红试验呈阴性。
acdS基因是产生ACC 脱氨酶的特有基因。提取DQJC1、DQJC5、DQJC6 三个菌株的DNA,用引物acdSf3∕acdSr4 进行PCR 扩增,PCR 产物进行1%琼脂糖凝胶电泳,3 株菌在片段大小为760 bp 处皆有条带,说明3 株菌均具有acdS基因,进一步验证了3株菌均具有产ACC 脱氨酶能力。将DQJC1、DQJC5、DQJC6 的16S rDNA 测序结果与NCBI 数据库比对,结果见表1,综合菌株的生理生化鉴定和分子鉴定结果,确定3 株菌为假单胞菌属(Pseudomonas)的不同菌种,3 株促生菌的系统发育分析情况见图1。

图1 菌株DQJC1、DQJC5、DQJC6基于16S rDNA构建的系统进化树Fig.1 Phylogenetic tree constructed from strains DQJC1,DQJC5,and DQJC6 based on 16S rDNA

表1 DQJC1、DQJC5、DQJC6的16S rDNA 基本信息与核酸序列比对(BLASTn)结果Tab.1 The 16S rDNA basic information and results nucleic acid sequence alignment(BLASTn)of DQJC1,DQJC5,and DQJC6
2.2 筛选菌株对绿豆插条下胚轴不定根的促生作用
2.2.1 最适盐碱胁迫浓度筛选 为了筛选绿豆插条在盐碱条件下能够生长的最高胁迫浓度,将绿豆插条分别置于0、10、12、14、16、18 mmol∕L NaHCO3溶液中生长,7 d 后统计不定根数目。结果表明,绿豆插条在无菌水中可以正常生根,在10~16 mmol∕L NaHCO3溶液中生根受到明显抑制,其中14 mmol∕L NaHCO3溶液抑制生根效果较强,插条平均生根数为4.10 条,在16 mmol∕L NaHCO3溶液中绿豆插条几乎不再生根,因此选择14 mmol∕L 的NaHCO3溶液作为绿豆插条生根的盐碱胁迫浓度。
2.2.2 最适菌液处理浓度筛选 将不同浓度的DQJC1、DQJC5、DQJC6 接种到绿豆插条基部,处理后发现,3 株促生菌皆在107cfu∕mL 时促生效果最好,当接种菌液浓度为108cfu∕mL 时,绿豆插条新生根根长有所增加,但发根数明显减少,因此,后续试验菌液处理浓度选择107cfu∕mL。
2.2.3 盐碱胁迫下接种3株菌对绿豆插条生根的影响 将接种促生菌后的绿豆插条分别经无菌水(正常条件)和14 mmol∕L NaHCO3溶液(盐碱胁迫)处理7 d,绿豆插条发根情况分别见图2、图3及表2,盐碱胁迫条件下接种3株促生菌显著增加了绿豆插条根的鲜质量。统计2 种处理条件下绿豆插条的发根数,结果见图4,正常条件下接种DQJC1、DQJC5、DQJC6 后,绿豆插条发根数分别增加了50.00%、26.32%、44.73%;盐碱胁迫条件下接种DQJC1、DQJC5、DQJC6 后,绿豆插条发根数分别增加了125.81%、106.45%、112.90%,说明在盐碱胁迫条件下,3 株促生菌具有明显的促进绿豆插条生根的能力,其中DQJC1促生效果最好。2.2.4 绿豆插条根中ACC 含量、ACC 合成酶活性、ACC 氧化酶活性 盐碱胁迫条件下接种DQJC1、DQJC5、DQJC6 后,绿豆插条新生根中的ACC 含量、ACC 合成酶活性、ACC 氧化酶活性检测结果如图5所示,DQJC1、DQJC6可以显著下调绿豆插条根中的ACC 含量,分别下调了136.15%、65.66%;DQJC1、DQJC5、DQJC6 可以显著下调绿豆插条根中ACC 合成酶、ACC 氧化酶活性,其中ACC 合成酶活性分别下调了204.83%、156.31%、160.79%,ACC 氧化酶活性分别下调了51.97%、47.60%、40.56%,3 株菌均表现出抑制ACC 合成酶和ACC 氧化酶活性。综合来看,接种菌株DQJC1 缓解盐碱胁迫对绿豆插条生根的抑制效果最好。

图2 正常条件下接种3株促生菌对绿豆插条生根的影响Fig.2 Effect of inoculation of three promoting strains on rooting of mung bean cuttings under normal conditions

图3 NaHCO3处理下接种3株促生菌对绿豆插条生根的影响Fig.3 Effect of inoculation of three promoting strains on rooting of mung bean cuttings under NaHCO3 treatment

图4 盐碱胁迫及正常条件下接种促生菌对绿豆插条生根的影响Fig.4 Effect of inoculation with promoting strains on mungbean cuttings rooting under saline stress and normal conditions
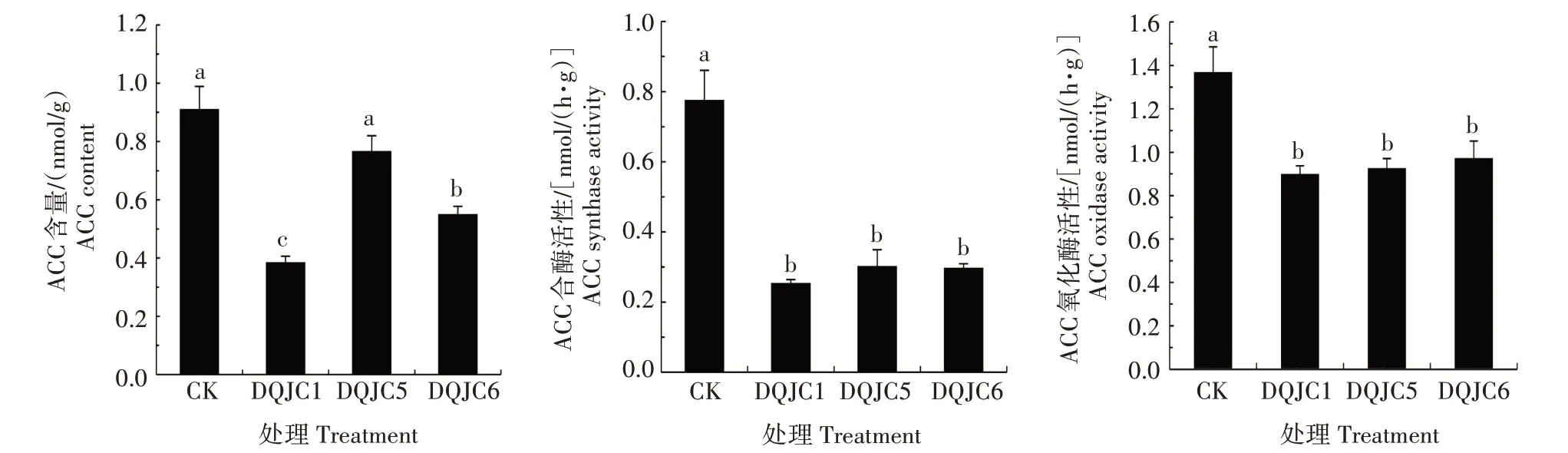
图5 接种3株促生菌对绿豆插条根中ACC含量、ACC合成酶活性和ACC氧化酶活性的影响Fig.5 Effect of inoculation with three promoting strains on the ACC content,ACC synthase activity and ACC oxidase activity in the roots of mung bean cuttings

表2 正常条件和盐碱胁迫条件下接种3株促生菌对绿豆插条根长及鲜质量的影响Tab.2 Effects of inoculation with three promoting strains on root length and fresh weight of mung bean cuttings under normal and saline stress conditions
3 结论与讨论
盐碱胁迫是导致植物减产的主要非生物胁迫之一,盐碱胁迫下植物产生的过量胁迫乙烯会阻碍植物叶片生长、根系伸长,导致植物衰老或死亡[26]。植物根际促生菌通常具有多种促生功能,可以帮助植物抵御盐碱胁迫,产ACC 脱氨酶是促生菌最重要的促生功能之一。研究表明,产ACC 脱氨酶的PGPR 可以调节盐碱胁迫下植物体内Na+、K+的流出,提高K+∕Na+和Ca+2∕Na+的比例[27];还可以通过触发植物细胞的抗氧化水平来诱导植物的抗盐能力[28]。目前已报道的产ACC 脱氨酶能力强同时也具备较强耐盐碱能力的菌株较少,如费诗萱等[29]从红枣根际土中筛出的产ACC 脱氨酶菌株,酶活性在0.500~7.218 U∕mg;梁翔宇等[30]从宁夏银北地区盐生植物根际土中筛选出3 株耐盐碱促生菌,可以在NaCl 含量为8%和pH 值为9 的培养基中生长。在试验方法相同的前提下,本研究筛选出的菌株DQJC1、DQJC5、DQJC6产ACC 脱氨酶能力分别达到8.147、7.282、7.906 U∕mg,在产ACC 脱氨酶能力较强的同时,也具有较强的耐盐碱能力,可以在pH 值11、NaCl含量10%的环境下生长。
前人研究表明,PGPR 可以通过产生植物激素IAA 和ACC 脱氨酶增强植物对逆境的抵抗能力,促进植物生长。盐碱胁迫下,植物生根组织对乙烯含量的响应有一个阈值,植物体内乙烯含量高于或低于这个阈值范围,生根则受到抑制[31-32]。除了乙烯外,植物激素IAA 在不定根起始和发生过程中也有着重要的作用。有研究表明,IAA 可以和乙烯协同作用促进植物初生根和次生根的生长[33];LIU等[34]研究表明,生长素能够通过增加未成熟桃子果实中的ACC合成酶含量来刺激乙烯的合成。供试的3株促生菌同时兼具产IAA 和产ACC 脱氨酶功能,其促进插条生根的机制可能是IAA 和ACC 脱氨酶的协同作用。一方面,促生菌产生的低浓度IAA 刺激生根部位细胞分裂,形成不定根,这与王金祥等[35]的研究结果一致,本试验在非盐碱胁迫条件下接种促生菌也可以显著增加绿豆插条的发根数,印证了这一点。另外,QIN 等[36]研究表明,IAA 可以通过激活植物ACC 合成酶的转录来影响促生菌ACC 脱氨酶的合成。另一方面,盐碱胁迫促使插条产生大量乙烯并在体内积累,插条体内乙烯积累量越来越多,当内源乙烯含量超过阈值,生根就会受到抑制。
本研究中,接种促生菌后显著下调了绿豆插条根中的乙烯前体ACC 含量,从而降低了乙烯的含量。ACC 含量的降低可能是促生菌分解了根系向外释放出的ACC。另外一个原因可能是促生菌降低了ACC合成酶和ACC氧化酶活性,ACC合成酶是调节植物体内乙烯浓度的中心限速酶,是植物合成ACC 的必经通路,随着ACC 合成酶活性的降低,ACC 的合成得到控制。ACC 氧化酶是乙烯生物合成的最后一步,接种促生菌后ACC 氧化酶活性下调,加上ACC 合成被抑制,乙烯合成的速率逐渐降低,产ACC 脱氨酶的促生菌通过抑制乙烯合成有效地缓解了盐碱胁迫对绿豆插条生根的抑制作用。
综上,本研究从碱草植物根际土中筛选出了3株产ACC 脱氨酶能力较强的促生菌,命名为DQJC1、DQJC5、DQJC6,其具有较强的耐盐碱能力,经生理生化和分子鉴定,3 株促生菌均为假单胞菌属。将3 株促生菌接种到绿豆插条基部后,在非盐碱和盐碱胁迫条件下均可显著增加绿豆插条的发根数,其中DQJC1促生效果最好;3株促生菌显著下调了盐碱胁迫条件下绿豆插条根中的ACC 合成酶活性和ACC 氧化酶活性,DQJC1和DQJC6显著下调了绿豆插条根中的ACC 含量,有效地缓解了盐碱胁迫对绿豆插条生根的抑制作用。

