氧化铜掺杂石墨相氮化碳增强光催化降解四环素废水性能研究
*李玥怡 李学松 申学鹏 李永勤 王旭明 吴之强,3*
(1.宁夏师范学院化学化工学院 宁夏 756000 2.宁夏大学物理与电子电器工程学院 宁夏 750021 3.宁夏大学土木与水利工程学院 宁夏 750021)
利用半导体光催化剂和太阳能是解决全球能源和环境危机的有效方法之一。然而,寻找高效、简单和可持续的光催化材料仍然是迄今为止极具挑战性的课题[1]。近年来,石墨氮化碳(g-C3N4)高分子材料的开发日益兴盛,其具有良好的电子构型和带隙以及耐酸碱等特性,被认为是一种具有良好前景的光催化剂[2-3]。然而本征块体的氮化碳其光生电子-空穴对易重组,比表面积小、光学带隙较大,从而导致其催化效率偏低。因此为提高g-C3N4光催化性能,研究者已开发了诸多方法如元素掺杂法、质子化法、与其他半导体复合方法等。而介孔氮化碳的开发也是形式多样,其高的表面积、可控调节的多孔结构均受人关注[4]。合成介孔氮化碳的方法一般采用模板法,主要包括软模板法、硬模板法及无模板法。通常将多孔二氧化硅或多孔阳极氧化铝为模板,将双氰胺冷凝成氮化碳,然后将其溶解在双氟化铵、氟化氢或氢氧化钠溶液中去除模板。该过程使用危险有污染试剂,需多步合成步骤,以获得合适的介孔材料。因此,采用软模板合成多孔g-C3N4的新方法更显优势。王勇等[5]报道采用P123作为结构导向剂,以DCDA为前驱体合成介孔g-C3N4,得到具有高表面积和高导电性材料。然而这些材料的碳含量较高,破坏了原始氮化碳半导体结构。
此外,将g-C3N4纳米片与CuO纳米材料复合是一种经济、高效的制备层状纳米金属氧化物掺杂氮化碳的方法[6]。Xiang等人[7]利用沉积法将Pt-Cu双金属负载于石墨相氮化碳表面并将其利用于提升光催化CO2还原性能研究。杨仁春等人[8]利用表面原位沉积将Cu2O-CuO共负载于氮化碳表面制备光催化剂,其催化降解罗丹明B取得了优异的效果。刘东京等人[9]研究表明将氯化铜作为改性原料对氮化碳形貌及晶体结构产生影响,其改性产物对金属汞的脱除具有良好的效果。Verma等人[10]用简单的超声混合法制备氯掺杂CuO/g-C3N4异质结构材料并应用于光催化降解4-硝基苯酚,其效果明显优于单纯的氮化碳材料。
本文以P123为模板剂,醋酸铜为掺杂剂,制备了氧化铜掺杂介孔石墨相氮化碳复合光催化材料,对材料进行表征分析和光催化降解四环素废水性能进行了评价。同时考察了催化剂的重复循环性能。
1.实验药品及仪器
三聚氰胺,醋酸铜,P123,四环素,乙醇(95%)和甲酸等均购自国药集团化学试剂有限公司,均为分析纯。
D8 Advance型X射线衍射仪(德国Bruker-AXS公司);NIS-10型傅里叶变换红外光谱仪(美国Thermo公司);ASAP2020型全自动比表面分析仪(美国麦克公司);UV-2600型紫外可见漫反射光谱仪(美国Agilent公司);HF-7000型荧光分光光度计(日本日立公司);TU-1901型双光束紫外可见分光光度计(北京普析通用仪器公司);GHX-II型光化学反应仪(上海Bilon仪器公司)等。
2.实验步骤
(1)氧化铜掺杂石墨相氮化碳制备
称取0.2g的P123倒入100mL烧杯,加入40mL、95%乙醇溶液,搅拌30min后备用。将不同质量(按照三聚氰胺0.5%(0.015g)、1.0%(0.03g)、3.0%(0.09g)、5.0%(0.15g))的醋酸铜加入P123水溶液(5mL),同时加入等量的甲酸溶液(2mL)。并将上述溶液加入烧杯;后将3g三聚氰胺同时加入,充分搅拌20min后取出磁子。
将上述混合物转移至氧化铝坩埚,空气气氛焙烧。焙烧条件:室温升温至350℃(2℃/min);保温1h;继续升温至550℃(5℃/min),保温3h后自然冷却至室温。将反应物取出并通过乙醇洗涤3次后干燥。标记样品分别为:CuO0.5-g-C3N4;CuO1.0-g-C3N4;CuO3.0-g-C3N4;CuO5.0-g-C3N4和空白样g-C3N4。
(2)光催化降解四环素废水性能
以模拟降解四环素废水为测试目标,分别考察样品CuO0.5-g-C3N4;CuO1.0-g-C3N4;CuO3.0-g-C3N4;CuO5.0-g-C3N4和g-C3N4的光催化活性。采用500W氙灯为光源(灯源与反应体系距离为7cm左右),将40mg催化剂分散于50mL、20mg/L的四环素废水溶液,先进行30min暗反应,后将光源打开进行搅拌反应。每隔10min取样,离心并吸取上层清液,用可见分光光度计测定λ为359nm下的吸光度(359nm为四环素最大吸收波长)。
3.结果与讨论
图1为样品g-C3N4和CuO5.0-g-C3N4的SEM谱图。利用扫描电镜对g-C3N4和CuO5.0-g-C3N4材料的形貌进行了表征分析。从图中可以看出,样品g-C3N4(图1a)和CuO5.0-g-C3N4(图1b)的形貌表现出相似的片层状结构,且伴随着褶皱出现,这主要归因于在煅烧过程中三聚氰胺的缩合作用以及P123模板剂的引入。其中,CuO的掺杂在一定程度上改变了样品g-C3N4的表面形貌,显得更加平滑。这可能是CuO通过插入g-C3N4的层状结构,使CuO5.0-g-C3N4样品的层状结构发生改变,这有利于样品CuO5.0-g-C3N4表面暴露更多的催化活性位点和提升电子的传导运输能力,进而提高材料的光催化性能。
图2(a)为样品含不同氧化铜比例的复合材料XRD谱图。可以看出不同CuO含量的复合材料均在13.0°和27.4°处出现峰值,分别对应g-C3N4的(100)和(002)晶面;同时说明g-C3N4的主要结构在CuO掺入后并没有明显改变。随着CuO掺杂量的增加,复合材料的(002)晶面衍射峰强度呈现减弱趋势。这可能是由于氧化铜的掺杂位置区域偏向(002)晶面界面。当氧化铜掺杂量达到3%时,在35.5°和38.7°处检测到两个明显的衍射峰,分别为CuO的(101)和(111)晶面(PDF#48-1548)[11]。通过图2(b)可以得出,氮化碳的基本骨架结构并未发生变化,其中代表N-H红外特征峰的3251.9cm-1位置出现明显的宽带基团峰,同时在2790.5cm-1和2701.3cm-1处代表三嗪环结构的C-H伸缩振动和1623.9cm-1处类似苯环骨架结构保持完整,这说明CuO的掺杂并没有直接改变氮化碳的本征结构,但可能因分子间作用力而发生一定的分子取代,其中最明显的峰值变化在1350.3cm-1和615.4cm-1处。与g-C3N4相比,样品CuO-g-C3N4材料在1350.3cm-1处的峰强度发生明显增强,且随着CuO含量增多而增强;而在615.4cm-1处特征峰强度发生明显弱化,且随着CuO含量增多而强度减弱。
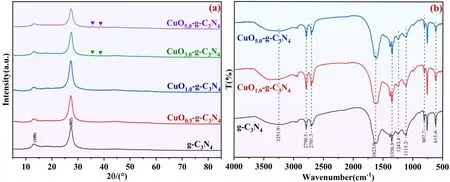
图2 不同比例的CuO掺杂g-C3N4复合材料XRD图谱和IR表征
图3分别是CuO-g-C3N4复合材料的氮气吸-脱附等温线和孔径分布。从图3(a)得出,制备的光催化材料均符合典型的V型等温线,属于介孔材料。纯块体g-C3N4比表面积为9.585m2/g,随着CuO掺杂量的增加,复合材料CuO0.5-g-C3N4、CuO1.0-g-C3N4、CuO3.0-g-C3N4、CuO5.0-g-C3N4的比表面积分别为12.056m2/g、12.755m2/g、14.728m2/g、19.560m2/g。这说明CuO的掺杂对石墨相氮化碳本征微观结构具有一定的影响,其比表面积随着CuO量的增加而增大。从图3b看出,CuO掺杂量的增加不会明显使的复合材料的平均孔径分布发生变化。所有样品的平均孔径均保持在3.84nm附近,其中密集分布位于3.0~20.0nm之间,这进一步证明复合材料具有明显的介孔结构。此外,随着CuO掺杂量的增加,复合材料的孔体积也有小范围的增大。

图3 复合材料CuO-g-C3N4的BET表征和孔径分布
图4显示了复合材料CuO-g-C3N4的紫外-可见漫反射光谱图(UV-vis DRS)。可以看出样品CuO1.0-g-C3N4、Cu5.0-g-C3N4相较于g-C3N4发生明显的红移,这说CuO与g-C3N4之间的相互作用使材料的可见光吸收强度增强,进而会提高光催化性能。值得注意的是样品CuO5.0-g-C3N4表现出最佳的可见光吸收能力,其吸收边缘达到544nm。从图4(b)看出,与样品g-C3N4(2.41eV)相比较,样品CuO1.0-g-C3N4和CuO5.0-g-C3N4的能带带隙分别为2.38eV和2.23eV,适当的带隙宽度可以提高材料对可见光的利用率,从而产生更多光电子-空穴对[12]。另外利用热缩聚法制备的g-C3N4其带隙一般为2.63~2.72eV附近,而通过软模板法制备的介孔g-C3N4带隙有所降低,而掺杂剂CuO的引入则进一步减小了复合材料的能带带隙,有效地提高了复合材料的光催化性能。

图4 复合材料CuO-g-C3N4的紫外-可见漫反射光谱图(UVvis-DRS)
图5为复合材料CuO-g-C3N4的PL谱图。一般认为光致发光强度越低,光生载流子分离和转移效果越好[13]。从图中看出,在掺杂CuO后所有复合材料CuO-g-C3N4的PL强度均显著降低。随着样品中CuO掺杂量的依次增加,复合材料的发光强度呈逐渐下降趋势,这说明当CuO与g-C3N4掺杂后,材料的光生载流子被有效分离和转移,从而抑制了光生电子-空穴对的重组复合[14]。此外可以看出,不同掺杂量下样品的波长还出现了明显的蓝移,这归因于CuO与g-C3N4掺杂后导致复合材料的带隙能下降,光响应强度增强,也进一步说明适量的CuO掺杂可有效改善材料的光催化性能。
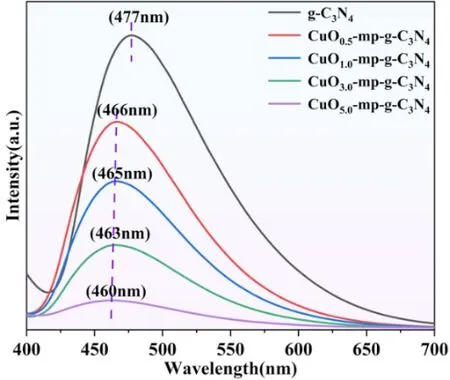
图5 复合材料CuO-g-C3N4的光致发光谱图(PL)
图6是复合材料CuO-g-C3N4光催化降解四环素废水(20mg/L)性能评价(图a)和重复使用性能考察(图b)。实验表明,所有样品均对四环素废水有一定将催化降级性能,其中样品CuO5.0-g-C3N4对四环素废水的光催化降解效果最佳,其在90min内对于四环素废水的降解效率达到65.1%,与此同时,样品g-C3N4、CuO0.5-g-C3N4、CuO1.0-g-C3N4和CuO3.0-g-C3N4的降解效率分别为47.2%、48.3%、50.1%和55.3%。相比较于g-C3N4,样品CuO5.0-g-C3N4的降解特性得到了明显的提升,这归因于氧化铜的掺杂对氮化碳本征结构产生了有利的影响,进而提升了光生电子-空穴对的分离和传输,提高了对光的吸收利用率。此外,将样品CuO5.0-g-C3N4在进行连续5个循环实验后,其降解性能仍然稳定保持在60%以上,这表明本实验制备的CuO-g-C3N4复合材料具有较高的循环稳定性能。
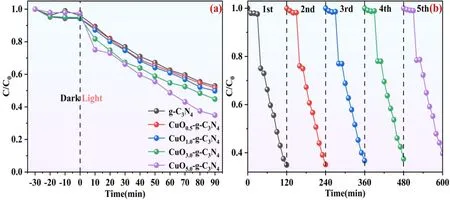
图6 复合材料CuO-g-C3N4光催化降解四环素废水性能评价(a)和重复使用性能考察(b)
图7为CuO-g-C3N4催化剂光催化降解机理图。由图可知,光生电子和空穴产生后通过CuO被转移到复合材料表面,同时电子被吸附在材料表面的氧捕获后产生超氧自由基;而空穴被吸附在材料表面的羟基和水,进而形成羟基自由基。超氧自由基和羟基自由基均具有较强的氧化性能,可以将四环素废水降解为目标产物,以达到光催化降解的目的。
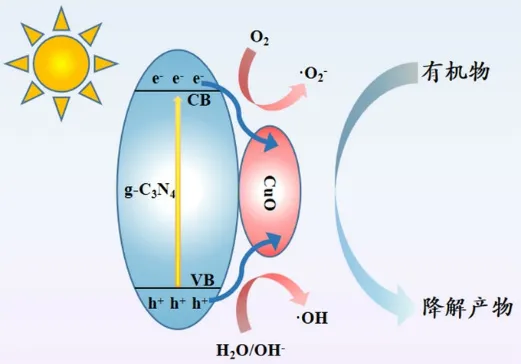
图7 CuO-g-C3N4催化剂光催化降解机理图
4.结论
该实验工作通过将模板剂P123和掺杂剂醋酸铜预处理前驱体三聚氰胺,并采用高温热缩聚法制备了CuO掺杂介孔g-C3N4复合光催化材料。表征结果证明该材料具有较大的比表面积、良好的光生电子-空穴分离效率和优良的催化活性,尤其是利用CuO对氮化碳本征材料进行掺杂后,复合材料表现出更佳的催化性能。样品CuO5.0-g-C3N4对四环素废水的催化降解能力最佳,其在90min内对四环素废水(20mg/L)的降解效率可以达到65.1%。此外,对催化剂进行重复性考察发现,复合光催化材料在重复循环5次后其催化活性仍保持在60%以上,无明显下降,说明该实验方法制备的光催化剂性能较为稳定。
——潘桂棠光生的地质情怀

