微胶囊处理含酚废水的研究
*李明道
(舟山市发展和改革委员会 浙江 316021)
引言
苯酚是一种油田污水中常见的水溶性污染物,重力沉降、水力旋流等常规油田污水处理工艺对含酚废水处理效果不佳[1],所以往往采用氧化法[2]、生化法[3]、物理吸附法和液液萃取法[4]等工艺深度处理含酚废水。其中物理吸附法主要采用活性炭[5]、天然材料[6]、生物质[7]等作为吸附剂吸附废水中的苯酚,但这些吸附剂存在吸附速率低,吸附量少,难以洗脱等局限性。液液萃取法具有平衡时间短,处理效率高,操作节能等优势,但在萃取过程中萃取剂容易和水相形成乳液,造成分离成本增加和萃取剂损失。
为找到处理高效,易于分离,成本又相对可控的含酚废水处理工艺,本文拟结合物理吸附法和液液萃取法的优势,采用微胶囊包裹有机溶剂的方式来处理含酚废水。本文配置了低浓度苯酚溶液作为含酚废水,选取了对苯酚有较好萃取效果的正辛醇,通过溶剂挥发法制备了载醇微胶囊和空载微胶囊,研究了两种微胶囊对低浓度苯酚溶液的处理效果,系统地考察了吸附动力学、吸附等温线以及温度和pH对吸附效果的影响,为微胶囊法处理含酚废水提供一定的理论依据。
1.试验部分
(1)试验试剂
苯酚(分析纯)、正辛醇(分析纯)、二氯甲烷(分析纯)、明胶(化学纯),国药集团化学试剂有限公司;聚砜(PSF,运动黏度0.56m2/s),上海曙鹏塑料有限公司。
(2)实验仪器
离心机(TDZ5-WS),湖南湘仪实验室仪器开发有限公司;紫外可见分光光度仪(Spectrumlab 52),上海棱光技术有限公司;pH仪(PHS-3E),上海精密科学仪器有限公司;偏光显微镜(ECLIPSE E600W POL),Nikon;热重分析仪(Pyris 1),Perkin-Elmer;扫描电镜(Utral 55),CorlzeisD。
(3)微胶囊的制备与表征
①载醇微胶囊制备。称取1g明胶置于250mL烧杯中,加入200mL去离子水搅拌溶解得到水相。称取2g聚砜,4g正辛醇溶于50mL二氯甲烷中得到有机相。将有机相倒入水相当中,以400rpm的转速搅拌使有机相分散成小液滴,形成稳定的水包油体系。将烧杯置于恒温水浴器中,在32℃下搅拌2h,使有机相中的二氯甲烷挥发完全,形成载醇微胶囊。经过滤后得到的载醇微胶囊,用去离子水冲洗5遍后置于空气中干燥待用。
②空载微胶囊制备。空载微胶囊的制备除有机相制取过程中不加入正辛醇外,其余流程均与制备载醇微胶囊一致。
③微胶囊的表征。通过偏光显微镜对微胶囊拍摄若干张照片,使用Image-Pro Plus软件统计可得到微胶囊粒径。载醇微胶囊的包裹率(即正辛醇的质量百分比)由热重分析仪测得,测定条件为从室温升温至800℃,升温速率为20℃/min,载气为N2。载醇微胶囊和空载微胶囊的表面以及内部结构形态采用扫描电镜观察并拍照。
(4)吸附实验
称取0.3g微胶囊置于离心试管中,加入20mL低浓度苯酚水溶液。将离心试管置于恒温水浴振荡器中在一定的温度下以200Hz的频率振荡一段时间。取出离心试管,放入离心机内以2000rpm的速度离心。待离心完全后,用20mL医用注射器吸取15mL左右的下层溶液,将得到的溶液通过滤纸过滤(微胶囊最小粒径为300μm,大于快速滤纸80~120μm的孔径,可确保微胶囊完全被滤纸过滤),最终得到澄清的样液。本文采用紫外可见分光光度仪检测水溶液中苯酚的含量,测量波长为260nm。通过苯酚水溶液处理前和处理后的苯酚浓度变化,便可通过下式计算出单位质量微胶囊的吸附量。每组实验重复三次,取平均值。
式中,C0为苯酚溶液初始浓度(mg·L-1);C为处理之后苯酚溶液的浓度(mg·L-1);V为加入的苯酚溶液的体积(L);M为加入的微胶囊质量(g);Q为单位质量微胶囊的吸附量(mg·g-1)。
2.结果与讨论
(1)微胶囊制备结果讨论。本文制备微胶囊过程中采用搅拌的方式来分散有机相,由于烧杯内流场并非均一稳定,制得的微胶囊粒径并不均一。将一组载醇微胶囊通过偏光显微镜拍摄,并通过软件统计粒径后得图1。从图1看到,微胶囊粒径范围约为300μm~1250μm,经统计平均粒径为750μm。

图1 载醇微胶囊粒径分布图
载醇微胶囊的包裹率是影响苯酚吸附量和吸附速率的重要因素,本文测定了载醇微胶囊的热重曲线,见图2。从图2看到,在100℃之前,热重曲线有一个小的下降,主要是水分挥发造成的;100℃到196℃之间热重曲线有一个较大的下降,主要是正辛醇(沸点196℃)挥发造成的;484℃左右出现的一个最大的下降,经与聚砜纯品的热重曲线对比可以确定是聚砜的分解造成的。将100℃下的残余质量百分比与196℃下的残余质量百分比相减便可以得到载醇微胶囊的包裹率约为25.82%。

图2 载醇微胶囊热重曲线
本文采用扫描电镜观察微胶囊的表面及内部形态,并拍摄了一系列图片,见图3(其中(a)(b)(c)(d)(e)为载醇微胶囊,(f)为空载微胶囊)。从图3(a)(b)(c)(d)看到,微胶囊呈中空的球形结构,表面密集地分布了10μm左右的小孔,这些小孔交错疏松,贯穿约80μm厚的微胶囊壁直通微胶囊内部空腔。从图3(e)(f)比较可以看到,空载微胶囊内表面平整无附着物,载醇微胶囊内表面密集地附着粒径2μm左右的正辛醇小液滴。

图3 微胶囊表面及横截面电镜图
(2)微胶囊吸附苯酚的动力学及机理分析。根据其他学者研究,微胶囊处理水溶液中有机物的宏观作用规律与吸附更吻合[8]。对于微胶囊吸附动力学,研究人员往往采用以下三种模型进行拟合[9]。
A.拟一级模型
式中,Qe1为拟一级模型饱和吸附量(mg·g-1);Qt为某一时刻吸附量(mg·g-1);k1为拟一级速率常数(h-1);t为吸附时间(h)。
用拟一级速率常数k1和拟一级模型饱和吸附量Qe1可以用来计算初始吸附速率H(mg·g-1·h-1),其公式如下:
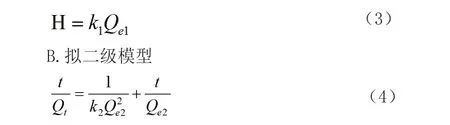
式中,Qe2为拟二级模型饱和吸附量(mg·g-1);Qt为某一时刻吸附量(mg·g-1);k2为拟二级速率常数(g·mg-1·h-1);t为吸附时间(h)。
C.内扩散模型
式中,Qt为某一时刻吸附量(mg·g-1);B为壁厚效应指示性参数(mg·g-1);k3为内扩散系数(mg·g-1·h-1/2)。
本文分别测定了空载微胶囊和载醇微胶囊处理80mg·L-1苯酚溶液的吸附动力学,以时间为横坐标,以单位质量胶囊的吸附量为纵坐标作图,得图4。

图4 空载微胶囊与载醇微胶囊的吸附动力学曲线
根据图4所示,空载微胶囊吸附速率较慢且较为平均,最终约在24h左右达到吸附平衡,平衡吸附量为0.6714mg·g-1;载醇微胶囊前4h吸附速率很快,随后吸附速率大幅降低,在12h左右达到吸附平衡,平衡吸附量为1.882mg·g-1。
①空载微胶囊吸附苯酚的动力学分析
首先将空载微胶囊吸附动力学数据用上述三种吸附模型拟合,计算出模型参数,结果如表1。

表1 空载微胶囊动力学数据拟合结果
根据表1中各模型R2和卡方值χ2综合分析,空载微胶囊吸附苯酚的动力学符合拟一级模型,即吸附速率与苯酚浓度呈线性正相关。由拟一级模型可以计算出空载微胶囊的初始吸附速率为0.0427mg·g-1·h-1。内扩散模型的拟合结果表明,微胶囊的吸附量Qt与t1/2具有良好的线性关系,说明内扩散过程是空载微胶囊吸附速率的控制步骤。
②载醇微胶囊吸附苯酚的动力学分析
将载醇微胶囊吸附动力学数据用上述三种吸附模型拟合,计算出模型参数,结果如表2。

表2 微胶囊动力学数据拟合结果
根据表2中各模型R2和卡方值χ2综合分析,载醇微胶囊吸附苯酚的动力学符合拟一级模型,即吸附速率与苯酚浓度呈线性正相关。由拟一级模型可以计算出载醇微胶囊的初始吸附速率为0.8554mg·g-1·h-1,远高于空载微胶囊的初始吸附速率。内扩散模型的R2仅为0.7504,说明载醇微胶囊吸附苯酚过程中内扩散并非唯一的速率控制步骤,有多重步骤共同影响吸附速率。
③载醇微胶囊吸附苯酚的机理探讨
根据化学分子结构特征,可以判断载醇微胶囊对苯酚的吸附作用力主要由四种组成:聚砜与苯酚的氢键作用力、聚砜苯环与苯酚苯环的相互作用力、正辛醇与苯酚的氢键作用、正辛醇与苯酚的疏水作用力。通过比较空载微胶囊与载醇微胶囊的饱和吸附量、初始吸附速率,表明正辛醇的存在能够大幅提高微胶囊对苯酚的饱和吸附量和吸附速率。
通过空载微胶囊的内扩散模型拟合结果,可以推断空载微胶囊吸附苯酚的过程主要有两个步骤:一是空载微胶囊外表面聚砜与苯酚的相互作用吸引苯酚分子到微胶囊周围,二是苯酚分子通过空载微胶囊的表面孔隙扩散至内部,并受聚砜的作用力被吸附固定到微胶囊内表面,逐步达到吸附平衡。其中第二个步骤为速率控制步骤。
通过载醇微胶囊的内扩散模型拟合结果,可以推断载醇微胶囊吸附苯酚的过程主要有三个步骤:一是载醇微胶囊外表面聚砜与苯酚的相互作用吸引苯酚分子到微胶囊周围,二是苯酚分子通过载醇微胶囊的表面孔隙扩散至内部,并受聚砜和正辛醇的共同作用力吸附到微胶囊内表面,三是部分苯酚分子被微胶囊内部聚砜吸附并逐步达到吸附平衡,部分苯酚分子被萃取到正辛醇中,与水相形成萃取平衡。其中第三个步骤既存在吸附平衡又存在萃取平衡,两者均为速率控制步骤。
(3)微胶囊吸附等温线分析。在吸附低浓度有机物的过程中,研究人员往往采用Langmuir模型和Henry定律来拟合吸附等温线。
①Langmuir模型
式中,Qe为微胶囊平衡吸附量(mg·g-1);Ce为水相苯酚平衡浓度(mg·L-1);Qmax为微胶囊最大吸附量(mg·g-1);KL为Langmuir系数。
②Henry定律
式中,Qe为微胶囊平衡吸附量(mg·g-1);Ce为水相苯酚平衡浓度(mg·L-1);KH为亨利系数(L·g-1)。
本文测定了25℃下微胶囊在低浓度范围(10~120mg·L-1)的吸附等温线,并采用Langmuir模型和Henry定律拟合,拟合结果见表3和图2。

表3 微胶囊吸附等温线拟合结果
根据表3和图5综合分析,Langmuir模型和Henry定律均能很好地拟合载醇微胶囊吸附低浓度苯酚的吸附等温线,这与Langmuir模型在低浓度范围可以简化为Henry定律这一推论吻合。根据Langmuir模型可以得出微胶囊吸附苯酚的最大吸附量为33.01mg·g-1。

图5 载醇微胶囊吸附等温线拟合图
(4)温度对吸附量的影响。本文测定了5个不同温度下载醇微胶囊处理80mg·L-1苯酚溶液的平衡吸附量,以温度为横坐标,以载醇微胶囊平衡吸附量为纵坐标,得图6。
从图6可以看出,随着温度的升高,载醇微胶囊的吸附量降低,说明该吸附过程为放热过程。吉布斯自由能变ΔG与平衡常数K有以下关系:

式中,ΔH为吸附过程焓变(kJ·mol-1);ΔS为吸附过程熵变(J·mol-1·K-1);K为平衡常数;Qe为载醇微胶囊平衡吸附量(mg·g-1);Ce为苯酚平衡浓度(mg·mL-1);T为开尔文温度(K)。
通过数据回归,可以得到ΔS=-4.373J·mol-1·K-1,ΔH=-9.868kJ·mol-1。
(5)pH对吸附量的影响。本文测定了苯酚浓度为80mg·L-1时,不同pH值下载醇微胶囊的平衡吸附量,见图7。从图7可知,载醇微胶囊的平衡吸附量与pH呈负相关,但pH值过低,反而会使得吸附量略有降低。微胶囊对苯酚的吸附作用主要为疏水力和氢键,而pH的增大会使苯酚离子化加剧,而离子化后的苯酚疏水性严重降低,同时原先形成的氢键断裂,导致苯酚与微胶囊的相互作用减弱,所以增大pH会使微胶囊的吸附效果变差。相反,若pH值减小,水中H+提高,苯酚的水解被抑制,主要以分子态存在于水中,增强了疏水力和氢键的作用,所以酸性条件下微胶囊吸附效果更佳。但若pH值过小,H+浓度过大,H+则容易占据微胶囊表面聚砜的吸附活性位点,使得微胶囊对苯酚的吸附效果反而变差。

图7 pH对载醇微胶囊平衡吸附量的影响
3.结论
载醇微胶囊和空载微胶囊吸附低浓度苯酚的动力学曲线均符合拟一级模型,即吸附速率与苯酚浓度呈线性正相关。由于正辛醇的存在,载醇微胶囊的饱和吸附量和吸附速率显著高于空载微胶囊。Langmuir模型和Henry定律均能很好地拟合25℃载醇微胶囊吸附低浓度苯酚的吸附等温线,通过数据回归得到载醇微胶囊的最大吸附量为33.01mg·g-1。载醇微胶囊吸附低浓度苯酚的过程属于放热过程,平衡吸附量随着温度的升高而降低。载醇微胶囊在酸性环境下的平衡吸附量大于在碱性条件下的吸附量,但pH值过低,反而会使吸附量略有降低。

