果酒增香酿造技术研究进展
王 飞,王晓宇,2,3,赵擎豪,赵越凡,刘 炎,杜国荣,赵鹏涛,2,3,*
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710119;2.国家苹果加工技术研发专业中心,陕西 西安 710119;3.西部果品高值利用教育部工程研究中心,陕西 西安 710119;4.西安文理学院生物与环境工程学院,陕西 西安 710065)
果酒因其高营养价值和良好的口感深受消费者青睐。然而,多数果酒存在香气寡淡、风味典型性不足的问题,极大影响了果酒的感官品质,制约着我国果酒产业的进一步发展。根据香气产生的酿造阶段,果酒香气可以分为品种香、发酵香和陈酿香。微生物在果酒酿造的各个阶段都发挥着重要作用,其生长代谢、产酶类型和产酶活力以及菌种间相互作用均对果酒风味形成有较大影响[1-3]。因此,深入解析酿酒微生物、酶和发酵前冷浸渍等工艺处理对果酒香气的影响机制,创制基于微生物香气化合物调控技术,对于提高果酒香气质量具有重要意义。
本文通过剖析酿酒微生物、酶及发酵前冷浸渍等工艺处理对果酒香气化合物生成的影响,阐明主要香气化合物的生成机理,并探讨优良产香酵母选育的研究进展。最后,对未来果酒风味的研究方向进行展望,旨在为果酒增香酿造技术的创制提供一定理论支持。
1 果酒香气
香气是果酒最重要的感官品质指标。果酒中发现的香气物质超过1 000 种,主要是在微生物生长代谢过程中形成,其产生机制如图1所示。来源于水果的品种香是果酒香气的重要组成部分,有利于果酒典型风味的塑造,然而大多品种香气化合物在酿酒及贮藏过程中会发生一系列变化,果香特征减弱[4];乙醇发酵过程产生的发酵香气构成了果酒香气的基本骨架,对果酒最终风味形成具有决定作用;陈酿过程中品种香气与发酵香气进一步转化,使果酒整体香气更加平衡和谐。
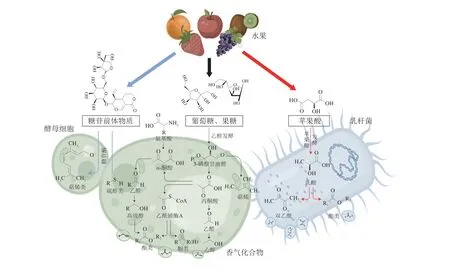
图1 果酒微生物产香机制Fig.1 Mechanism of microbial aroma production in fruit wine
1.1 果酒香气形成机制
在发酵过程中,以糖苷结合态形式存在于水果中的非挥发性香气前体物质在酿酒酵母相关酶的作用下解离出游离态香气,主要包括一些硫醇类和萜烯类化合物,这些物质贡献了果酒主要的品种香气,赋予果酒独特的风味。
总体来说,果酒芳香大部分由发酵香气组成,构成了果酒香气的主体部分,香气化合物包括酯类、醇类、有机酸类、醛酮类、含硫化合物以及萜烯类等[5]。乙醇发酵过程中由酿酒酵母代谢产生的香气化合物贡献了果酒的主要发酵香气。糖酵解产生一些直接或次级代谢物如甘油、乙醇等,构成了果酒的基本香气骨架。氨基酸代谢产生的风味物质主要是高级醇以及与其相关的酯类物质,还包括少量的醛类物质。乙醇发酵结束后,经过苹果酸-乳酸发酵,在降酸的同时生成双乙酰和一些酯类化合物,有助于果酒风味的进一步提升。
陈酿过程中果酒的芳香成分迁移转化,进一步提升了果酒的香气复杂性。关于果酒的陈酿增香机理,一般认为与氧有关:一是“氧化说”,如葡萄酒陈酿期间氧气通过橡木桶的微孔进入酒液,使醇、醛类物质缓慢氧化,高级醇类含量降低;二是“酯化说”,即醇类物质氧化成相应的酸,酸与乙醇反应形成酯,使酯香增强。陈酿香气会随陈酿周期的变化呈现不同的结果。蒲彪等[6]研究了枇杷果酒陈酿期间香气成分的变化规律,发现醇类含量总体减少,酯类含量总体增加,酯香复杂浓郁,且陈酿3 个月后特征香气由辛酸乙酯更替为癸酸乙酯。基于此,果酒陈酿增香的研究方向应为促进醇的氧化和酯的形成。目前果酒催陈方法有电化学催陈、微波催陈、超高压催陈、氧化催陈等[7]。
1.2 主要风味化合物的合成及调控机理
高级醇类和酯类物质是发酵香气的重要组成部分,几乎存在于所有发酵果酒中。因此,研究其合成机理有利于从分子水平上精确调控化合物的含量,提升果酒香气的强度和复杂度[8]。
1.2.1 高级醇类物质
高级醇类物质主要由酵母在α-酮酸发酵过程中形成,与Ehrlich途径降解氨基酸有关[8]。高含量的高级醇会产生威士忌等异味,而低含量的高级醇则会赋予酒青草香、果香等香气[9]。因此,可以通过调节Ehrlich途径调控高级醇的生成。酵母生长阶段、相关酶活力和氨基酸含量等因素均会影响Ehrlich途径的代谢过程,从而影响果酒香气成分组成。如与Ehrlich途径相关的基因BAT1在酵母指数生长期优先表达,而BAT2在稳定生长期过表达,这两个基因的过表达会使异丁醇和异戊醇含量显著增加[10]。
1.2.2 酯类物质
酯类物质是在果酒中发现的最丰富的香气化合物,包括乙酸酯和乙酯两类[11],它们由酵母通过不同的代谢机制形成,但均具有类似水果的芳香,如草莓、甜果、青苹果、香蕉等气味[12]。乙酸酯的形成依赖于乙酸和高级醇,也受酿酒酵母中ATF基因编码的两种醇乙酰转移酶的影响[8]。例如,葡萄酒发酵过程中过表达ATF1基因会导致乙酸酯的产量增加约10~200 倍[13],但酵母过表达ATF1生产乙酸乙酯会对酒中的其他酯类以及挥发性物质产生抑制作用,从而掩盖葡萄酒的品种香气,并产生清漆或指甲油等不良气味[14]。
乙酯的生物合成受乙醇含量的影响较大[15],较低含量的乙醇有利于乙酯的生成,因此研究人员特别重视降低葡萄酒中乙醇的水平[16-18]。最近一项研究发现,通过推动碳通量生产甘油能够减少乙醇的生成[19],然而,这种方法会造成醋酸的积累,使挥发性酸度处于很高水平,导致酿酒故障。另一种能够有效降低乙醇产量的方法是从分子水平去除乙醛脱氢酶基因(ALD6)[20]。与酵母代谢相关的主要化合物的合成如图2所示。
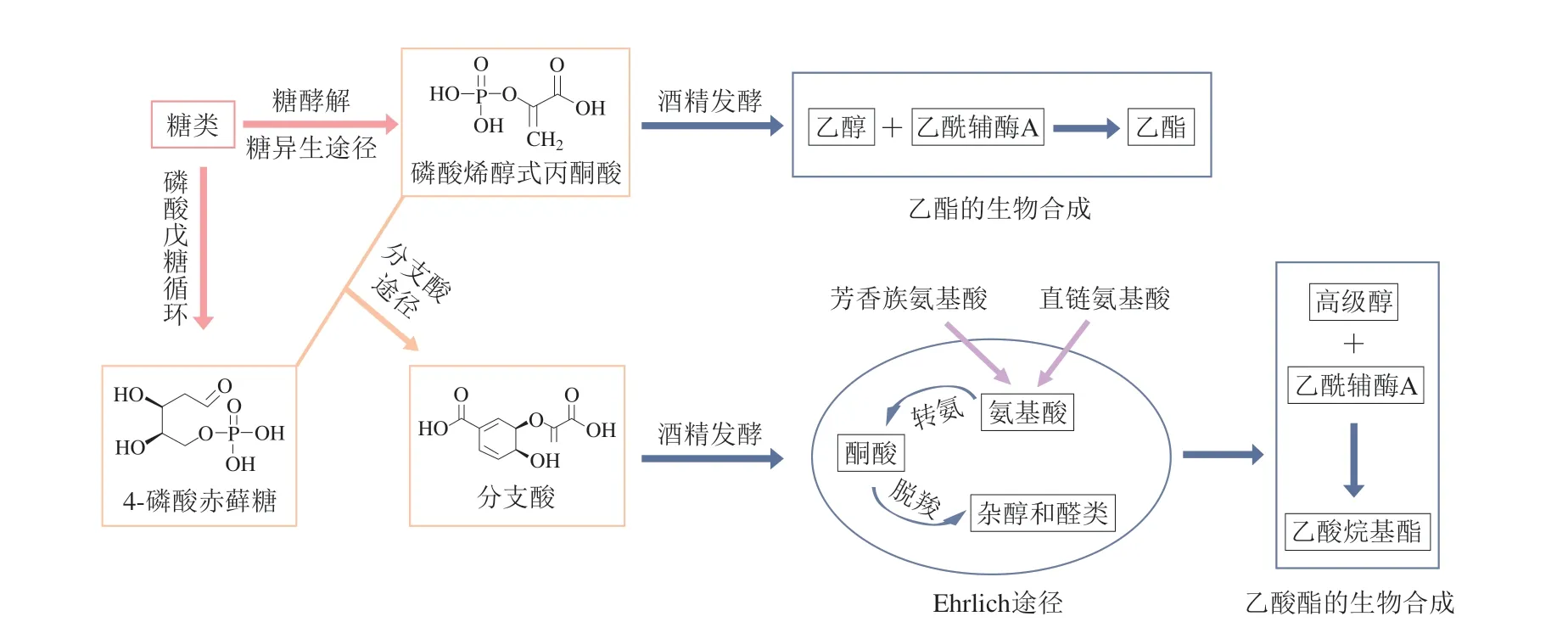
图2 与酵母代谢相关的主要化合物的合成[8]Fig.2 Synthesis of major compounds related to yeast metabolism[8]
2 果酒增香发酵
2.1 酿酒微生物对香气的影响
2.1.1 酵母对香气的影响
产香酵母又称产酯酵母,是一类能够改善发酵产品风味的酵母。自20世纪60年代开始用于白酒生产,之后陆续应用于黄酒、酱油、食醋、葡萄酒、果酒等行业,用于弥补香气不足的缺点。产香酵母能分泌丰富的糖苷酶类,在代谢过程中产生大量酯类、醇类等香气物质,使酒体协调,赋予酒体浓郁的发酵香味。果酒中常见的产香酵母包括克鲁维毕赤酵母(Pichia kluyveri)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、铁红假丝酵母(Candida pulcherrima)、东方伊萨酵母(Issatchenkia orientalis)、季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)等[21]。
2.1.1.1 克鲁维毕赤酵母
克鲁维毕赤酵母具有很强的产酯能力,特别是乙酸苯乙酯和辛酸乙酯[22-23],能够赋予酒类特色的果味、玫瑰味、甜味和蜂蜜味。如由克鲁维毕赤酵母发酵的苹果酒具有浓郁的热带水果味[24]。同时,有研究证明克鲁维毕赤酵母能够增强β-裂解酶活性,从而促进挥发性硫醇的释放,克鲁维毕赤酵母与酿酒酵母混合发酵产生的硫醇含量为酿酒酵母单发酵的7 倍[25]。但在含有克鲁维毕赤酵母的发酵液中发现了戊酸(腐臭气味)含量的增加和硫化氢(臭鸡蛋味)的产生,对酒体产生不利影响[26]。然而,它们的来源尚不确定,有待进一步研究。
2.1.1.2 葡萄汁有孢汉逊酵母
葡萄汁有孢汉逊酵母的主要特征之一是高产乙酸酯[27]。Ciani等[28]检测到由葡萄汁有孢汉逊酵母发酵的白葡萄酒中乙酸乙酯含量约为酿酒酵母发酵的9 倍。Romano等[29]比较葡萄汁有孢汉逊酵母和酿酒酵母生产香气化合物的能力,发现葡萄汁有孢汉逊酵母发酵的酒中乙酸平均质量浓度约为2 g/L,远高于酿酒酵母发酵酒(0.6 g/L)。但是与酿酒酵母相比,用葡萄汁有孢汉逊酵母发酵葡萄酒产生的总脂肪酸含量和总高级醇含量要少得多,这有利于减少酒精味、指甲油味、脂肪味等不良气味[30]。
2.1.1.3 其他产香酵母
铁红假丝酵母与酒中高含量酯的产生有关。在纯培养条件下,铁红假丝酵母产生的乙酸异戊酯含量显著高于其他非酿酒酵母,当质量浓度超过0.001 g/L时,呈现糖果味、水果味和香蕉味[15]。而与酿酒酵母进行混菌发酵时会产生较高水平的乙酸乙酯以及一些与不良风味有关的挥发性物质,当乙酸乙酯质量浓度为0.2 g/L时,葡萄酒的果味与乙酸乙酯呈强相关[31]。季也蒙有孢汉逊酵母与酒中玫瑰和蜂蜜味有关[32],而Hanseniaspora vineae是果香椰子和香草味形成的主要原因[33],此外,Hanseniaspora vineae中支链氨基酸转氨酶(BAT2)和醇酰基转移酶(EEB1)基因的缺失会导致高级醇、脂肪酸和乙酯产量的减少[8]。东方伊萨酵母的存在会导致酒中乙酸乙酯(220~730 mg/L)的过量生成,但其较强的苹果酸降解能力对于发酵是有利的[34]。
2.1.2 混菌发酵对香气的影响
目前果酒工业生产采用酿酒酵母单菌发酵,其发酵速率快、效率高,但生产的果酒缺乏风味复杂性。非酿酒酵母虽然发酵性能差,但在发酵过程中可以通过酶和风味代谢产物的产生改善发酵酒的芳香特性。因此,利用酿酒酵母与非酿酒酵母混合发酵提升果酒感官质量是一种可行的办法。
2.1.2.1 混菌发酵菌种的选择
相较于传统的发酵方式,利用非酿酒酵母与酿酒酵母混合发酵对改善果酒的风味和口感具有积极作用。尹雪林等[35]利用酿酒酵母与戴尔凯氏有孢圆酵母混合发酵猕猴桃酒,共检出23 种挥发性物质,远多于纯种发酵,丰富了猕猴桃酒的香气成分,其中β-大马士酮、香茅醇、α-松油醇等萜烯类物质大量生成,使得猕猴桃酒的花果香更加浓郁。张文文等[36]对酿酒酵母和东方伊萨酵母混合发酵杨梅酒产生的挥发性风味成分进行比较,发现乙酯类和乙酸酯类物质含量较酿酒酵母单发酵分别提高了18.52%和57.34%,同时提高了发酵效率,降低了酿酒酵母单发酵产生的酵母味和癸酸乙酯带来的涩味。采用不同种类的非酿酒酵母与酿酒酵母混合发酵黄桃果酒,产生的香气化合物具有较大的差异,Lachancea thermotolerans组和Metschnikowia pulcherrima组分别有利于苯乙醇和甘油的生成。H.uvarum/S.cerevisiae组的乙酸乙酯含量最高,而T.delbrueckii组高级醇和脂肪酸含量降低,从而减弱了酒中刺鼻的气味[37]。不同果酒混菌发酵的香气特点如表1所示。

表1 不同果酒混菌发酵的香气特点Table 1 Aroma characteristics of different fruit wines produced by mixed fermentation
2.1.2.2 接种方式的选择
在混合发酵过程中,接种策略也会影响酒体香气特征。研究发现顺序接种发酵比同时接种发酵效果更好,因为顺序接种时非酿酒酵母在发酵开始阶段能进行更高程度的代谢表达[48-49]。在樱桃酒发酵中,顺序接种比同时接种发酵产生更多的酯类和高级醇类,包括3-甲基-1-丁醇、己酸乙酯、辛酸乙酯、β-苯乙醇和芳樟醇等,这可能是由于同时接种导致与酿酒酵母的氮竞争,抑制了戴尔凯氏有孢圆酵母的生长[50]。然而,在龙眼酒中显示了与之矛盾的结果,同时接种发酵产生了最高含量的总酯和苯乙醇[45]。
接种比例也是一个必须要考虑的问题。据报道,以1∶1同时接种酿酒酵母和拜氏接合酵母有利于生产乙酯,包括乙酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯等。然而,当接种比例为1∶100或1∶1 000时会生成过量的乙酸乙酯,产生不良气味[51]。张文静等[39]采用本土克鲁维毕赤酵母与酿酒酵母分别以1∶1、10∶1、20∶1的比例混合接种发酵赤霞珠葡萄酒,发现克鲁维毕赤酵母接种比例的增加有利于葡萄酒中丁酸乙酯、己酸乙酯、辛酸乙酯、异戊醇和乳酸乙酯等香气物质含量的提高。Canonico等[52]比较了在曝气条件下,3 种非酿酒酵母与酿酒酵母顺序接种发酵对葡萄酒挥发性成分的影响,发现只有拜氏接合酵母能稍许增加酯类的产量。与酿酒酵母单发酵相比,接种拜氏接合酵母的葡萄酒乙醇体积分数降低了约2%[53];同时花青素含量增加了36%,改善了葡萄酒的颜色,这可能是由于酵母细胞壁中花青素吸附能力的差异[54]。
此外,随着现代生物技术的迅猛发展,基因组学、蛋白质组学以及代谢组学等技术逐渐运用到提升果酒风味方面。Giorello等[8]利用全基因组测序技术分析发现2-苯乙酸酯和2-苯乙醇含量的增加可能与芳香氨基酸转氨酶(ARO8和ARO9)和苯丙酮酸脱羧酶基因的复制有关。Kondo等[55]通过在酿酒酵母中过表达2-酮酸脱羧酶基因(KDC)和醇脱氢酶基因(ADH6、ADH7),检测到更高含量(13 倍)的异丁醇。另外,通过改变缬氨酸生物合成的碳通量和敲除丙酮酸脱羧酶基因(PDC1),可进一步提高异丁醇的产量。ATF1和ATF2基因双缺失会导致乙酸异戊酯无法合成[56],而IRC7基因是影响葡萄酒中4-巯基-4-甲基-2-戊酮形成的关键基因[57]。
2.1.3 苹果酸-乳酸发酵对香气的影响
苹果酸-乳酸发酵是乳酸菌将苹果酸转化为乳酸和CO2的过程。该过程除了能够降低酒液酸度外,还可以调节酒的香气和口感。酒酒球菌、乳杆菌和片球菌等可以通过糖苷酶水解香气前体物质影响酒体香气特征。Spano等[58]报道了β-葡萄糖苷酶基因在乳杆菌中的表达情况,其受到乙醇含量、pH值以及菌株等因素的影响。Olguín等[59]推断,在中等乙醇体积分数(8%~10%)条件下可能会诱导酒酒球菌中bgl基因的表达。然而,β-葡萄糖苷酶活性与基因表达之间的关系尚不清楚,还需要更多的研究。此外,菌种间糖苷酶活性的差异会影响香气化合物的含量,Michlmayr等[60]报道,酒酒球菌组糖苷酶处理葡萄酒中产生的芳樟醇和香茅醇含量明显高于乳杆菌组。此外,乳酸菌与酵母菌混合发酵对酯类的含量有显著影响,最近一项研究显示,混合接种发酵使乙醇发酵与苹果酸-乳酸发酵同时进行,缩短发酵时间的同时提升了果酒香气,乙酯含量显著增加,尤其是乳酸乙酯和琥珀酸二乙酯[61]。
综上,发酵香气的形成不再单一地依赖酿酒酵母,利用酿酒酵母、非酿酒酵母以及乳酸菌等多菌种间的相互作用调控果酒风味品质将受到更多关注,今后对多菌种间的分子相互作用机理应作深入研究。
2.2 风味相关生物酶对香气的影响
果酒酿造过程可将水果果实中以糖苷键合态形式存在的风味物质解离释放到酒中。酿酒微生物能够代谢产生一些风味酶,包括糖苷酶、果胶酶、蛋白酶等,这些酶能够水解香气前体物质,从而促进香气化合物的释放。在酿造前加入外源糖苷酶、果胶酶和糖基水解酶可提高果酒的风味品质[62]。
2.2.1 糖苷酶
糖苷酶可以促进水果中糖苷香气前体物质的释放,主要包括萜烯类和一些多酚类化合物,从而增强和丰富果酒的风味。糖苷键合态前体物质本身不具有香气活性,但可以在β-糖苷酶等香气形成关键酶作用下转化为具有香味的香气物质。萜类糖苷键合态前体物一般由单葡萄糖或双葡萄糖和萜类糖苷配基组成,其中葡萄糖可以进一步与其他糖配基结合,例如α-L-阿拉伯呋喃糖基、α-L-鼠李糖基、β-D-吡喃木糖基,以及β-呋喃芹糖基等[63]。在葡萄冷浸渍中,萜类物质和C13-降异戊二烯类物质通过生物代谢途径,如糖苷键合态前体的水解或生成,这一过程可能受到葡萄果实中β-糖苷酶的活性变化影响。
一些非酿酒酵母包括假丝酵母属(Candida)、毕赤酵母属(Pichia)、汉逊酵母属(Hanseniaspora)等均表现出良好的β-葡萄糖苷酶活性[64]。例如,葡萄酒中萜烯类以及降异戊二烯类物质含量的增加与葡萄汁有孢汉逊酵母中β-葡萄糖苷酶的活性密切相关[65]。Liu Xiaozhu等[66]从刺梨中筛选出Wickerhamomyces anomalusC4菌株的β-葡萄糖苷酶活性最强,为酿酒酵母X16的1.65 倍,并且体积分数15%的乙醇、5 g/100 mL葡萄糖、Cu2+等因素均会抑制其活性。来源于不同菌株的β-葡萄糖苷酶活性及产香能力也有明显差异。Hu Kai等[67]应用半定量比色法筛选了来自中国3 个不同地区的酵母菌——H.uvarum、P.membranifaciens、Rhodotorula mucilaginosa,发现来自H.uvarum中的β-葡萄糖苷酶活性最高,且对C13-正异戊二烯和一些萜烯的芳香糖苷物质具有催化特异性,丰富了葡萄酒中新鲜花香、浆果和坚果等香气。
2.2.2 果胶酶与蛋白酶
果胶酶可破坏植物细胞壁结构,将果胶聚合物降解为半乳糖醛酸,从而促进果汁澄清过滤。同时,在果酒发酵前的浸渍过程中,果胶酶可以将糖苷键合的风味前体切割成芳香活性苷元,从而增强果酒的风味特性。例如,Rollero等[68]从设拉子葡萄汁中筛选出一株具有高果胶酶活性的酵母Kluyveromyces marxianus,此菌株可促进葡萄酒发酵过程中产生更多的苯乙醇和苯乙酸乙酯,而且还能够增加多酚和花青素的含量。
蛋白酶主要通过为酵母提供氮源影响果酒香气的形成。非酿酒酵母是蛋白酶的重要来源,在最近的一项研究中,将来自美极梅奇酵母异源表达的天冬氨酸蛋白酶MpAPr1添加到长相思葡萄汁中[69]。结果表明,该酶在发酵过程中具有活性,并在一定程度上降解了葡萄酒蛋白[70],促进氨基酸水解,为酿酒酵母的生长提供更好的氮源,从而对香气化合物产生有利影响[71]。此外,E3泛素-蛋白连接酶被证明可通过增加Ehrlich通路相关基因ARO9和BAT1以及去甲基化通路基因STR3表达,抑制ARO10、PDC1、PDC5和PDC6基因表达,调节高级醇的生成[72]。这两种途径的控制为工业应用提供了巨大的潜力,包括乙醇生产过剩和风味质量控制。然而,目前为止仍未找到合适的控制Ehrlich途径和去甲基化途径的方法。
2.2.3 其他酶
关键的单萜和降异戊二烯香气化合物在酿酒过程中被酵母和产香细菌分泌的糖苷酶、酯酶、C—S裂合酶和脱羧酶等降解为游离态释放[62]。目前,提高单帖类化合物策略主要有以下两种:一种是在发酵过程中或发酵后添加来自其他微生物的外源性酶制剂以改善糖基化结合物的水解,商业酶制剂一般包含果胶酶、葡聚糖酶和木聚糖酶,主要从曲霉中获得,然而这些酶缺乏特异性,可能会导致对风味不利的二次反应;另一种是采用少数非酿酒酵母,如葡萄汁有孢汉逊酵母的水解酶活性较高,能够促进与糖苷结合的单帖类物质前体水解,导致单萜类物质含量增加[73]。
从以上研究结果可以发现,发酵过程中添加风味胞外酶和某些非酿酒酵母可以有效改善成酒的品种香气。其主要原理是利用外源酶或非酿酒酵母分泌的高活性糖苷酶水解水果果皮中的香气糖苷前体,从而释放游离态品种香气成分,增强果酒的典型风味。
2.3 发酵前处理工艺对香气的影响
在葡萄破碎期间,酶促氧化反应、β-胡萝卜素物质(其他类胡萝卜素)的降解被认为能够产生多种类型的降异戊二烯类物。这类化合物主要包括β-大马士酮(奇异水果的香气)、β-紫罗兰酮(紫罗兰花的香气)、3-氧代-β-紫罗兰酮(烟草气味)和Vitispirane(新鲜的花香果香和/或异国花卉和泥质木本植物的香气)等。低温冷浸渍工艺可以保留小分子香气化合物,增加香气复杂性。有研究表明,在冷浸渍和低温发酵过程中,醇类、酯类、烷烃类物质等发酵香气也会有所增加,脂肪味和化学味有所下降[74]。在酿酒酵母与毕赤酵母混合发酵过程中,适度延长冷浸渍时间(3 d),3-甲基丁醇、乙酸乙酯和乙酸异戊酯的含量会明显增加。此外,如芳樟醇、α-萜品醇和β-香茅醇等萜烯类香气成分主要来源于果皮,说明通过冷浸渍工艺可以充分浸提果皮中的芳香类物质,提高果酒的品种香气,从而增加果酒的香气浓郁度。
由于天然酵母、微生物和相关酶的作用,较高含量的己醇、顺-6-壬烯醇主要是在浸渍过程中形成[75]。冷浸渍过程中一些耐低温的产香酵母可以使葡萄酒的主香气成分含量增加[76]。研究发现,通常当温度超过25 ℃时就会抑制非酿酒酵母的生长。有时低温更有利于其发酵作用,如柠檬型克勒克酵母在10 ℃较25 ℃时发酵更好,该酵母可产大量的甘油,可以调节细胞内的氧化还原电位,使葡萄酒具有更好的柔和性,这种甘油含量高的葡萄酒在新西兰、澳大利亚都很受欢迎。
3 产香酵母的选育
酵母产香能力直接影响成酒的风味质量,因此酵母的选育备受重视。酵母的选育方法主要包括自然突变菌株的选育、杂交育种、基因工程育种、诱变育种等[77]。传统的育种方法以自然突变为主,从不同原料(水果、土壤)中筛选并分离出具有特殊性能的新菌株。例如,吴卓凡等[78]从自然界中筛选出发酵能力强且风味优良的枇杷果酒专用酿酒酵母,测定并分析了其风味物质组成,相比商业菌株,醇类、酯类和酸类物质含量分别高31%、86%和25%,总挥发性物质增加了45%,具有良好的工业应用前景。冯涛等[79]从不同地区的葡萄园土壤中筛选分离出产香性能良好的酿酒酵母,测定并比较了其与商业酵母在产香方面的差异,证实了筛选出的酵母可以显著提升发酵酒的整体香气。
杂交育种可以将两个或多个优良性状结合,构建具有优良性状的新菌株。Wang Zhouli等[80]通过原生质体融合技术构建了基于酿酒酵母和乙醇念珠菌的新型重组融合酵母,在酿造香气浓郁且低酒精度的苹果酒方面有巨大潜力。基因工程育种由于外源基因的安全性一直未得到认可,其在酵母选育中应用受到很大限制。
诱变育种方法可以使生物突变率显著升高,但要获得性状优良的正向突变菌株需要花费相当长的时间,并且优良酵母选育涉及到较多的酿酒工艺学指标(如产乙醇能力、发酵速率、高糖耐受性、pH耐受性等),需要进行多年、多点的生产试验,筛选进程相对较慢。近几年常压室温等离子体诱变技术的出现有效地解决了这一难题,并广泛用于筛选优良产香酵母。Tian Tiantian等[81]通过一种联合策略,包括常压室温等离子体诱变系统、高通量筛选技术以及适应性进化策略,从突变库中获得了一株耐酸性强、产香和遗传稳定性良好的菌株ET008-c54,将该菌株用于发酵青梅酒,使关键风味化合物的总质量浓度由17.8 mg/L提升至27.0 mg/L,提高了51.9%,特征香气物质安息香醛质量浓度由1.8 mg/L提升到2.8 mg/L,解决了青梅酒风味不足和典型性不突出的问题。冯鹏鹏等[82]同样采用常压室温等离子体诱变方法获得了低产高级醇的诱变菌株,提高了成酒的风味品质。
4 结语
本文综述了酿酒微生物、酶对果酒香气的影响,尽管利用产香酵母提高葡萄酒风味的复杂性越来越普遍,但非酿酒酵母在其他果酒生产中的应用仍然很少。且果酒中部分关键风味化合物的合成途径及微生物代谢通路仍需要进一步研究。当前,果酒酿造过程中酿酒酵母与非酿酒酵母分子相互作用机制仍不清晰,高通量技术可用于揭示微生物的相互作用,从而有利于更好地设计混合培养物,提升混菌发酵的控制水平。此外,果酒陈酿周期较长,但目前催陈技术仍不成熟,有待进一步研究。未来,在全基因组测序技术快速发展的带动下,基因组学、蛋白质组学、代谢组学以及风味组学的相关技术也将促进对微生物合成风味化合物代谢途径的认识和对风味代谢物质调控机理的探索,为创制果酒增香酿造技术奠定基础。

