酿酒酵母乙酸代谢调控机制及低产菌株选育的研究进展
邓海霞,郭晨晨,李二虎,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.果蔬加工与品质调控湖北省重点实验室(华中农业大学),湖北 武汉 430070)
果酒是水果经破碎、榨汁、发酵、澄清、陈酿等工艺加工后获得的低酒精度饮料,其酒精体积分数一般在7%~18%。经发酵酿制而成的果酒,既保留了水果的风味又增加了其营养价值,符合人们当前的消费需求,受到广大消费者的喜爱。果酒中的有机酸包括固定酸和挥发酸。乙酸作为挥发酸的主要成分,其含量高低是影响果酒品质的重要因素[1]。乙酸含量过高不仅会导致果酒口感苦涩、刺激,而且会导致酵母细胞死亡,阻碍发酵正常进行[2]。通常情况下,果酒中乙酸质量浓度在0.1~0.5 g/L,当质量浓度超过0.8 g/L就会出现酸败味[3]。2020年制定的《果酒通用技术要求》规定,果酒中的乙酸质量浓度应不高于1.2 g/L。但是实际生产中因原料质量及酿造工艺等因素的影响,常有果酒乙酸含量超标的现象发生,阻碍了我国果酒产业的高质量发展。
果酒中的乙酸主要来源于3 个方面:1)果酒发酵原料带入。水果成熟后易受病虫害浸染,表面滋生微生物,由病原体感染或自然形成引起的果皮破裂,使得醋酸菌能够进入果实的内部,并利用天然酵母发酵产生的乙醇作为其首选碳源,使得果汁中乙酸含量超标[4-5];2)果酒发酵过程酿酒酵母(Saccharomyces cerevisiae)代谢生成。在酒精发酵过程中,丙酮酸脱氢酶活性在厌氧条件下受到抑制,阻碍了丙酮酸转化成乙酰辅酶A。为了满足酵母细胞基本能量和物质的合成,酵母丙酮酸脱氢酶旁路被激活,乙酸则是酿酒酵母通过丙酮酸脱氢酶旁路形成的一种重要副产物,主要产生于酒精发酵初期,其产量受酵母菌株[6-7]、含糖量[8-10]、氮源[11-12]和发酵条件[13-16]等因素影响;3)陈酿阶段产生。果酒在陈酿过程中,如果贮存管理不科学,果酒与空气接触,感染杂菌或酒中的乙醇被氧化,也会导致乙酸含量增加[17]。其中,在发酵原料和陈酿阶段产生的乙酸,国内外学者已开展了大量研究,并提出了相应的生产控制措施[18-19]。而针对酒精发酵过程中酿酒酵母生成导致果酒乙酸含量过高的问题,学术界和工业界至今仍未能找到有效的解决措施。虽然通过优化发酵工艺条件能够在短期内快速调整果酒中乙酸含量[20-21],但是由于原料的差异性以及发酵环境的复杂性,对生产设备和发酵工艺提出了较高的要求。因此,要想从根本上解决果酒乙酸含量超标的问题,应该从酿酒酵母乙酸代谢调控机制出发,选育优良的低产乙酸酵母菌株。本文介绍酒精发酵过程中酿酒酵母乙酸代谢途径及其调控基因,并在此基础上阐述酿酒酵母乙酸调控机制研究策略以及低产乙酸菌株选育方法的研究进展,以期为精准调控果酒中乙酸含量、提高果酒品质提供理论指导。
1 酿酒酵母乙酸代谢途径及调控基因
酒精发酵过程中酿酒酵母产生的乙酸是引起果酒挥发酸含量升高的重要原因。研究乙酸在酿酒酵母细胞内的代谢过程对控制果酒乙酸有重要意义。图1展示了酿酒酵母中乙酸代谢的主要途径及关键调控基因。
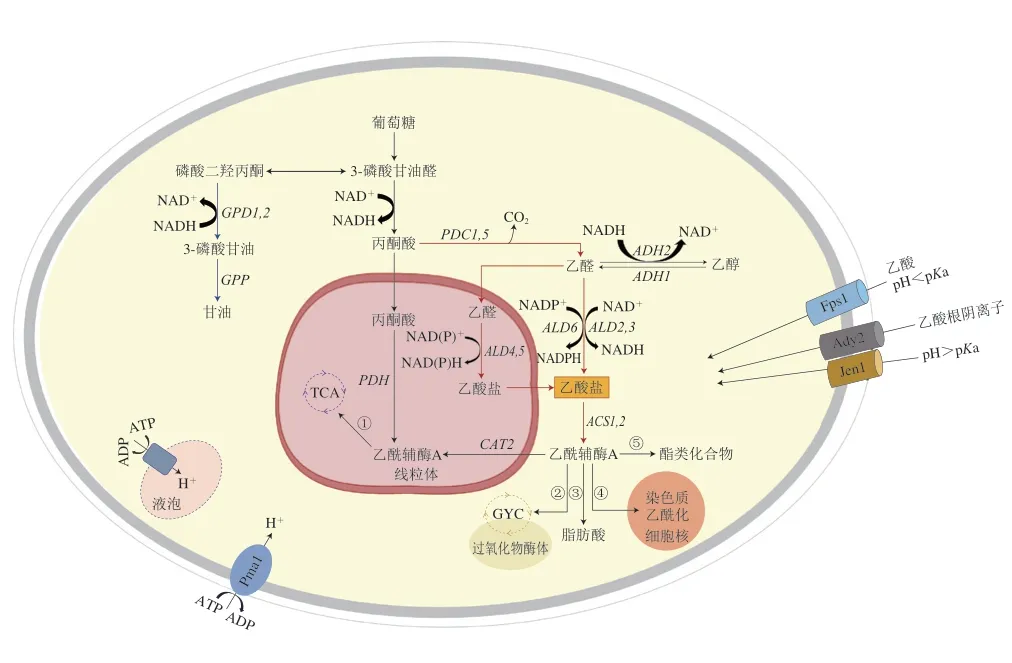
图1 酿酒酵母乙酸转运及代谢途径[22-26]Fig.1 Acetic acid transportation and metabolism pathways in S.cerevisiae[22-26]
1.1 乙酸的合成代谢
酿酒酵母代谢生成乙酸的实际生化途径虽然还没有明确阐明,但国内外学者普遍认为乙酸是酿酒酵母经过丙酮酸脱氢酶旁路的副产物[27-28]。该途径涉及到丙酮酸在丙酮酸脱羧酶的催化下生成乙醛,之后乙醛通过乙醛脱氢酶被氧化为乙酸(图1)。Verduvn等[29]研究发现,在厌氧条件下,具有最低乙醛脱氢酶活性酵母产生的乙酸含量最低。在高糖发酵基质中,酿酒酵母合成乙酸与甘油总是同步的,因此有人提出酿酒酵母产生乙酸以平衡响应高渗应激和甘油过量产生的NAD+可能是乙酸形成的机制[30-31]。除了上述两种说法以外,Jost等[32]提出乙酸也可由乙酰辅酶A水解酶水解乙酰辅酶A以及柠檬酸裂解酶裂解柠檬酸生成。
1.2 乙酸的分解代谢
乙酸在酵母细胞中的转运取决于胞外pH值(图1)。在低pH值条件下(pH<4.76),乙酸处于未解离(质子化)状态,可以通过水甘油孔通道蛋白(Fps1p)或通过简单扩散进入细胞[23]。但Mollapour等[33]却发现当酵母细胞被突然暴露在高质量浓度乙酸(6 g/L)环境下时,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)会被迅速激活,使Fps1p磷酸化,这种磷酸化会导致Fps1p的内吞和降解,阻止乙酸进入细胞。未解离的乙酸一旦进入细胞质,就会解离成乙酸根阴离子和质子,质子可以通过质膜质子泵ATP酶(Pma1p)或液泡质子泵ATP酶(V-ATPase)被排出到细胞质外,以恢复细胞内pH值[34]。当外界pH值高于4.76时,乙酸根离子主要通过两个电中性转运蛋白(Ady2p和Jen1p)进入细胞内[35]。
进入细胞的乙酸根阴离子以乙酸盐的形式进入丙酮酸脱氢酶旁路被代谢。乙酸盐在乙酰辅酶A合成酶的催化下与辅酶A结合生成乙酰辅酶A。乙酰辅酶A作为酿酒酵母体内一种重要的辅因子,参与了包括TCA、GYC[25]、脂肪酸合成[36]、酯类化合物合成[32]和染色质蛋白乙酰化[26]等细胞内多种生化反应。
1.3 乙酸代谢调控基因
酿酒酵母生成乙酸是多个基因共同调控的结果。目前对乙酸调控基因的研究主要集中在丙酮酸脱氢酶旁路途径和甘油合成途径(图1),现对这两条代谢通路的关键调控基因以及相关转录因子进行介绍,并阐述其对乙酸的调控作用。
1.3.1 丙酮酸脱氢酶旁路途径调控基因
丙酮酸经过丙酮酸脱羧酶脱羧生成乙醛和二氧化碳,该反应中的丙酮酸脱羧酶主要由PDC1和PDC5控制编码,且该酶80%~90%的活性来源于Pdc1p[37],而Wang Depei等[38]研究表明,PDC5才是完全实现丙酮酸脱羧酶活性的主导基因。PDC1被报道在厌氧条件下对酵母乙酸的生成影响不显著[39],但Curiel等[40]在有氧条件下敲除酵母的PDC1,结果发现乙酸产量下降了57%。说明PDC1对乙酸的调控作用可能与氧气有关。
乙醛在乙醛脱氢酶催化作用下被氧化为乙酸,并伴随着NAD+还原成NADH。酿酒酵母中已鉴定出3 种编码细胞质乙醛脱氢酶的基因(ALD2、ALD3和ALD6)和2 种编码线粒体乙醛脱氢酶基因(ALD4和ALD5)。ALD2与ALD3使用NAD+作为辅因子,其活性受到应激胁迫诱导和葡萄糖抑制[41]。ALD6由Mg2+激活并优先利用NADP+作为辅助因子,对葡萄糖和乙醇条件下酵母的生长发挥作用[42]。ALD5是编码线粒体乙醛脱氢酶的一种次要基因,由K+激活,并利用NAD+和NADP+作为辅助因子,在电子传递链组分的调节或生物合成中发挥作用,并受渗透应力诱导[43-44]。ALD4由K+激活,主要参与酵母在乙醇条件下的生长,对酵母在葡萄糖条件下的生长无明显作用[45]。目前,尚不清楚是哪一种编码乙醛脱氢酶的基因在乙酸调控方面占主导地位,不同的菌株背景和发酵条件下,基因表达情况也有所不同。在大部分果酒发酵过程中,ALD6主要负责酒精发酵过程中乙酸的生成,ALD3和ALD4的表达均受到葡萄糖的抑制[46-48]。在模拟葡萄汁发酵过程中,ALD6主要负责乙酸的合成,ALD5起辅助作用[49]。若删除野生型菌株的一个或两个拷贝的ALD6,可以使酒中乙酸产量分别降低为野生型的75%和40%,而ALD4可以部分补偿ALD6缺失引起的乙酸产量降低[40,49]。在冰酒发酵的高渗透胁迫条件下,ALD3的高水平表达似乎有助于维持酿酒酵母细胞内氧化还原平衡和发酵过程中乙酸的产生[9,50]。
乙酸在乙酰辅酶A合成酶的催化下与辅酶A结合生成乙酰辅酶A,并伴随着ATP水解。乙酰辅酶A合成酶受两个基因编码,分别是ACS1和ACS2。研究表明由ACS1编码的酶与乙酸盐的亲和力约是ACS2编码酶的30 倍,但ACS1的表达在厌氧条件下会受葡萄糖抑制,这种抑制作用会在ACS2缺失时被削弱[51]。Shiba等[52]研究发现酿酒酵母的ALD6过表达会导致乙酸产量会升高,ACS1过表达导致乙酸产量降低,而当二者同时过表达时,乙酸产量降低,说明ACS1对乙酸的调控作用比ALD6更显著。
1.3.2 甘油合成途径调控基因
酒精发酵初期,酿酒酵母细胞内乙醇脱氢酶的活性被抑制,氧化还原反应不平衡引发甘油的合成。甘油合成过程对NADH的需求增加,诱导酿酒酵母生成更多的乙酸以平衡甘油合成途径中消耗的NADH[31]。磷酸二羟丙酮是合成甘油的底物,在细胞质中经NADH依赖性甘油-3-磷酸脱氢酶和甘油-3-磷酸酶催化后转化为甘油。甘油-3-磷酸脱氢酶是甘油形成的关键限速酶,由两个同源基因(GPD1和GPD2)编码[53]。GPD1的表达受到渗透压应激诱导并通过高渗甘油信号(highosmolarity glycerol response,HOG)途径调节[54]。GPD2的表达不受外部渗透压变化的影响,但与厌氧条件下维持氧化还原的平衡有关[55]。Pigeau等[50,56]发现在冰酒发酵过程中,与稀释后的冰酒汁相比,高糖胁迫条件下冰酒中乙酸含量增加了7 倍,酿酒酵母GPD1表达量增加了2.5 倍,但GPD2表达量变化不显著。
1.3.3 转录因子
除了上述的调控基因外,一些转录因子可通过调控编码乙醛脱氢酶的基因或蛋白进而调控乙酸的生成。Rsf2p是一种可以调节ALD6的转录因子[57],但敲除菌株的RSF2对酵母乙酸生成无显著影响[47],说明RSF2对乙酸调控不具有主要作用。Aaf1p是一种锌指转录因子,在葡萄酒发酵条件下定位于细胞核中[47]。Aaf1p可直接或者通过介导Ald6p调节ALD4和ALD6的转录水平,从而调节乙酸的生成。Walkey等[58]研究发现,AAF1敲除菌株产生的乙酸量比野生型菌株少39%左右,其效果比RSF2的敲除更显著。Yap1p是一种控制酿酒酵母氧化应激反应的转录因子。氧化条件下的ChIP芯片全基因组定位分析表明,Yap1可直接与ALD5和ALD6基因的启动子相互作用,参与酿酒酵母乙酸的调控[59]。Cordente等[60]发现,YAP1突变的酿酒酵母表现出较低的乙酸产量和较低的乙醛脱氢酶活性。
研究表明,当酿酒酵母细胞中编码乙醛脱氢酶的5 个基因都被敲除时,该缺失菌株依旧可以产生乙酸[49],说明还存在其他调控基因可通过影响乙醛脱氢酶活性进而影响乙酸的生成,或者是除丙酮酸脱氢酶旁路外,可能还存在其他产生乙酸的途径。因此,酿酒酵母乙酸代谢通路及其调控的关键基因,仍需进一步探索和挖掘。
2 酿酒酵母乙酸代谢调控机制研究策略
为了更有效地调控酿酒酵母乙酸的生成,需要深入揭示酵母乙酸调控机制。酿酒酵母产乙酸特性是受多基因控制的数量性状,是基因与基因、基因与环境互作的结果,每个基因都具有复杂的表达调控网络,这给低产乙酸分子机制的解析提出了挑战。可采用组学技术和数量性状基因座(quantitative trait loci,QTL)定位技术挖掘调控酿酒酵母乙酸产量的关键基因,解析乙酸表型-基因型关系,既可明晰酿酒酵母调控乙酸代谢的分子机制,又能够为低产乙酸酵母菌株选育提供理论依据。
2.1 组学技术
组学技术的发展为了解菌株的代谢途径、寻找差异表达基因及生物标志物提供了有力的分析平台。利用下一代测序技术进行测序比对,通过转录组学、代谢组学等技术对基因及代谢物进行定性定量,结合生物信息学分析对其进行功能注释及分类,寻找基因表达及代谢物丰度差异,进而解析基因型与表型关系。
转录组学通常用于比较不同组织或生理状况下基因表达水平的差异,发现与特定生理功能相关的基因,从而研究基因与相关代谢通路调控规律。转录组分析技术主要包括基于杂交的DNA微阵列技术、基于标签的基因表达系列分析和大规模平行测序技术、基于新一代高通量测序的转录组测序(RNA sequencing,RNA-seq)技术。RNA-seq技术通过新一代测序技术对cDNA文库进行测序,对转录本进行全方位的研究,无需进行荧光标记,数据准确可靠、操作简单方便,逐渐成为转录组研究中应用最广泛的技术。Baumann等[61]通过RNA-seq技术确定酿酒酵母与其高产辛酸改造菌株的差异表达基因,通过对这些基因进行敲除和过表达,验证了RPL40B的过表达对辛酸的产生发挥了重要的作用。沈璐[62]利用RNA-Seq技术研究抗葡萄糖阻遏菌株乳源酵母Kluyveromyces marxianus246解阻遏的机制,通过对不同碳源的细胞进行转录组测序,确定了MIG1的低表达使得半乳糖代谢途径相关基因获得适应性进化,从而具有抗葡萄糖阻遏作用。对酿酒酵母乙酸代谢机制的研究,也可利用转录组学技术比较同一菌株不同时期或不同乙酸表型酿酒酵母菌株同一时期的基因表达,挖掘与乙酸产量密切连锁的主效基因,揭示表型背后的分子机制。
代谢组学是研究生物体内因基因或基因表达被扰动而导致的代谢产物、代谢途径变化规律的学科。代谢组技术通常基于质谱与气相色谱、高效液相色谱等技术联用对代谢产物进行定性定量分析[63]。代谢组学技术通常被用于确定生物体系代谢途径,从代谢的水平上揭示物质调控机制。Ogawa等[64]采用非靶向代谢组学结合气相色谱-质谱技术研究酒花酵母的葡萄糖酸代谢,结果表明葡萄糖酸的代谢涉及到包括TCA循环和甘油脂代谢在内的4 个代谢途径,提出可基于这些途径进一步调控葡萄酒中的葡萄糖酸含量。依靠代谢组学能够找到与乙酸相关的代谢通路,从而进一步探究酿酒酵母的乙酸代谢途径及调控机制。
利用转录组分析可以得到大量差异基因以及众多调控网络,但难以确定关键调控途径。代谢组分析可以反映表型状态的变化,但无法解释表型的基因机理。因此,越来越多学者选择采用组学联合的方法分析差异基因与差异代谢物的相关性,确定关键基因,构建核心调控网络,阐释生物学现象。Zhang Zhiyong等[65]采用代谢组学结合转录组学探究马克斯克鲁维酵母(Kluyveromyces marxianus)和酿酒酵母在苹果酒中静态发酵条件下的挥发性化合物含量及代谢途径变化规律,分析表明马克斯克鲁维酵母糖酵解和乙醇合成途径的相关基因都有很高的表达量,从而促进了乙酸乙酯和相关酯的合成。Zhu Yuanyuan等[66]以转录组和代谢组研究木质纤维素抑制剂对树干毕赤酵母(Pichia stipitis)的代谢机制影响,发现在抑制剂的作用下,毕赤酵母细胞内参与碳源代谢的基因表达显著下调,氨基酸合成途径基因表达显著上调。转录组学和代谢组学相结合策略也可被应用在研究酿酒酵母乙酸代谢的分子机制上,通过转录组和代谢组测序获得差异表达基因和差异代谢物,并计算差异基因和差异代谢物的相关性,构建相关性网络,找出引起乙酸变化的关键作用基因,确定关键的调控通路。
2.2 数量性状基因座定位
酿酒酵母乙酸产量是受多基因与环境共同调控的复杂数量性状。如果能找到与乙酸产量密切连锁的主效基因,将会对酵母乙酸调控机制的研究以及低产菌株的选育工作提供很大的帮助。近年来,随着分子生物学技术的发展,复杂数量性状主效基因的挖掘效率和成功率不断提高[67-68]。解析数量性状基因座的一般方式为:首先通过连锁分析等方法从目标物种的基因组上定位与目标数量性状间存在显著相关关系的区段,即QTL;随后在定位到的QTL区段内通过筛选与鉴定,寻找数量性状候选基因(quantitative trait gene,QTG);采用基因置换、相互半合子分析(reciprocal hemizygosity analysis,RHA)等方法对候选基因进行克隆鉴定;通过等位基因间的比对寻找引发该数量性状改变的有效数量性状核苷酸突变(quantitative trait nucleotide,QTN),最终对其分子机制进行解析[67]。Offei等[69]以布拉氏酵母(Saccharomyces boulardii)与酿酒酵母为亲本菌株,采用混合分离全基因组序列分析,对布拉氏酵母高乙酸产量基因进行QTL定位,结合互惠半合子分析、等位基因置换、序列分析确定了布拉氏酵母候选基因sdh1F317Y、whi2S287*对高乙酸产量的重要作用。Marullo等[70]对两株产乙酸量存在差异的亲本菌株的后代采用高密度核苷酸微阵列进行基因分型,并建立性状与分子遗传标记之间的统计联系,从而定位决定乙酸产量显著差异的QTL,进一步研究表明,该QTL仅在以天冬酰胺为主要氮源时才有效。
定位QTL的方法主要有构建遗传图谱法、全基因组关联分析法(genome-wide association study,GWAS)和分离群体分组分析法(bulked segregant analysis,BSA)。传统的构建遗传图谱法,需要对所有个体进行基因分型和表型测定,时间长、成本高。GWAS涉及使用从种群或物种中采样的遗传多样性个体识别遗传变异和性状之间的关联[71],具有更高的遗传作图分辨率,并能够对物种中存在的遗传多样性进行更广泛的采样。GWAS在检测人群中常见的遗传变异方面最为有效,因此低频的因果变异可能无法识别[72]。随着高通量测序的发展,下一代测序技术为目标性状连锁标记及基因快速定位提供了有效手段,分离群体分组分析与全基因组重测序技术相结合(BSA-seq),具有所需样本量少、成本低、效率高等特点,已成为QTL定位的主流方法。自1991年由Michelmore等报道以来[73],BSA-seq技术在作物农艺性状[74]和酵母数量性状[75-76]基因定位的研究中应用十分广泛。目前,BSA-seq技术已成功用于探索调控酿酒酵母耐受性[77]、发酵速率[78]、氮源利用[79]、甘油产量[80]、香气合成[81]及微生物互作[82]等数量性状的主效基因。因此,可利用BSA-seq策略挖掘果酒发酵过程中酿酒酵母乙酸产量性状主效QTL,从而分析酿酒酵母调控乙酸生成分子机制。如图2所示,首先筛选出两株乙酸产量差异极显著的酿酒酵母,形成后代杂合孢子,后代孢子是携带来自亲本(红色和蓝色片段)遗传物质的嵌合体;对F2代进行表型筛选,分别构建低产乙酸混池和高产乙酸混池,对不同表型的子代混池样本及亲本进行全基因组重测序,通过生物信息学分析实现QTL定位[67]。
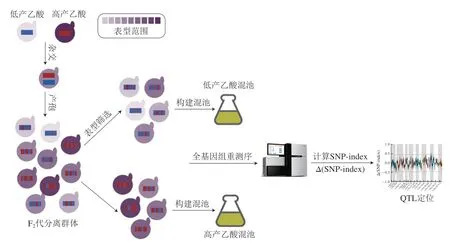
图2 基于BSA-seq技术定位酿酒酵母乙酸产量主效数量基因座的方法示意图[67]Fig.2 Schematic diagram of the method for locating the major effect QTL of acetic acid production in S.cerevisiae based on BSA-seq technology[67]
3 低产乙酸酿酒酵母的选育方法
为了控制酿酒酵母产生乙酸,以往采取的措施主要是从自然发酵中筛选低产乙酸的菌株[83-84]。然而这种方式不仅消耗大量的人力和物力,而且所筛菌株性状往往不够理想,不能够满足现代产业的需要。随着酿酒酵母乙酸代谢机制研究的不断深入,研究人员逐渐倾向于依靠诱变、杂交和代谢工程等功能菌种选育技术选育出优良的低产乙酸酵母菌株,实现果酒乙酸的调控。
3.1 诱变育种
诱变育种是目前应用最广泛的菌种选育技术,主要是指采用物理和化学等诱变剂处理酿酒酵母,使其基因的突变率大幅提高,从而获得具有特定功能菌株的育种技术。物理诱变包括紫外诱变与常压室温等离子体诱变技术,通过增大酿酒酵母菌株DNA的碱基错配率,进而提高酿酒酵母的基因突变率。紫外诱变通过破坏菌株DNA双链解旋和碱基配对,影响菌株DNA正常复制,形成突变体[85]。常压室温等离子体技术通过发射等离子体,造成菌株DNA损伤以及不完全修复,进而形成可稳定遗传的突变株[86]。陈雪等[87]通过常压室温等离子体对酿酒酵母进行诱变,得到一株低产挥发酸突变菌株,该菌株遗传稳定性好,酿造的冰酒挥发酸含量低,但导致其低产挥发酸的原因有待探究。
化学诱变是一种经济方便的育种方法,并且较物理诱变,采用不同化学诱变剂对染色体、基因等的诱变专一性更强[88]。张菡[89]以浅蓝菌素为诱变剂处理酿酒酵母,从得到的浅蓝菌素突变体中筛选出稳定、高效的低产乙酸目标菌株,ALD6的碱基突变可能是突变菌株低产乙酸的原因。Mizuno等[90]从酿酒酵母的2-脱氧葡萄糖(2-deoxyglucose,2-DG)突变体中分离出具有低乙酸和高乙醇生产力的突变体2-DGR19,并且通过DNA微阵列分析发现,ADH的高表达与ALD的低表达是导致该突变体具有这些特性的主要原因。
单一的诱变方式效率较低,且很少能得到性状十分优良同时能够稳定遗传的菌株。因此,有些学者选择采用物理诱变与化学诱变技术相结合的方式来提高筛菌效率。Kosugi等[91]通过紫外诱变分离耐2,4-二硝基苯酚(2,4-dinitrophenol,2,4-DNP)的清酒酵母菌株,这些菌株显示出高产苹果酸和低产乙酸,进一步研究发现低线粒体活性和高NADH/NAD+比率是导致两种有机酸含量改变的原因。物理和化学诱变技术都是目前比较常见的育种技术,操作简单、成本低。但酵母菌的基因结构使得这种育种方法应用起来有局限性,因为大部分的酵母基因都有2 个以上的拷贝,隐性突变的选择很困难[92],而且长期使用诱变剂会导致菌株产生耐受性。
3.2 杂交育种
杂交育种是指将不同优良表型的亲本菌株进行杂交,从而得到具有双亲优良性状杂交种的育种方法。杂交一般可通过4 种方式实现:孢子杂交、罕见杂交、大规模杂交、原生质体融合。孢子杂交类似于自然交配,由具有不同交配型的孢子接合,杂交成功率大,遗传稳定性好[93],但实验中无法对孢子的表型进行表征,形成的杂交种可能会丢失亲本的优良表型[94]。大规模杂交使用大量来源于不同亲本的单倍体进行随机交配,可以以快速且相对容易的方式获得多种有益突变累加在一起的表型。Steensels等[95]通过从301 株酵母菌株中选择3 株具有遗传多样性的酿酒酵母作为亲本菌株,以果香化合物为标准对其142 个分离孢子进行筛选,共选择17 个单倍体进行杂交,最终获得高产乙酸异戊酯的杂交菌株H44,乙酸异戊酯产量比亲本菌株(Y354和Y397)提高了152%和145%。罕见杂交是指当二倍体酵母菌株交配型位点的杂合性自发消失时,该酵母可与其互补的酵母菌株杂交,这种方式交配率极低,往往需要选择性标记分离杂种。原生质体融合包括去除亲本细胞壁、融合原生质体、新细胞壁合成,这种方法不需要考虑菌株的产孢及交配能力,并且形成的杂种基因组具有较低的稳定性[96]。Bellon等[97]将酿酒酵母与低产乙酸的贝酵母(Saccharomyces bayanus)进行种间杂交获得杂交酵母,两种杂交种产生的乙酸水平约为酿酒酵母的65%,并可用于生产具有特征风味与香气的葡萄酒。
酵母菌杂交育种也存在一定局限性,主要是由于酵母菌的多倍体基因排列,使得自然界中能形成孢子的菌株出现几率很小,还有一些特殊的酵母菌属间杂交不会将结合子的理想特性传递给子代,另外,能够被交换或传递到子代、结合子上的理想性状特点也是有限的。
3.3 代谢工程育种
代谢工程是近年来发展迅速的新兴学科领域,能够突破物种间的障碍,最大限度地定向构造菌株。代谢工程通过对酿酒酵母细胞内乙酸代谢途径进行有目的地修饰和改造,从而改变细胞特性,并与细胞基因调控、代谢调控及生化工程技术相结合,构建低产乙酸的代谢途径。随着对控制乙酸产量主效基因的挖掘以及酿酒酵母乙酸代谢调控机制研究的深入,运用代谢工程手段定向构造低产乙酸酵母菌株已成为了研究热点(表1)。Shi Wenqi等[98]以酿酒酵母为研究对象,通过引入异源醇乙酰转移酶过表达ACS1和ALD6,并删除负责丙酮酸和乙酰辅酶A线粒体转运的基因(POR2、MPC2、PDA1),以此降低乙酸含量、提升乙酸乙酯的产量。Eglinton等[99]通过构造ALD6缺失型菌株,使得乙酸产量减少至原来的1/3,但也导致发酵速率减慢以及一些次级代谢产量降低。

表1 代谢工程对酿酒酵母乙酸产量和发酵特性的影响Table 1 Effect of metabolic engineering on acetic acid production and fermentation characteristics of S.cerevisiae
虽然通过敲除或过表达乙酸合成途径中的基因可以达到降低乙酸含量的目的,但是这种方式往往会影响菌株的正常生长及酿酒性能。针对这一问题,可以考虑采用逆向代谢工程进行低产乙酸酿酒酵母的选育,即首先确定乙酸产量的关键基因或特定的环境因子,然后通过遗传修饰或改变环境,使低产乙酸表型在特定生物中表达[103]。用此手段构造的菌株,仅携带与低产乙酸相关的有利突变,并且保留了野生型菌株的优良性状。
4 结语
酿酒酵母代谢是果酒酒精发酵过程中乙酸生成的主要原因,该过程受多个基因的调控。基于组学及BSAseq技术进一步确定酿酒酵母控制乙酸产量的主效基因,揭示酵母乙酸的代谢调控机制,对选育出优良的低产乙酸酵母菌株、实现果酒乙酸的精细化调控有重要意义。目前,针对发酵过程中乙酸含量的控制方法多集中于从自然环境中筛选低产乙酸的菌株或采用转基因及非转基因手段改造酿酒酵母。筛选、诱变和杂交都是采用非转基因手段从庞大的细胞池中筛选具有特定表型的酵母细胞,而细胞池中仅有少数表现出有益突变的细胞,通过多轮诱变、诱变后定向进化、杂交前菌株表型筛选可以帮助缩小范围同时靶向特定表型,但这些操作也可能造成其他表型丢失,导致突变株或杂交株表现弱于原始株。代谢工程可以通过敲除或过表达乙酸代谢途径中的关键基因达到降低乙酸产量的目的,但这种基于转基因方式制作的食品可能会使消费者难以接受。因此,未来仍需要探索更加合适的菌种选育方式,以获取更加适用于工业及商业需求的酵母菌株。

