微酸性电解水对采后西兰花叶绿素降解的影响
韩 颖,孙 莹,郭 峰,王馨渝,赵安琪,吴朝霞,李鹏霞,3,李国锋,3,胡花丽,3,*
(1.江苏省农业科学院农业设施与装备研究所,江苏 南京 210014;2.沈阳农业大学食品学院,辽宁 沈阳 110866;3.农业农村部农产品冷链物流技术重点实验室,江苏 南京 210014)
西兰花(Brassica oleraceaL.var.italica)又称青花菜、嫩芽花椰菜等,属十字花科,因富含硫代葡萄糖苷、萝卜硫素等活性物质而具有抗癌、防癌的功效[1]。但由于西兰花采收后呼吸代谢旺盛,贮运过程中极易出现组织萎蔫、花蕾黄化现象,严重影响其市场价值[2]。因此,研究有效的保鲜方法来延缓西兰花黄化衰老至关重要。
微酸性电解水(slightly acidic electrolyzed water,SAEW)是通过电解NaCl稀溶液或稀盐酸发生氧化还原反应生成的产物[3]。与常用的含氯消毒剂相比较,SAEW不仅可以高效杀菌,还能保持食品的物理品质、营养品质和感官特性,被广泛应用于果蔬、粮油和水产品等的杀菌保鲜中[4]。例如,Chen Guanwen等[5]证实SAEW能够通过降低李斯特菌胞内过氧化氢酶等酶的活力,打破细胞活性氧(reactive oxygen species,ROS)平衡来破坏其细胞脂质、蛋白质及核酸等物质,从而达到杀菌效果;Liu Lin等[6]阐明了随有效氯浓度(available chlorine concentration,ACC)的增加,SAEW产生的细胞内ROS含量明显升高,致使腐生希瓦氏菌和腐生葡萄球菌失活的杀菌机制。国内外学者不仅针对SAEW的杀菌机制进行了大量研究,还将其应用在果蔬保鲜中。唐志龙等[7]发现SAEW凝胶能抑制微生物的繁殖,延缓天麻切片品质劣变;周然等[8]采用SAEW结合壳聚糖处理水蜜桃来减缓酚类的积累,进而延缓果肉的变色;也有研究发现将SAEW结合真空预冷可有效延缓采后鸡毛菜黄化衰老进程,维持其营养品质[9];本课题组前期的研究结果也显示,SAEW不仅能抑制采后西兰花菌落总数的增加,且能有效抑制采后西兰花花蕾中叶绿素的降解,延缓西兰花花蕾的黄化进程[10]。
果蔬中黄化症状的发生与其组织内叶绿素降解有关。果蔬中的叶绿素以叶绿素a和叶绿素b的形式存在,叶绿素b转化为叶绿素a,叶绿素a受到叶绿素相关代谢酶和相关基因的调控,转化为非绿色荧光物质代谢物的形式,最终导致黄化[11]。据报道,叶绿素a在去镁离子去植基生成脱镁叶绿酸a的过程中有两条途径,作用于这两条途径的关键酶分别是叶绿素代谢酶、脱镁螯合酶(Mg-dechelatase,MDCase)和脱镁叶绿素酶(pheophytinase,PPH),生成的脱镁叶绿酸a在脱镁叶绿素a加氧酶(pheophorbide a oxygenase,PAO)作用下生成初代荧光叶绿素代谢产物[12]。近年来,大量研究证实了通过调控叶绿素代谢相关酶及其基因从而影响果蔬色泽的可行性。如李雪瑞等[13]采用1-甲基环丙烯结合低温抑制叶菜中叶绿素代谢酶和PPH的活性,缓解组织中叶绿素的降解,延缓其黄化;曹婷婷等[14]通过蓝光协同乙烯处理,对蜜橘果皮叶绿素代谢相关基因进行调控,促进果实中叶绿素衍生物的降解,从而加速果实转色;任亚梅[15]通过多种方法处理猕猴桃,所得结果都证实了叶绿素相关代谢酶影响着其叶绿素衍生物的含量。然而截至目前,尚鲜见SAEW调控西兰花叶绿素代谢的报道。
基于此,本研究以西兰花为材料,详细分析了SAEW对采后西兰花叶绿素降解的影响,以期为SAEW处理调控采后果蔬的黄化机制提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
西兰花购自江苏省南京市众彩批发市场。采购后1 h内送回江苏省农业科学院装备所处理室。挑选体积、成熟度基本一致,颜色翠绿的西兰花作为实验材料。
叶绿素a、叶绿素b 美国Sigma公司;甲醇、乙酸乙酯(均为色谱纯) 美国Avantor Performance Materials公司;丙酮、盐酸、硫酸 上海凌峰化学试剂有限公司;无水乙醚 南京化学试剂股份有限公司;石油醚 成都市科龙化工试剂厂;氯化钾、无水硫酸钠、磷酸二氢钾、正己烷 国药集团化学试剂有限公司;Tris、Triton X-100 北京索莱宝科技有限公司;PAO酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 江苏晶美生物科技有限公司;Plant Total RNA Isolation Kit Plus 成都福际生物技术有限公司;First Strand cDNA Synthesis Kit 美国Thermo Scientific Revert Aid公司;ChamQ SYBR qPCR Master Mix(Vazyme,编号Q311-02)试剂盒 南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
PL202-L电子天平、Seven Multi pH计 梅特勒-托利多国际贸易(上海)有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪美国Agilent公司;3K15高速冷冻离心机 德国Sigma公司;UV-1102型紫外-可见分光光度计 上海天美科学仪器有限公司;A11 Basic型液氮研磨器 艾卡(广州)仪器设备有限公司;KY-II型水浴式氮吹仪 安简(北京)科技有限公司;CR-400全自动测色色差仪 日本Konica Minolta公司;Epoch酶标仪 美国Bio-Tek公司;Zqty-70振荡培养箱 上海知楚仪器有限公司;CFX connect型荧光定量聚合酶链式反应(real-time quantitative PCR,qPCR)仪 美国Bio-Rad公司;“赐绿得”微酸性次氯酸水生成器 南京氯盾科技有限公司。
1.3 方法
1.3.1 SAEW的制备
以氯化钠溶液作为辅液,自来水为原水,用微酸性次氯酸水生成器电解生成SAEW。采用Seven Multi pH计对SAEW的pH值进行测定,碘量法测定其ACC。经测定,所制备SAEW的pH值为6.5,ACC为85 mg/L。以ACC为85 mg/L的SAEW为母液,后续实验所需不同质量浓度SAEW用自来水进行稀释。
1.3.2 采后西兰花处理
通过前期的浓度筛选实验发现[10],SAEW对采后西兰花叶绿素降解、丙二醛积累及组织黄化的影响呈现浓度依赖效应,其中50 mg/L SAEW处理的效果最好。因此本次实验中选择50 mg/L SAEW。将挑选的西兰花随机分成两组,每组含约300 个花球,分别浸泡于自来水(CK)和50 mg/L SAEW中15 min,取出沥干后装入4.5 L带孔乐扣盒中(共27 盒),然后置于(15±1)℃贮藏4 d,期间每天取样1 次,每组随机取3 盒,每盒20~25 个小花球(直径约5.8 cm)。取花球周边部位及中心部位的花蕾为材料,置于液氮中速冻并存放在-80 ℃冰箱中保存,用于测定相关指标。测定指标时用液氮研磨器粉碎混匀,以保证取样具有代表性。
1.3.3 色差测定
参考纪淑娟等[16]的方法,利用CR-400全自动测色色差计(直径1.1 cm)测定花球的色度,花球的大小和凸面基本可完全覆盖色差计的镜头。分别在L*(亮度)、a*(红绿度)、b*(黄蓝度)和h°(色相角)模式下平行测定15 次。
1.3.4 总叶绿素含量的测定
参考Hu Huali等[17]的方法并稍作修改。取0.5 g经液氮研磨器研磨后的西兰花粉末,加入5 mL 体积分数80%丙酮溶液,避光常温浸提6 h,过滤后取上清液,以体积分数80%丙酮溶液为空白校零,分别测定在642 nm和665 nm波长处提取液的吸光度,重复测定3 次,按式(1)~(3)分别计算总叶绿素、叶绿素a和叶绿素b含量。
式中:C表示总叶绿素含量/(μg/g);Ca表示叶绿素a含量/(μg/g);Cb表示叶绿素b含量/(μg/g);V表示提取液总体积/mL;m表示样品质量/g;1 000为转换系数。
1.3.5 叶绿素衍生物含量的分析
叶绿素a、b标准品分别用-20 ℃预冷丙酮溶解。
脱镁叶绿素的制备参照Gloria等[18]的方法。取3 mL叶绿素丙酮溶液(500 μg/mL),慢慢滴加30 μL盐酸(1 mol/L),边加边振荡。2 min后加入乙醚萃取,同时添加纯净水去除多余的酸(洗涤2~3 次)。氮吹仪吹干后溶于2 mL经-20 ℃预冷的丙酮。
脱植基叶绿素的制备参考Chen Kewei等[19]的方法:称取橙皮样品10 g,充分研磨后用冷丙酮浸提脱色3 次,离心(10 000×g、4 ℃、20 min),残渣在10 mL 5 mmol/L磷酸盐缓冲液(含0.24% Triton X-100和50 mmol/L KCl,pH 7.0)中4 ℃下浸提2 h,离心(10 000×g、4 ℃、10 min),上清液加无水硫酸铵析出蛋白后离心10 min(10 000×g、4 ℃),蛋白溶于3 mL磷酸盐缓冲液(100 mmol/L、pH 7.0)中。加入1 mL叶绿素丙酮溶液(150 μg/mL),再加入5 mL Tirs-HCl缓冲液(100 mmol/L、pH 8.0),37 ℃下于恒温振荡培养箱反应1 h。乙醚萃取,氮吹仪吹干后溶于2 mL经-20 ℃预冷的丙酮。
脱镁叶绿酸的制备采用Sievers等[20]的方法:取500 μL脱植基叶绿素加入浓盐酸30 μL,边加边振荡。2 min后加入乙醚萃取,同时添加纯净水去除多余的酸(洗涤2~3 次)。氮吹仪吹干后溶于2 mL经-20 ℃预冷的丙酮。
样品处理参考Roca等[21]的方法并略作修改。取0.5 g经液氮研磨器研磨后的西兰花粉末,加入10 mL经-20 ℃预冷的丙酮超声浸提至组织无色,过滤。将上清液转移至分液漏斗,等体积加入NaCl溶液(质量分数10%),再加入2 倍总体积的乙醚萃取,静置分层后弃去下层,向上层的乙醚相加入15 mL超纯水重复2 次。乙醚相用无水硫酸钠干燥后氮气吹干,溶于2 mL经-20 ℃预冷的丙酮,过0.22 μm有机滤膜等待上样。
HPLC条件参考An Ronghui等[22]的方法。流动相A为色谱级甲醇-超纯水(3∶1,V/V),流动相B为色谱级乙酸乙酯;柱温:35 ℃;检测波长:430 nm;进样量:20 μL;洗脱程序:0~10 min,80%~60% A;10~34 min,60%~20% A;34~38 min,20%~80% A;38~43 min,80% A,流速为1.0 mL/min。
1.3.6 叶绿素降解相关酶活力的测定
1.3.6.1 叶绿素酶活力的测定
叶绿素酶(chlorophyll metabolizing enzyme,Chlase)液提取参照Funamoto等[23]的方法,取0.5 g经液氮研磨器研磨后的西兰花粉末,加入10 mL经-20 ℃预冷的丙酮浸提至组织变白。残渣于4 ℃避光放置12 h后,加入2.5 mL 5 mmol/L的磷酸盐缓冲液(含2.4 g/L Triton X-100和50 mmol/l KCl,pH 7.0),4 ℃浸提1 h后离心(10 000×g、4 ℃、15 min),上清液为酶提取液。
酶活力的测定参照Aiamla等[24]的方法,取0.1 mL叶绿素a丙酮溶液(0.1 μmol/mL),加入0.5 mL Tris-HCl缓冲液(100 mmol/L)和0.5 mL Chlase提取液。30 ℃水浴避光浸提1 h后,加入4 mL经-20 ℃预冷的丙酮结束反应,再加入4 mL正己烷,剧烈摇动,分层后取丙酮层离心(10 000×g、4 ℃、10 min),测定667 nm波长处吸光度,以每分钟OD667nm变化0.01表示1 个酶活力单位。
1.3.6.2 MDCase活力的测定
酶提取液制备方法同1.3.6.1节。
反应底物的制备参考Kaewsuksaeng等[25]的方法:取4.5 mL 8.0 μg/mL的叶绿素a溶液,加1.12 mL蒸馏水,加入丙酮使其终体积分数为80%,加入8.4 mL石油醚剧烈摇动。上层的醚相被分离,用4.2 mL蒸馏水洗涤3 次,然后加入50 μL甲醇(含30% KOH),此时脱镁叶绿酸a开始沉淀,将脱镁叶绿酸a沉淀物溶于10 mL蒸馏水得到脱镁叶绿酸a溶液,将其用1 mol/L Tris-HCl缓冲液调节pH值至9.0,即得到MDCase的底物溶液。
MDCase活力的测定参考Hornero等[26]的方法,取0.8 mL 50 mmol/L Tris-HCl溶液(含0.1% Triton X-100,pH 9.0)、100 μL叶绿酸a溶液和500 μL酶提取液,总体积为1.4 mL。将混合物于25 ℃培养30 min,在687 nm波长处测定吸光度,以每分钟OD687nm变化0.01表示1 个酶活力单位。
1.3.6.3 PPH活力的测定
参考Aiamla等[24]的方法测定PPH活力。
底物的制备:取10 mL 89.29 μg/mL叶绿素a溶液加入一滴0.1 mol/L HCl,待反应2 min后加入0.5 mL 0.1 mol/L NaOH溶液,作为PPH的底物溶液。
取0.5 g经液氮研磨器研磨后的西兰花粉末,加入8 mL经-20 ℃预冷的丙酮浸提至组织变白。残渣于4 ℃避光放置12 h后,加入5 mL 50 mmol/L磷酸盐缓冲液(pH 8.0),4 ℃条件下提取1 h后离心(10 000×g、4 ℃、15 min),上清液即为酶提取液。
酶活力的测定:将0.5 mL 50 mmol/L Tris-HCl溶液(pH 8.0)、150 μL脱镁叶绿素a丙酮溶液和500 μL酶提取液混合。混合物在25 ℃反应40 min,加入2 mL经-20 ℃预冷的丙酮终止反应。在667 nm波长处测定吸光度,以每分钟OD667nm变化0.01表示1 个酶活力单位。
1.3.6.4 PAO活力的测定
按照植物PAO ELISA试剂盒说明书进行PAO活力测定。
1.3.7 RNA的提取和cDNA的合成
RNA的提取和cDNA的合成参照刘红艳等[27]的方法,略作修改。西兰花组织总RNA的提取按照Plant Total RNA Isolation Kit Plus说明书完成。西兰花cDNA的合成按照First Strand cDNA Synthesis Kit说明书操作。总体系20.00 μL,总RNA 500.00 ng,GoldenstarTMRandomer 1.00 μL,5×GoldenstarTMBuffer 4.00 μL,dNTP Mix 1.00 μL,DTT 1.00 μL,GoldenstarTMRT6 1.00 μL,用RNase-free water补足至20.00 μL。之后于25 ℃反应10 min,55 ℃反应15 min,85 ℃反应5 min。产物置于-80 ℃冰箱备用。
1.3.8 实时荧光qPCR分析
以Actin为内参基因,测定叶绿素b还原酶(chlorophyll b reductase,BoNYC1/BoNOL)、叶绿素酶1(chlorophyllase 1,BoCLH1)、叶绿素酶2(chlorophyllase 2,BoCLH2)、滞绿蛋白(chlorosis protein,BoSGR)、脱镁叶绿素酶(pheophytinase,BoPPH)、脱镁叶绿酸a氧化酶(pheophorbide a oxygenase,BoPAO)、红色叶绿素降解产物还原酶(red chlorophyll catabolite reductase,BoRCCR)和衰老特异性半胱氨酸蛋白酶(aging specific cysteine protease,BoSAG12)编码基因的表达量。
qPCR根据ChamQ SYBR qPCR Master Mix试剂盒说明书完成。总反应体系20.00 μL,包括2×SYBR Premix ExTaqTMII(Tli RNaseH Plus)10.00 μL,PCR Forward Primer 0.60 μL,PCR Reverse Primer 0.60 μL,DNA模板1.00 μL,ddH2O(灭菌蒸馏水)7.80 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40 个循环。详细引物序列见表1,每个样品设3 次重复。
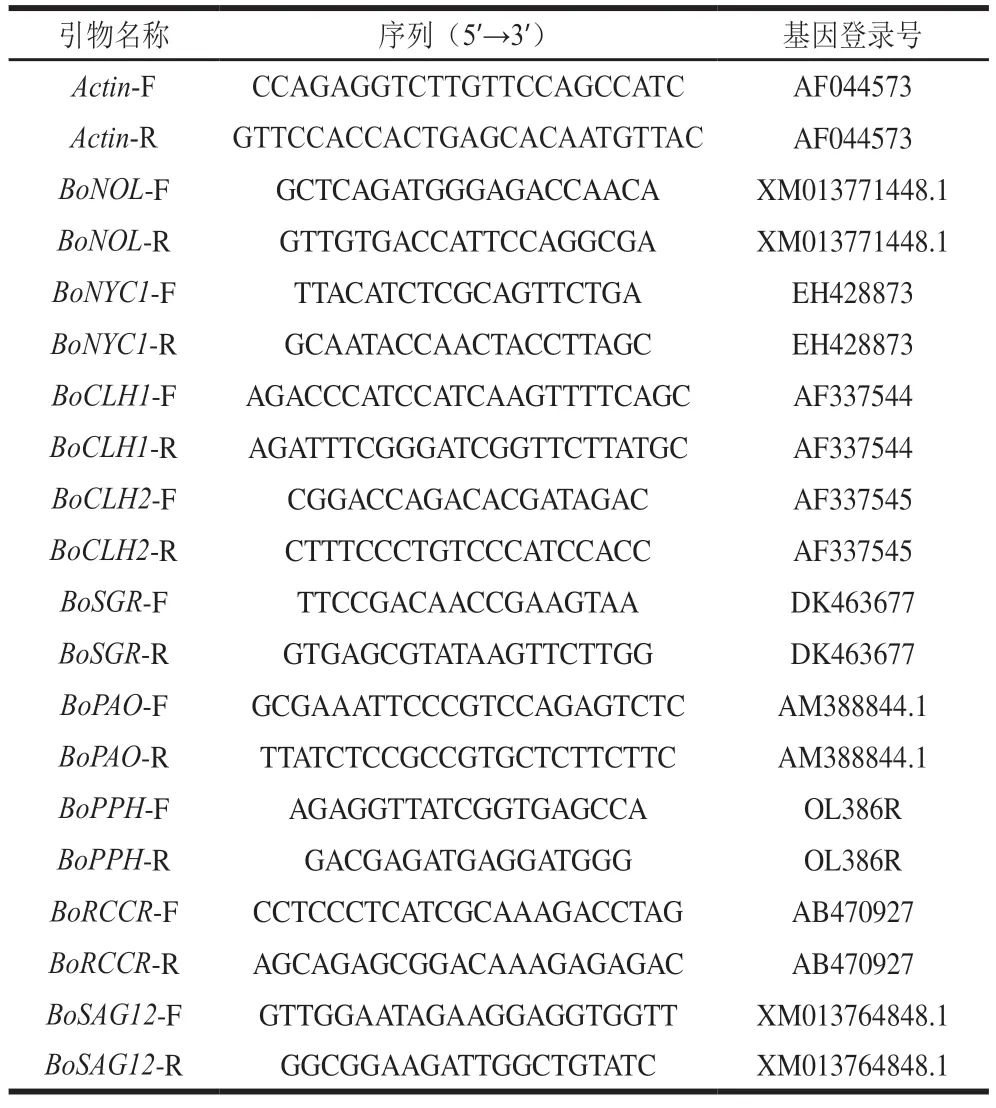
表1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.4 数据处理与分析
所有数据为3 次生物学重复,数据采用平均值±标准误差表示。两个处理之间的差异显著性分析采用SPSS 26软件进行t检验,以P<0.05表示差异显著,采用Duncan法进行多重比较,用Origin 2021软件作图。
2 结果与分析
2.1 SAEW对采后西兰花外观品质的影响
由图1可知,采后西兰花随贮藏时间的延长而逐渐黄化。在贮藏第3天时,CK组西兰花出现轻微黄化,在贮藏第4天时黄化严重。相比之下,经SAEW处理的西兰花在贮藏第3天时仍有较好的外观品质,贮藏至第4天时才出现轻微的黄化现象。可见,SAEW处理可显著延缓采后西兰花的黄化进程,延长货架期。

图1 SAEW对采后西兰花外观品质的影响Fig.1 Effect of SAEW on the appearance quality of postharvest broccoli
2.2 SAEW对采后西兰花色差的影响
色泽是果蔬质量重要的衡量指标。L*值代表西兰花花蕾的亮度,在整个贮藏阶段,SAEW对西兰花的亮度影响较大,显著低于CK组(第1、3、4天)(图2A)。a*值代表西兰花花蕾的红绿度,随着褪绿性的增加而升高,在贮藏后期(3~4 d)CK组西兰花花蕾绿色衰减加剧,a*值显著高于SAEW处理组(图2B)。b*值代表西兰花花蕾的黄蓝度,随西兰花花蕾黄化程度加剧而升高,从图2C可以看出,在贮藏初期CK组西兰花花蕾b*值从14.57升高至33.57,而SAEW处理组第4天的b*值为24.75,极显著低于CK组。h°值表示颜色饱和度,h°值越小说明西兰花花蕾黄化越明显,在贮藏后期(3~4 d),CK组西兰花花蕾的h°值极显著低于SAEW处理组(图2D)。综上,在整个在贮藏过程中,SAEW处理显著抑制了西兰花花蕾L*、a*、b*值的上升及h°值的下降,有效维持了西兰花的色泽。
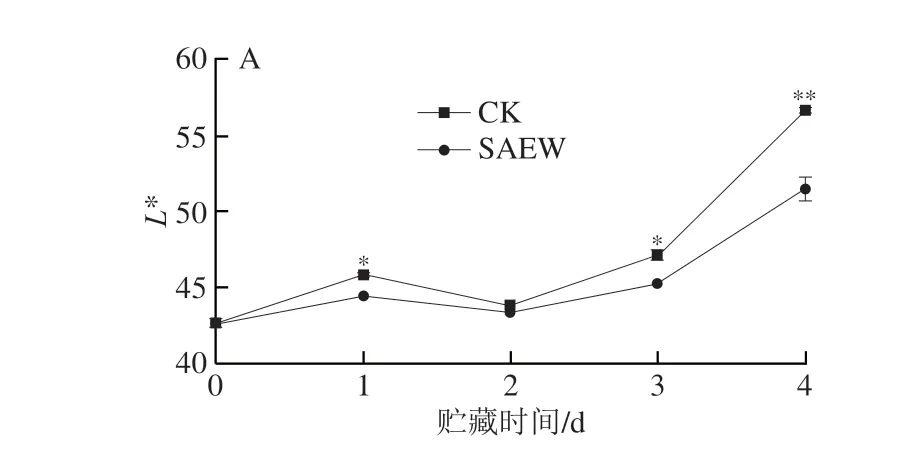

图2 SAEW处理对采后西兰花色差L*(A)、a*(B)、b*(C)和h°(D)值的影响Fig.2 Effect of SAEW treatment on the L* (A),a* (B), b* (C)和h° (D)values of postharvest broccoli
2.3 SAEW对采后西兰花叶绿素a、叶绿素b和总叶绿素含量的影响
通过分光光度法分析采后贮藏期间西兰花叶绿素含量的变化情况,由图3可以看出,在整个贮藏期间,西兰花组织中的叶绿素a(图3A)、叶绿素b(图3B)和总叶绿素(图3C)含量均呈现逐渐减少的特点;而SAEW处理可有效减缓采后西兰花中叶绿素含量的下降。在贮藏第1~4天,SAEW处理组西兰花的总叶绿素含量分别为434.39、404.39、394.15 μg/g和232.42 μg/g,分别是CK组的1.12、1.10、1.61 倍和1.40 倍。可见,SAEW处理能显著抑制采后西兰花在贮藏期间叶绿素的降解。
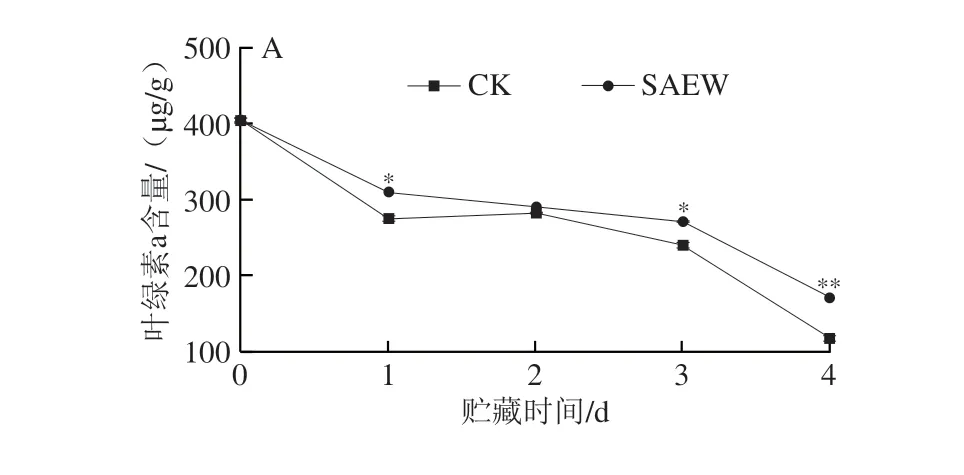
图3 SAEW处理对采后西兰花叶绿素a(A)、叶绿素b(B)和总叶绿素(C)含量的影响Fig.3 Effect of SAEW treatment on the chlorophyll a (A),b (B) and total chlorophyll (C) contents in postharvest broccoli
2.4 SAEW对采后西兰花叶绿素降解代谢产物的影响
采用HPLC法评估了叶绿素及其代谢产物的变化情况。
2.4.1 SAEW对采后西兰花叶绿素a和叶绿素b含量的影响
由图4可看出,在整个贮藏期,西兰花组织中的叶绿素a(图4A)和叶绿素b(图4B)含量均呈下降趋势,与分光光度法分析结果一致。在贮藏第1、3、4天,SAEW处理组西兰花叶绿素a含量分别为342.63、263.76 μg/g和165.24 μg/g,分别是CK组的1.08、1.40 倍和1.72 倍;在贮藏第3、4天,SAEW处理组采后西兰花叶绿素b含量分别为41.56 μg/g和20.24 μg/g,分别是CK组的1.67 倍和2.59 倍,极显著高于CK组。可见,SAEW处理可以有效减缓采后西兰花在贮藏期间叶绿素a和叶绿素b的降解,这与色差及总叶绿素含量的分析结果一致。
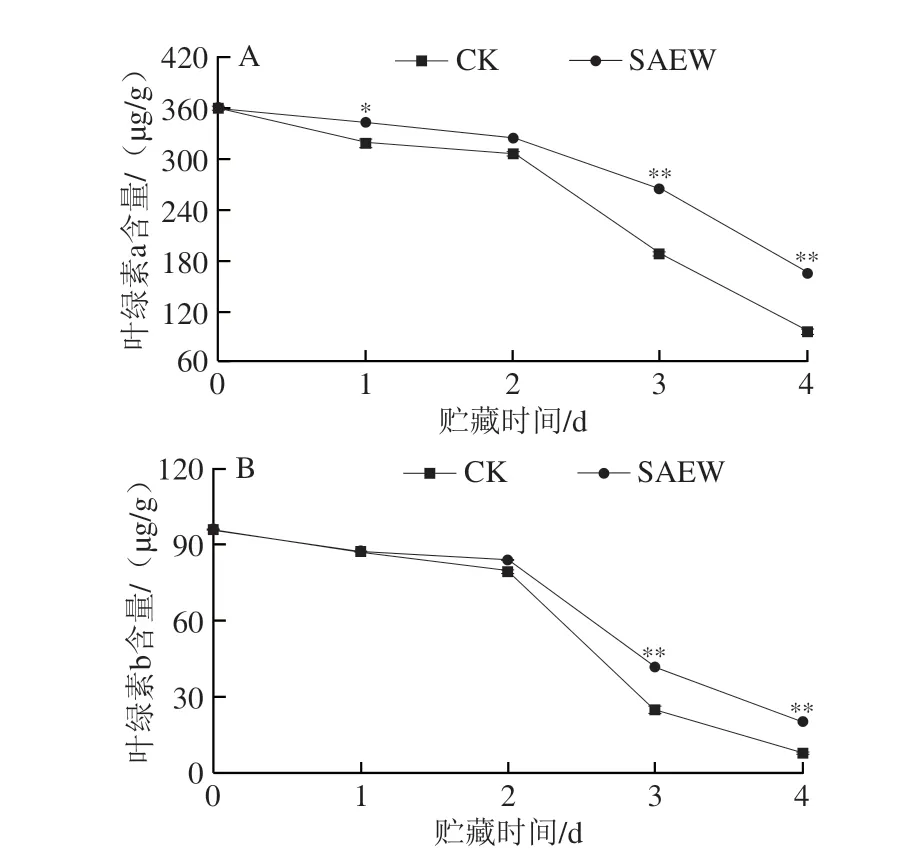
图4 SAEW处理对采后西兰花叶绿素a(A)和叶绿素b(B)含量的影响Fig.4 Effect of SAEW treatment on the chlorophyll a (A) and chlorophyll b (B) contents in postharvest broccoli
2.4.2 SAEW对采后西兰花脱植基叶绿素a和脱植基叶绿素b含量的影响
在整个贮藏期,西兰花组织中脱植基叶绿素a和脱植基叶绿素b含量总体呈下降趋势,在经SAEW处理的采后西兰花中呈下降-上升-下降的波动趋势,但大部分时间均高于CK组(图5)。在贮藏第2、3、4天,SAEW处理组西兰花脱植基叶绿素a含量分别为246.98、162.72、83.31 μg/g,分别比CK组高33.1%、43.7%和37.6%;且SAEW处理组西兰花脱植基叶绿素b含量在贮藏第3、4天有所上升,分别为110.40 μg/g和106.40 μg/g,其分别较CK组高34.0%和26.5%。可见,SAEW处理可有效延缓采后西兰花中脱植基叶绿素a和脱植基叶绿素b的降解。
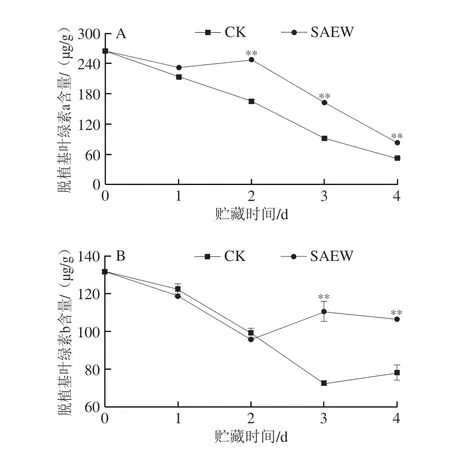
图5 SAEW处理对采后西兰花脱植基叶绿素a(A)和脱植基叶绿素b(B)含量的影响Fig.5 Effect of SAEW treatment on the chlorophyllide a (A) and chlorophyllide b (B) contents in postharvest broccoli
2.4.3 SAEW对采后西兰花脱镁叶绿酸a和脱镁叶绿素a含量的影响
如图6A所示,在整个贮藏期间采后西兰花组织中脱镁叶绿酸a含量呈下降趋势。SAEW处理组西兰花脱镁叶绿酸a含量在贮藏第3、4天分别为0.83 mg/g和0.26 mg/g,分别是CK组的1.61 倍和2.99 倍,极显著高于CK组。如图6B所示,在贮藏第1~4天,采后西兰花组织中脱镁叶绿素a含量整体呈下降趋势,而SAEW处理有效延缓了西兰花中脱镁叶绿素a的降解速率。尤其在贮藏第3、4天,SAEW处理组西兰花组织中脱镁叶绿素a含量分别为104.20 μg/g和101.87 μg/g,分别是CK组的1.53 倍和1.41 倍。可见,SAEW处理在贮藏后期(3~4 d)可大幅延缓采后西兰花组织中脱镁叶绿酸a和脱镁叶绿素a的降解。
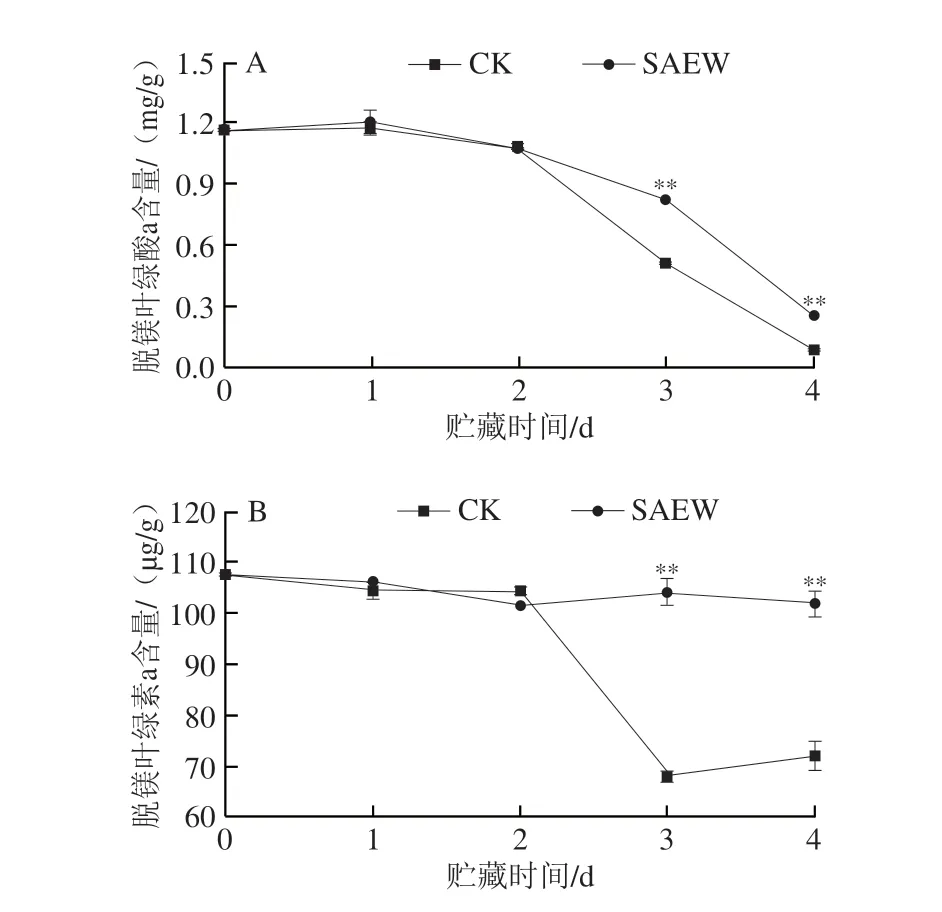
图6 SAEW处理对采后西兰花脱镁叶绿酸a(A)和脱镁叶绿素a(B)含量的影响Fig.6 Effect of SAEW treatment on the pheophorbide a (A) and pheophytin a (B) contents in postharvest broccoli
2.5 SAEW对采后西兰花叶绿素降解酶活力的影响
采后西兰花中相关叶绿素降解酶活力影响着其叶绿素的降解速度。如图7A所示,两组西兰花在贮藏前期(1~2 d)组织中Chlase活力无明显差异。在贮藏第3天时,CK组与SAEW处理组西兰花组织中Chlase活力达到峰值,分别为2.98 U/g和2.38 U/g,CK组极显著高于SAEW处理组;在贮藏第4天时,虽两组Chlase活力都有所下降,但SAEW处理组出现大幅下降,较CK组(2.77 U/g)低60.6%。可见,SAEW处理能较好地抑制西兰花在贮藏期间Chlase活力的升高。
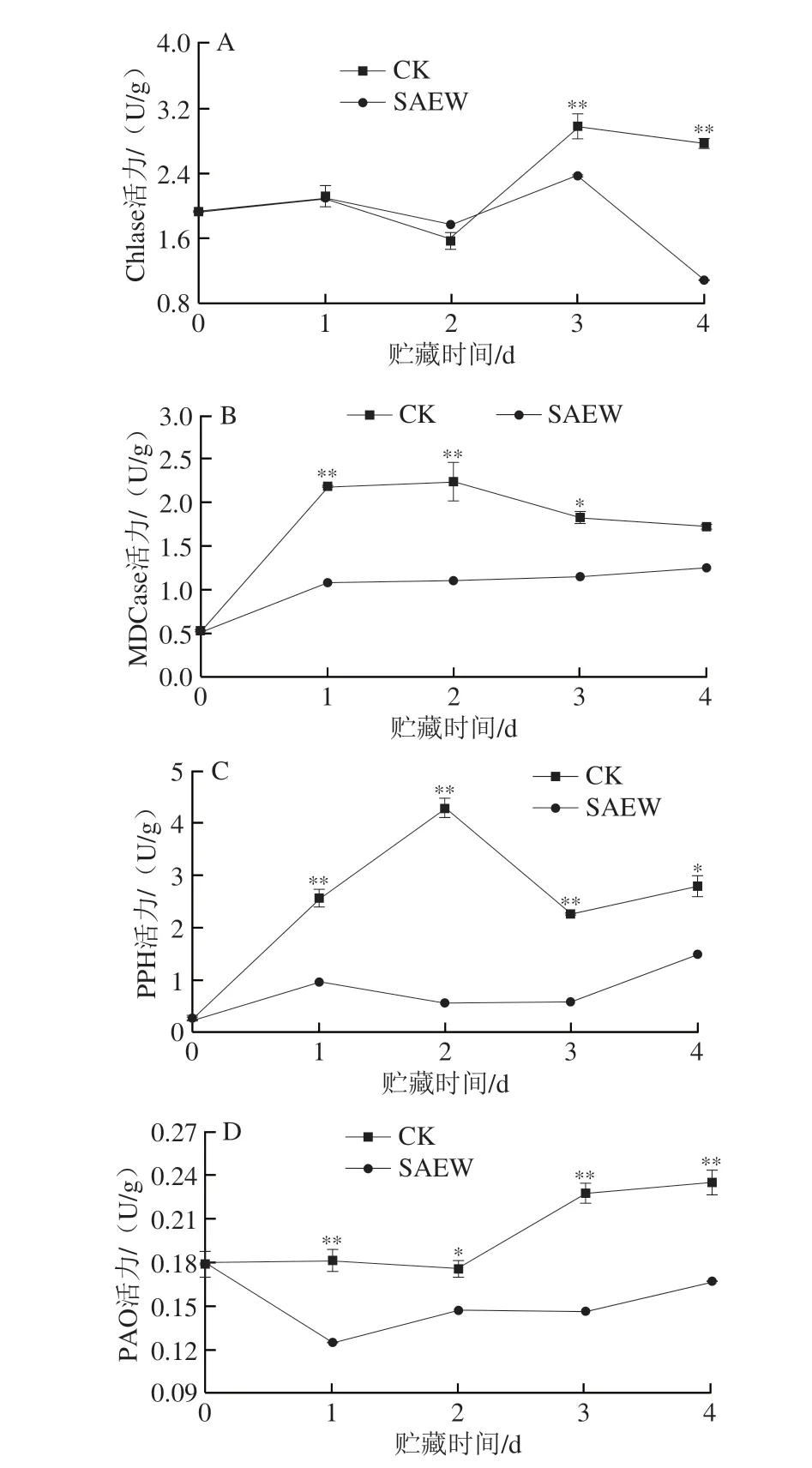
图7 SAEW处理对采后西兰花Chlase(A)、MDCase(B)、PPH(C)和PAO(D)活力的影响Fig.7 Effect of SAEW on the activities of Chlase (A),MDCase (B),PPH (C) and PAO (D) in postharvest broccoli
随着贮藏时间的延长,CK组采后西兰花组织中MDCase活力呈先上升后下降的变化趋势,虽然经SAEW处理的采后西兰花组织中MDCase活力呈缓慢上升趋势,但显著低于CK组(图7B)。在贮藏期第1~4天,SAEW处理组西兰花中MDCase活力分别为1.09、1.09、1.15 U/g和1.25 U/g,分别较CK组低50.2%、51.3%、36.8%和27.3%,且在贮藏第1~3天时SAEW处理组西兰花中MDCase活力极显著低于CK组。可见,SAEW处理能较好地抑制西兰花在贮藏期间MDCase活力的升高。
如图7C所示,两组西兰花组织中PPH活力均呈上升-下降-上升的变化趋势。与CK组相比,SAEW处理明显抑制了西兰花中PPH活力的上升。在贮藏期第1~4天,SAEW处理组西兰花的PPH活力分别为0.98、0.56、0.59 U/g和1.50 U/g,分别比同期CK组低61.9%、86.9%、74.0%和46.4%(P<0.01)。综上,SAEW处理对抑制西兰花贮藏期间PPH活力的升高有显著效果。
如图7D所示,CK组西兰花中PAO活力显著高于SAEW处理组。在贮藏1、2、3 d和4 d时,SAEW处理组西兰花中PAO活力分别为0.13、0.15、0.15 U/g和0.17 U/g,分别比同期CK组低27.8%、16.7%、34.8%和29.2%,且在贮藏第1、3、4天时有极显著差异。可见,SAEW处理能较好地抑制西兰花在贮藏期间PAO活力的升高。
2.6 SAEW对采后西兰花叶绿素代谢相关基因表达的影响
BoNYC1和BoNOL在叶片衰老过程中对调控叶绿素b降解和捕光复合体II降解发挥重要作用。由图8A、B可知,SAEW处理抑制了西兰花中BoNYC1和BoNOL的表达,使其在贮藏第3、4天时与CK组出现极显著差异;且在第3天时达到峰值,SAEW处理组西兰花BoNYC1和BoNOL的表达量极显著低于CK组。说明SAEW处理可显著抑制采后西兰花中BoNYC1和BoNOL的表达。
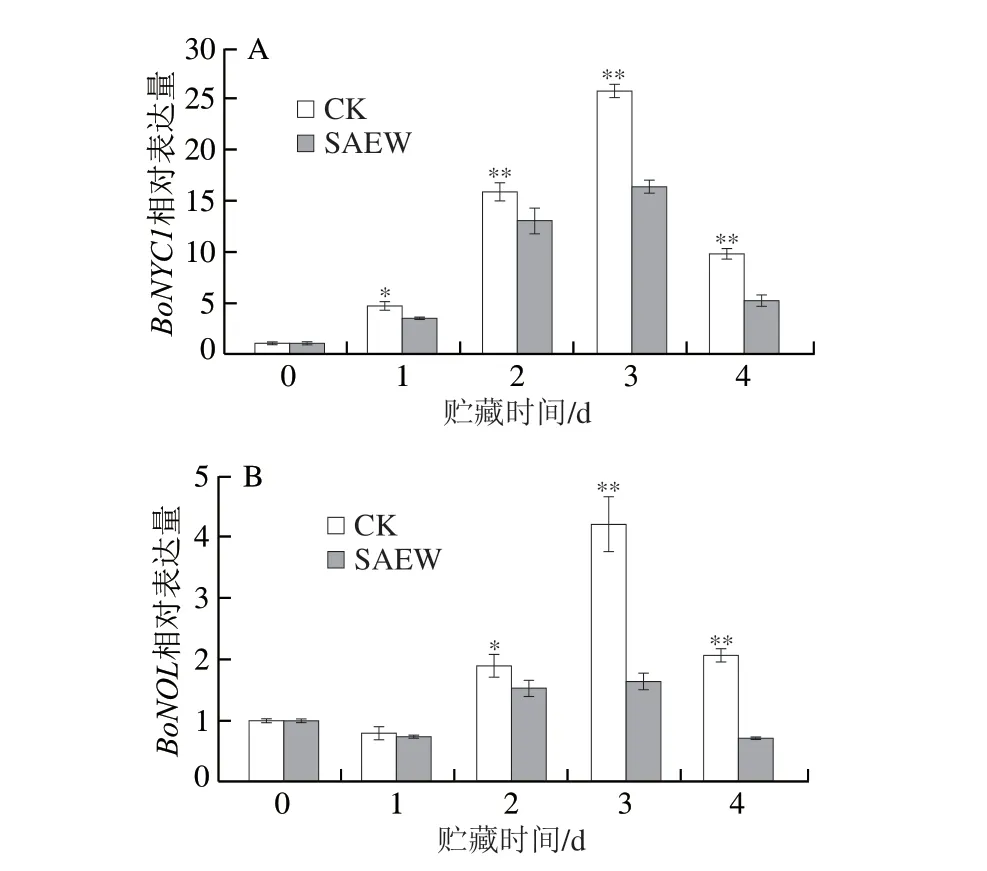
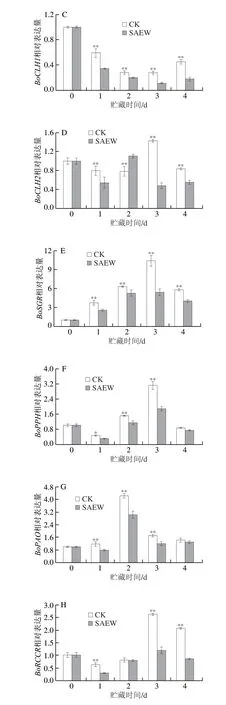
图8 SAEW处理对采后西兰花叶绿素代谢相关基因表达的影响Fig.8 Effect of SAEW on the expression of chlorophyll metabolismrelated genes in postharvest broccoli
BoCLH1和BoCLH2可催化叶绿素生成脱植基叶绿素和植醇。在整个贮藏期间,两组西兰花中BoCLH1的表达量均呈先下降后上升的趋势,且CK组显著高于SAEW处理组(图8C)。CK组与SAEW处理组西兰花中BoCLH2的表达呈上升-下降-上升的趋势(图8D)。在贮藏第3、4天时,SAEW处理极显著地抑制了西兰花中BoCLH1和BoCLH2的表达。
在整个贮藏期间,两组西兰花中BoSGR的表达量均呈先上升后下降的趋势,在贮藏第3天达到峰值(图8E)。在贮藏第1~4天时,CK组西兰花中BoSGR基因表达量分别是SAEW处理组西兰花的1.45、1.20、1.91 倍和1.89 倍。可见,SAEW处理可极显著抑制西兰花中BoSGR的表达。
BoPPH在西兰花衰老过程中参与叶绿素降解。如图8F所示,西兰花在贮藏过程中BoPPH表达量呈下降-上升-下降的趋势,在贮藏第1~3天时,SAEW处理组西兰花中BoPPH表达量分别较CK组低35.5%、24.8%和39.7%(P<0.05,P<0.01)。可见,SAEW处理极显著地抑制了西兰花中BoPPH的表达。
BoPAO与西兰花衰老密切相关。在整个贮藏期内,两组西兰花中BoPAO的表达量呈先上升后下降的趋势(图8G),在贮藏第1~3天时,CK组西兰花中BoPAO基因表达量分别是SAEW处理组的1.51、1.40 倍和1.41 倍。可见,SAEW处理极显著地抑制了西兰花中BoPAO的表达。
BoRCCR在叶绿素降解与植物绿色细胞死亡过程中起关键性的作用。西兰花中BoRCCR表达量在贮藏过程中呈下降-上升-下降的趋势,在贮藏第3天达到峰值(图8H)。SAEW处理组西兰花中BoRCCR表达量不仅峰值极显著低于CK组,在贮藏第1、4天时也极显著低于CK组。可见,SAEW处理组可极显著地抑制西兰花中BoRCCR的表达。
BoSAG12是西兰花中具有代表性的衰老基因。西兰花贮藏过程中BoSAG12的表达量急剧上升,而SAEW处理显著抑制了其升高速率(图8I)。在贮藏后期(第3、4天),SAEW处理组西兰花中BoSAG12表达量较CK组分别低47.1%和59.0%(P<0.01)。综上,SAEW处理可以显著抑制衰老基因BoSAG12的表达。
2.7 相关性分析
由图9可看出,叶绿素含量与色差a*、h°值及叶绿素衍生物含量呈显著正相关;与色差L*、b*值、叶绿素相关代谢酶Chlase、MDCase、PPH、PAO活力及叶绿素代谢相关基因BoNYC1、BoNOL、BoPAO、BoRCCR和衰老基因BoSAG12表达量呈负相关。综上,SAEW处理可减缓叶绿素及其衍生物的降解,抑制叶绿素相关代谢酶活力,抑制叶绿素代谢相关基因及其衰老基因的表达,使采后西兰花维持较好的色泽,推迟其黄化衰老进程,达到延长货架期的目的。
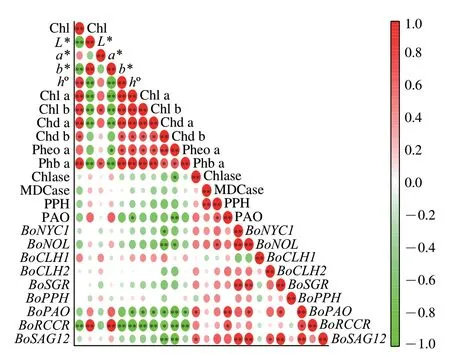
图9 采后西兰花色泽与叶绿素代谢指标的相关性分析Fig.9 Correlation analysis between color and chlorophyll metabolism indexes of postharvest broccoli
3 讨论
采后西兰花在贮藏期间花蕾极易黄化,叶绿素降解是引起黄化的直接原因。因此,如何通过有效维持西兰花中叶绿素含量来延缓黄化是其采后保鲜的关键。
绿色蔬菜的黄化程度是衡量其商品价值的重要标志。由外观品质(图1)、色差(图2)和总叶绿素含量(图3)分析结果可知,随着贮藏时间的延长,两组采后西兰花花蕾的亮度和褪绿程度升高,颜色饱和度降低,但与CK组相比,SAEW处理可显著抑制显著西兰花花蕾L*、a*、b*值的上升及h°值的下降,并且有效延缓叶绿素降解,从而延缓其黄化衰老进程。近年来的研究也证实了抑制西兰花叶绿素的降解可达到延缓黄化的效果。例如,Techavuthiporn等[28]的实验结果表明缺氧处理可通过延缓叶绿素在贮藏期间的降解来维持西兰花的色泽;刁春英等[29]研究发现真空减压技术可有效延缓西兰花中叶绿素的降解,从而达到护色保鲜的效果;且本课题组前期探索SAEW对采后西兰花贮藏品质的影响时发现,SAEW可有效抑制采后西兰花组织中VC、可溶性糖、可滴定酸和可溶性蛋白含量的降低,并且有助于延缓其叶绿素的降解[10]。本研究结果与上述研究结果一致,说明SAEW处理可显著延缓采后西兰花中总叶绿素的降解,从而有效延缓其黄化衰老进程。
叶绿素代谢包括叶绿素合成和叶绿素分解两方面。叶绿素合成与植物叶色变化和光合特性密切相关,其合成途径包括15 步酶促反应,其中涉及的酶由27 个相关基因编码[30],叶绿素合成需要光的参与。在本研究中,处理后的西兰花在黑暗条件下进行贮藏,因此在采后西兰花的叶绿素代谢中以分解代谢为主。基于SAEW对采后西兰花叶绿素降解的有效抑制作用,随后的实验进一步分析了SAEW对采后西兰花叶绿素降解代谢的影响。叶绿素的降解代谢可分解为两个阶段,第一个阶段在叶绿体中完成,首先是叶绿素被Chlase催化形成脱植基叶绿素,然后由一个金属螯合物脱去镁离子形成脱镁叶绿酸a,脱镁叶绿酸a经过由PAO和红色叶绿素代谢产物还原酶催化的两步反应转化成初生荧光叶绿素代谢产物,初生荧光叶绿素代谢产物经过几次修饰之后运输至液泡中。第二个阶段是经修饰的初生荧光叶绿素代谢产物被液泡中酸性的pH值环境所诱导而发生非酶学的异构化,形成非荧光叶绿素代谢产物,最后转化形成单吡咯降解产物[31]。可见,叶绿素代谢的降解阶段是由多种代谢酶共同作用的过程,在此过程中产生的衍生物前期为绿色,后期转化为无色物质,说明前期衍生物的含量影响着果蔬的褪绿程度,参与这一过程的主要代谢酶有Chlase、MDCase、PPH和PAO,其中PPH是叶绿素代谢的关键酶,PAO是褪绿过程中的关键酶[32]。该机制在大量的果蔬研究中已得到证明,例如,安容慧[33]采用富氢水结合真空预冷处理上海青、朱玲玲[34]通过褪黑素处理西兰花,皆发现在叶绿素代谢过程中有效抑制了叶绿素代谢酶活性,延缓了叶绿素衍生物的降解。类似的研究也证实通过抑制叶绿素代谢酶活力可有效延缓叶绿素的降解[35]。同样,在本研究中,SAEW处理有效抑制了采后西兰花中Chlase、MDCase、PPH和PAO的活性,延缓了叶绿素衍生物脱植基叶绿素a、脱植基叶绿素b、脱镁叶绿素a和脱镁叶绿酸a含量的下降。
近年来,许多研究也分析了影响叶绿素降解的相关代谢途径。比如,才佳卉[36]发现乙烯代谢对叶绿素降解相关酶活性及基因表达具有显著影响;刘红艳等[37]采用6-苄氨基嘌呤处理鲜切西兰花,结果显示6-苄氨基嘌呤有效抑制了采后西兰花中叶绿素的降解;Hu Huali等[17]采用褪黑素处理青花菜,发现褪黑素不仅调控了青花菜的呼吸代谢,而且下调了叶绿素降解相关基因的表达,从而有效延缓了组织的黄化衰老进程。Aghdam等[38]研究发现,八肽NOP-1通过下调BoPAO和BoPPH基因的表达延缓了组织的黄化。这些研究表明,相关前体物质和激素类物质的代谢可影响组织中叶绿素的降解过程。在小白菜[22]中的研究也表明,二氢槲皮素处理显著下调了叶绿素代谢酶及其相关基因和衰老基因的表达,延缓了组织的黄化衰老。本研究分析了西兰花中叶绿素代谢相关基因BoNYC1、BoNOL、BoCLH1、BoCLH2、BoSGR、BoPPH、BoPAO、BoRCCR和衰老基因BoSAG12的表达情况,结果表明,除贮藏第2天的BoCLH2基因外,在整个贮藏期间,SAEW处理组各基因的表达水平均显著低于CK组。可见,SAEW处理组西兰花中较高的叶绿素及其衍生物含量可能与其BoNYC1、BoNOL、BoCLH1、BoCLH2、BoSGR、BoPPH、BoPAO和BoRCCR和BoSAG12基因的表达下调有关。
综上,采后西兰花经50 mg/L SAEW处理可以显著延缓其黄化衰老进程。进一步研究显示,SAEW处理能显著抑制采后西兰花中叶绿素代谢酶Chlase、MDCase、PPH和PAO活性及其相关基因的表达量,延缓采后西兰花中叶绿素及其衍生物的降解,从而有效延缓黄化以达到延长货架期的目的。

