超声波提取卵孢小奥德蘑多糖的工艺优化
林俊铭 谢 静 曾 荣 白永亮 郭艳峰
(1佛山科学技术学院食品科学与工程学院,广东佛山 528200;2中山火炬职业技术学院健康产业学院,广东中山 528436)
卵孢小奥德蘑Oudemansiella raphanipies,别名长根菇,属伞菌纲、小奥德蘑属,因菌菇上半部分为暗褐色,且形似鸡菌,故只有商品名黑皮鸡菌[1-2]之称。该菌在中国主要分布于四川、福建、云南等省[3-4],近几年人工栽培量逐渐上升。卵孢小奥德蘑肉质鲜嫩、口感爽脆、营养价值高[5],富含氨基酸及生物活性物质等,有调节人体机能、增强免疫等作用[6-7],具有较高营养、药用价值以及广阔的市场前景。
目前,食用菌多糖提取的方法有水提醇沉法[8]、超声波提取法[9]、微波提取法[10]、酶提取法[11]、酸碱提取法[12]、超临界萃取技术提取法[13]等,然而上述提取方法仍有一些不足,如:水提醇沉法耗时长,提取率低;微波提取法因为热应力导致多糖结构被破坏;酶提取法成本较高,多糖结构容易破坏;酸碱提取法中强酸强碱容易导致多糖结构破坏;超临界萃取技术对设备要求较高,工艺操作复杂。而超声波提取法主要是利用超声波的机械作用,破坏细胞壁、细胞膜等生物组织,并提高细胞内的传质效率,可促进多糖成分的释放。马晓宁等[14]通过单因素及响应面试验确定杏鲍菇多糖超声提取的最佳工艺条件,提取率达14.71%。周理红等[15]、吴昊等[16]通过超声波辅助提取法有效提高了绿菇、红菇多糖的提取率。焦迎春等[17]采用超声提取最佳工艺获得的柴达木大肥菇(柴达木双层环伞菌)多糖具有较强的抗缺氧化效果。王荣琨等[18]比较竹荪多糖提取方法,结果超声波提取法可提高多糖提取率,且提取的多糖抗氧化性最强。
基于超声波提取法操作简单、提取率高的特点,研究以卵孢小奥德蘑为原料,经真空冷冻干燥粉碎后,采用超声波提取法提取多糖。试验通过单因素、正交试验比较不同的超声条件(温度、时间、功率)以及料液比的多糖提取率,最终筛选出最适合卵孢小奥德蘑多糖提取的工艺及条件。研究可为卵孢小奥德蘑精深加工和功能产品的开发提供依据。
1 材料与方法
1.1 原材料及试剂
新鲜卵孢小奥德蘑来源于广东省肇庆市广宁县食用菌种植基地。
试验所用主要试剂:无水葡萄糖,天津市大茂化学试剂厂;苯酸,天津市大茂化学试剂厂;无水乙醇,天津市大茂化学试剂厂;硫酸,广东广试试剂科技有限公司。
1.2 仪器设备
试验所用主要仪器设备:BSA124S 电子分析天平,赛多利斯科学仪器(北京)有限公司;SB-5200DTD 超声波清洗机,宁波新芝生物科技股份有限公司;V6 旋涡混匀器,广东安胜仪器有限公司;DZKW 电热恒温水浴锅,北京市永光明医疗仪器有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;3-20R 台式高速冷冻离心机,上海托莫斯科学仪器有限公司;FD-1A-50真空冷冻干燥机,上海比朗仪器制造有限公司;WZJ6-A 振动式药物超微粉碎机,济南倍力粉技术工程有限公司。
1.3 试验方法
1.3.1 卵孢小奥德蘑多糖的提取及测定
1.3.1.1 卵孢小奥德蘑多糖提取
(1)预处理:挑选新鲜、无损伤腐烂的卵孢小奥德蘑,清洗干净后于通风室内晾干表面水分,备用。
(2)真空冷冻干燥及粉碎:取适量预处理后的卵孢小奥德蘑,于-20 ℃的冷藏室中预冻24 h;于冷冻温度为-42 ℃,真空度为7.9 Pa 的条件下,将预冻卵孢小奥德蘑放入料盘内冻干,待料盘内卵孢小奥德蘑温度与冷冻温度一致时停止冻干。冷冻后卵孢小奥德蘑用超微粉碎机粉碎,过100目筛,用干燥器密封保存备用。
(3)提取多糖:参考徐澜等[19]的方法稍做修改。称取适量粉碎后的卵孢小奥德蘑粉末于烧杯中,加入一定比例的去离子水,混合均匀,在超声清洗机的最佳条件下超声提取粗多糖。超声提取结束后于5 000 r/min 离心20 min,收集上清液,弃沉淀。将收集的上清液置于2 000 mL 烧杯中,加入等量的无水乙醇,搅拌均匀置冰箱中,于4 ℃下醇沉24 h。醇沉后的溶液于5 000 r/min 离心10 min,弃上清液,收集沉淀物。
(4)多糖冻干:将收集的沉淀物旋转蒸发残留的无水乙醇,然后进行真空冷冻干燥,最终获得卵孢小奥德蘑粗多糖。
1.3.1.2 卵孢小奥德蘑多糖测定
(1)葡萄糖标准曲线的绘制
称取0.1 g经105 ℃恒温烘干至恒重的葡萄糖于100 mL 烧杯中,加去离子水溶解,定容至1 000 mL。分别吸取不同体积(0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL)的葡萄糖标准溶液于试管中,用去离子水补至1.0 mL。向试管液中加入1.0 mL 5%苯酚溶液,然后立即加入5.0 mL 硫酸,静置10 min 后,用旋涡振荡仪振荡30 s,充分混匀反应液,于30 ℃水浴中静置20 min。用双光束紫外分光光度计于490 nm 处测定吸光度,绘制葡萄糖标准曲线,回归方程:y=0.0109x-0.0085,R2=0.9988。
(2)卵孢小奥德蘑多糖的测定
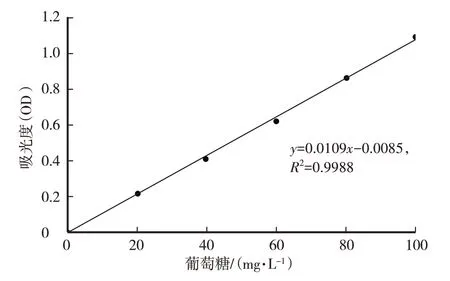
图1 葡萄糖标准曲线
采用苯酚硫酸法进行多糖含量的测定,作出标准曲线,根据标准曲线计算得出多糖含量,最后根据方程计算得出多糖提取率。
式中:ω—样品中多糖含量(g/100 g);C—从标准曲线上查得样品测定液中多糖含量(mg/L);V—样品定容体积(mL);M—样品质量(g);0.9—葡萄糖换算成葡聚糖的校正系数。
1.3.2 单因素试验
1.3.2.1 卵孢小奥德蘑多糖提取率与超声温度的关系
准确称取0.5 g 卵孢小奥德蘑粉末,按照料液比1∶40加入去离子水,搅拌均匀。超声功率240 W,于40 ℃、50 ℃、60 ℃、70 ℃、80 ℃的条件下,分别超声20 min。
1.3.2.2 卵孢小奥德蘑多糖提取率与超声时间的关系
准确称取0.5 g 卵孢小奥德蘑粉末,按照料液比1∶40 加入去离子水,搅拌均匀。于超声温度70 ℃,超声功率240 W 的条件下,分别超声10 min、20 min、30 min、40 min、50 min。
1.3.2.3 卵孢小奥德蘑多糖提取率与超声功率的关系
准确称取0.5 g 卵孢小奥德蘑粉末,按照料液比1∶40 加入去离子水,搅拌均匀。于超声温度70 ℃,超声功率180 W、210 W、240 W、270 W、300 W 的条件下,超声20 min。
1.3.2.4 卵孢小奥德蘑多糖提取率与料液比的关系
准确称取0.5 g 卵孢小奥德蘑粉末,按照料液比1∶10、1∶20、1∶30、1∶40、1∶50 加入去离子水,搅拌均匀。于超声温度70 ℃,超声功率240 W 的条件下,超声20 min。
1.3.3 正交试验
基于上述单因素试验结果,设计4 因素3 水平的正交试验,并通过正交试验确定卵孢小奥德蘑多糖提取的最佳工艺条件。
1.3.4 数据处理
数据统计采用Microsoft Office、Excel 2010、正交试验助手软件,标准偏差分析采用Spss 26.0 软件,试验结果作图采用Origin 2021软件。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声温度对卵孢小奥德蘑多糖提取率的影响
由图2 可知,卵孢小奥德蘑多糖提取率随着超声温度的上升呈现先升高后下降的趋势。超声温度50 ℃多糖提取率最高,为4.46%,超声温度超过50 ℃,提取率逐渐降低。超声温度从30 ℃升至50 ℃,溶液黏度逐渐下降,传质速率逐渐加快,导致对细胞的破坏力不断增大,细胞壁的结构变得更加疏松多孔,因而多糖更容易溶出[20-21]。超声温度过高会破坏多糖的分子结构而导致提取率低[22]。因此,选取超声温度为40 ℃、50 ℃、60 ℃作为后续的正交试验超声温度水平。
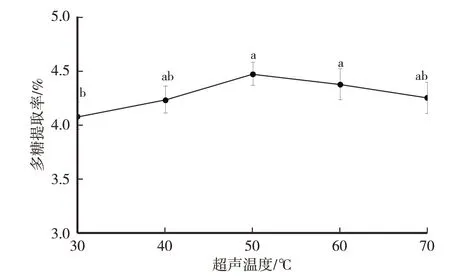
图2 超声温度对卵孢小奥德蘑多糖提取率的影响
2.1.2 超声时间对卵孢小奥德蘑多糖提取率的影响
研究表明,适度延长超声的时间,可以提高多糖的提取率[9-23]。由图3 可知,试验超声时间内卵孢小奥德蘑多糖提取率先逐渐升高后迅速下降,超声30 min 多糖提取率最高,为5.45%,显著高于其他超声时间处理的提取率(P<0.05)。超声时间10 min、20 min、30 min 时,多糖提取率逐渐上升,原因为超声波作用导致的多糖不断析出,提取率上升。但当超声时间超过30 min 后,部分多糖因长时间受到超声波的影响,其结构开始遭到破坏,发生水解现象,导致多糖损失,造成提取率出现快速下降现象[24]。综上,选取超声时间为20 min、30 min、40 min 作为正交试验设计的三个超声时间水平。
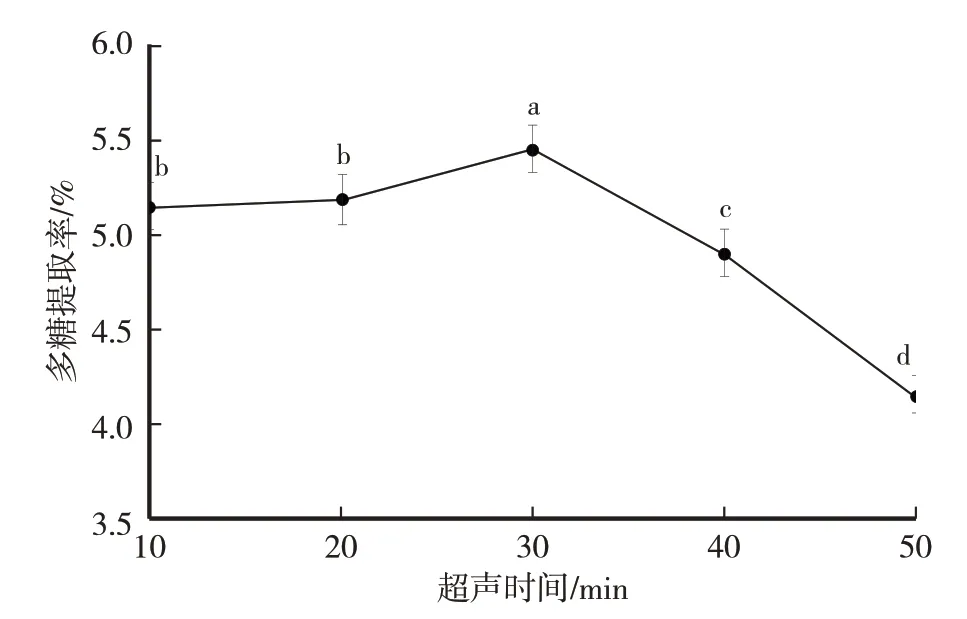
图3 超声时间(min)对卵孢小奥德蘑多糖提取率的影响
2.1.3 超声功率对卵孢小奥德蘑多糖提取率的影响
由图4 可知,卵孢小奥德蘑多糖提取率随超声功率的不断增大,呈现先升高后下降的趋势。其中180 W、210 W、240 W 超声功率下的多糖提取率显著高于其他处理。超声功率为210 W 时,多糖提取率达最高,为4.32%。当超声功率从180 W 升高至210 W 时,多糖提取率提高,原因为超声波加速破坏细胞壁,加快多糖物质的传递[25];但是当超声功率大于210 W,由于高频的功率导致多糖结构被破坏,造成损失,同时开始析出其他杂质[26],多糖提取率反而降低。因此选取180 W、210 W、240 W 为正交试验的三个超声功率水平。
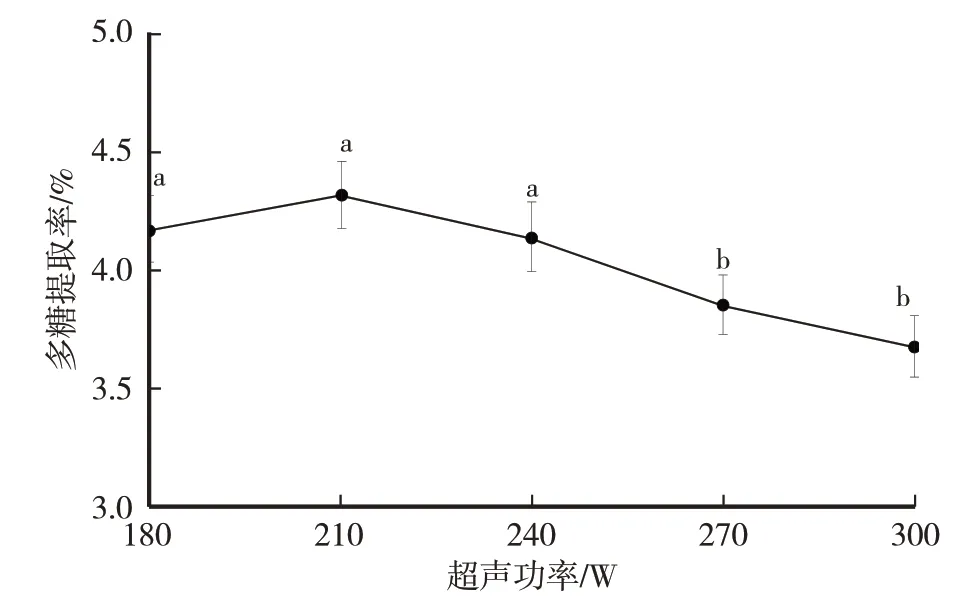
图4 超声功率(W)对卵孢小奥德蘑多糖提取率的影响
2.1.4 料液比对卵孢小奥德蘑多糖提取率的影响
由图5 可知,试验料(g)液(mL)比之间多糖提取率均存在显著性差异(P<0.05);多糖的提取率随料液比的上升而提高,并于料液比为1∶40时达峰值(5.50%),料液比大于1∶40时,提取率开始下降。当料液比在1∶10~1∶30时,多糖提取率缓慢上升,是由于粉末相对质量多,不能均匀分散在溶剂中,导致多糖提取率不高[27]。随着料液比的上升,多糖的提取率逐渐提高,因为溶剂的增加,溶剂与粉末间接触面积增大,以及超声的空化及振动作用,使多糖溶出量增加[28]。料液比超过1∶40 后,多糖提取率下降,这可能是因为过多的溶剂反而使得提取不完全,导致多糖提取率的下降[29]。正交试验选取料液比1∶30、1∶40、1∶50水平。
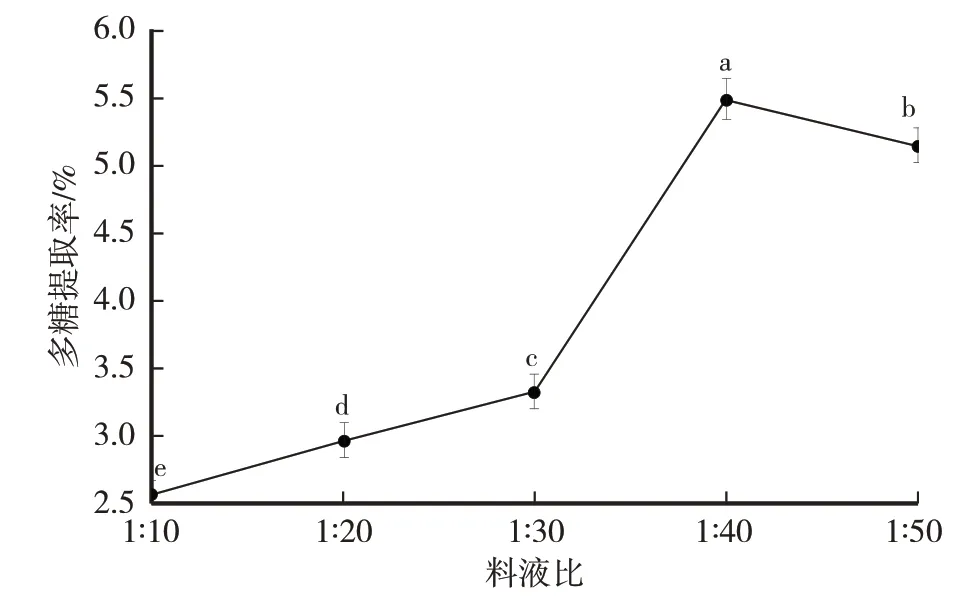
图5 料(g)液(mL)比对卵孢小奥德蘑多糖提取率的影响
2.2 正交试验结果
根据单因素试验的结果设计了4 因素3 水平的正交试验(表1)。
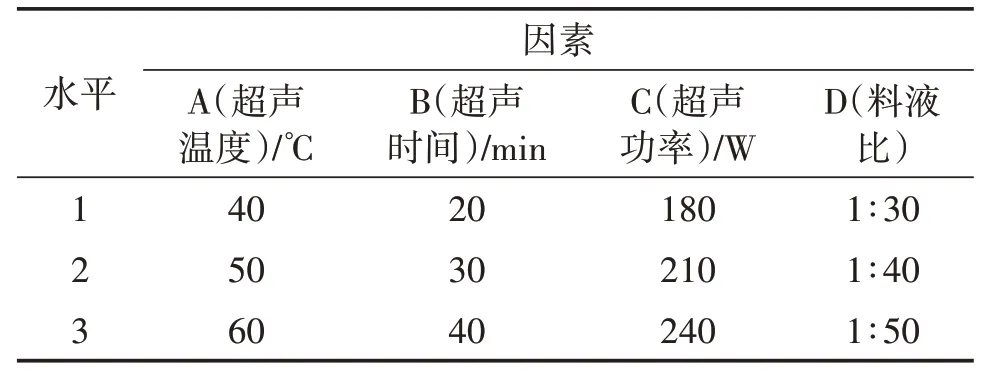
表1 正交试验设计
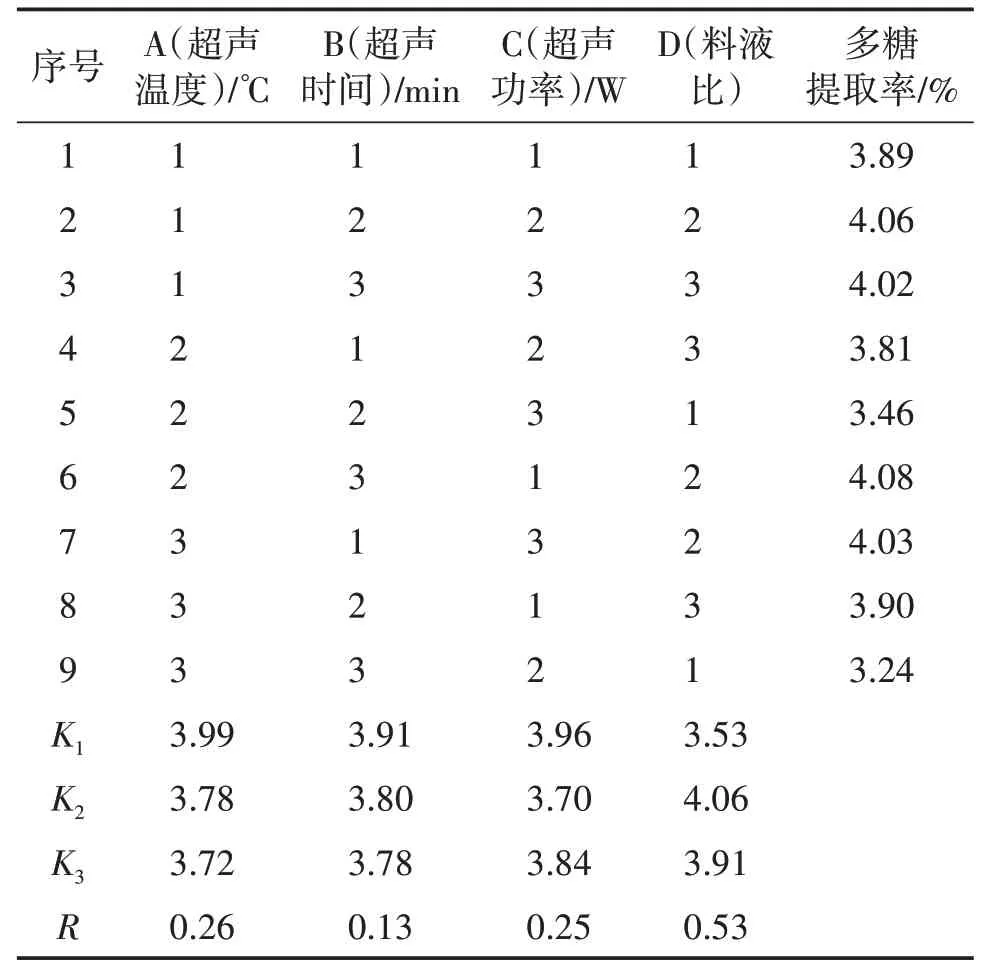
表4 正交试验结果
正交试验结果中,R值越大则该因素对多糖的提取率影响越大。由表2 可得,对卵孢小奥德蘑多糖提取率影响次序为D(料液比)>A(超声温度)>C(超声功率)>B(超声时间),料液比对多糖提取率影响最大,超声时间最小。由正交试验结果中的三组均值K1、K2、K3可知,多糖提取率的4因素3水平正交试验的最优组合是A1B1C1D2,即当超声温度40 ℃、超声时间20 min、超声功率180 W 以及料液比1∶40时,提取卵孢小奥德蘑多糖的效果最佳。
最优组合进行多糖验证试验,重复三次,多糖提取率为5.64%。因此正交试验的最优组合A1B1C1D2可以确定为卵孢小奥德蘑多糖提取率的最佳工艺条件。
3 小结
研究采用超声波提取法提取多糖,利用其机械作用破坏卵孢小奥德蘑的细胞壁、细胞膜,提高细胞内的传质效率,促进多糖成分的释放。通过单因素试验、正交试验确定超声波提取卵孢小奥德蘑多糖的最佳工艺条件为超声温度40 ℃,超声时间20 min,超声功率180 W,料液比1∶40,在此工艺条件下,卵孢小奥德蘑多糖的提取率达5.64%。研究为卵孢小奥德蘑多糖的进一步提取纯化和生物活性研究打下了基础。

