水溶液一步法制备铜基Cu2S微纳米结构及其超疏水性能
陈新华,李晓毅,张万强,侯珂珂,王宏胜
(1. 许昌学院 a. 化工与材料学院; b. 数理学院, 河南 许昌 461000;2. 广州市花都区秀全外国语学校, 广东 广州 510000)
0 引言
硫化亚铜是一种常见的半导体材料,其禁带宽度约为1.2 eV,被广泛应用于太阳电池[1]、锂离子电池[2]、超级电容器[3]以及析氧反应[4]等领域。金属铜由于具有优异的导热导电性和良好的可加工性,在人们的日常生活和生产中得到了广泛的应用。近年来,具有特殊微纳米结构的铜基硫化亚铜材料的制备引起了国内外研究者的广泛关注。在铜基材料表面制备硫化亚铜微纳米结构,一般采用气固反应,通过金属铜与硫化氢气体或硫化氢与氧气等的混合气体来进行制备[5-7]。在溶液中制备铜基硫化亚铜材料一般用水热法[8]或者通过两步法,即首先在铜表面制备氢氧化铜微纳米结构,然后通过硫化转化来制备[9]。
浸润性是固体表面的重要性质之一,它主要由表面化学成分和表面的微观几何结构共同决定的[10]。这种固体表面的浸润性根据水滴在其表面的静态接触角的不同,又可以分为亲水表面和疏水表面。当疏水表面对水的静态接触角大于150°、对水滴的滚动角小于10°时,被称为超疏水表面。超疏水表面由于这种特殊的浸润性而被应用于流体减阻[11]、油水分离[12]、防细菌[13]、太阳能电池等领域。
本文采用铜基材料和硫代乙酰胺(CH3CSNH2)在室温下反应,直接在铜基表面制备硫化亚铜微纳米颗粒结构,经过充分干燥后达到超疏水性能。 该方法简单易行,使用试剂单一,将具有很好的工业化应用前景。
1 实验部分
1.1 试剂与仪器
扫描电子显微镜(SEM,EVOLS15,英国:蔡司公司);动态接触角仪(JC2000D2,上海中晨数字技术设备有限公司);X射线粉末衍射仪(XRD,D8-Advance,德国:Bruker);X射线光电子能谱仪(XPS,ESCALAB 250Xi,美国:赛默飞世尔科技公司。单色Al Ka (hv=1 486.6 eV),功率150 W,500 μm束斑;结合能以C 1s 284.6 eV校准)。
1.2 实验步骤
铜箔(国药集团化学试剂有限公司,厚度0.1 mm)裁成1 cm × 2 cm大小。 用1200目砂纸打磨,除去表面氧化层和油脂;然后,分别用无水乙醇和去离子水超声清洗10 min;最后,用大量去离子水清洗干净。
将上述铜箔浸渍于不同浓度的CH3CSNH2溶液中,室温下反应一定时间后,将试样取出,用去离子水清洗,然后放入70 ℃ 烘箱中烘干24 h。
2 结果与讨论
2.1 铜基表面的化学组成分析
图1是铜箔反应前后的XRD谱图。
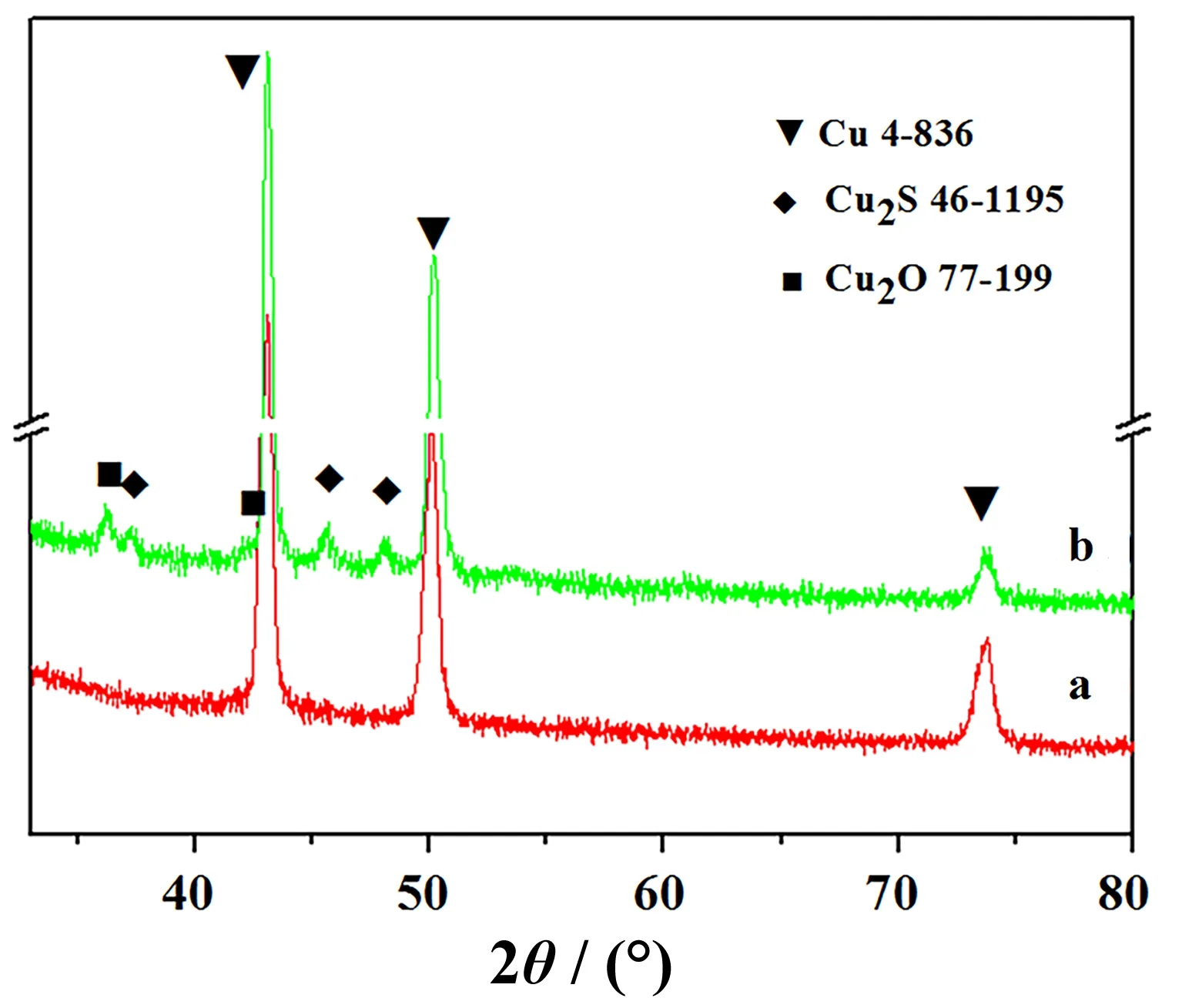
图1 铜箔与CH3CSNH2溶液反应前后的XRD图谱(a)反应前;(b)反应后Fig. 1 XRD patterns of copper foil before (a) and after (b) the reaction with CH3CSNH2 solution
从图1a可以看出在43.13°、50.14°、73.77°位置处出现了3个明显的衍射峰,分别对应面心立方结构金属铜基底的(111)、(200)、(220)晶面的特征衍射峰。当铜基底在0.5 mol/dm3的CH3CSNH2溶液中浸泡4 d后,在36.23°、45.74°和48.14°分别出现了Cu2S(JCPDS Card No. 46-1195)强度较弱的衍射峰,分别对应(102)、(110)和(103)晶面。同时,也在37.33°和42.24°出现了Cu2O(JCPDS Card No. 77-199)强度非常微弱的衍射峰,分别对应(111)和(200)晶面(如图1b)。这表明当铜箔在CH3CSNH2溶液中浸泡一段时间后,最终在铜箔表面形成了Cu2S相,其中掺杂有少量Cu2O。与此同时,铜箔表面的颜色也由铜红色最终变成了黑色。其反应机理如下所述。
铜基底被水中的溶解氧氧化,得到氧化铜:
2Cu + O2→ 2CuO
氧化铜与金属铜进一步反应得到氧化亚铜(在XRD图谱中发现有氧化亚铜相生成):
Cu + CuO → Cu2O
氧化亚铜亦可发生歧化反应得到铜离子(反应后溶液颜色为蓝色):
Cu2O +H2O→ Cu2++ Cu+ 2OH-
在水溶液中,氧化亚铜与CH3CSNH2释放出的硫离子反应,转化为更难溶的硫化亚铜;或溶液中的铜离子与硫离子发生氧化还原反应而得到硫化亚铜相。由于在水溶液中室温下反应,所得到的硫化亚铜相晶体结晶度较差,所以其XRD衍射峰强度较弱。
Cu2O + S2-+H2O→ Cu2S + 2OH-
2Cu2++ 2S2-→ Cu2S + S
2.2 铜箔表面SEM表征
2.2.1 溶液浓度对表面形貌的影响
图2(a—c)分别为经过预处理的铜箔在不同浓度的CH3CSNH2溶液中浸泡4 d后得到的铜表面的SEM图。从图2可以看出,铜箔在经过4 d的浸泡后,表面上均沉积出大量微晶,这些微晶大多数为微球型结构,表面较光滑,尺寸为100~500 nm。此时,铜箔表面颜色也逐渐由红铜色转变为黑色。

图2 铜箔在不同浓度CH3CSNH2溶液中反应4 d后所得铜箔表面的SEM图(a) 预处理后的铜箔;(b) 0.005 mol/dm3;(c) 0.05 mol/dm3Fig. 2 SEM images of copper foil surfaces after immersion in different concentrations of thioacetamide solution for 4 days(a) pretreated copper foil; (b) 0.005 mol/dm3; (c) 0.05 mol/dm3
通过对比不同浓度的CH3CSNH2反应相同时间后的SEM图,可观察到CH3CSNH2溶液的浓度对铜箔表面的微观形貌有明显的影响。 当CH3CSNH2浓度为0.005 mol/dm3时,铜箔表面层沉积有直径为300~500 nm的亚微米球组成,微球表面比较光滑而缺少次级纳米结构,排布也较为分散;当CH3CSNH2浓度增加到0.05 mol/dm3时,铜箔表面出现了微纳米双尺寸的粗糙度结构,但分布的比较稀疏;而进一步增大CH3CSNH2浓度至0.5 mol/dm3时(图3 d),表面沉积了由小尺寸纳米粒子聚集而成的密集颗粒膜。为了得到较为均匀的超疏水铜表面,在实验中选择了0.5 mol/dm3的CH3CSNH2溶液。
2.2.2 反应时间对铜箔表面形貌的影响
图3(a—f)分别为铜箔在0.5 mol/dm3CH3CSNH2溶液中反应1、2、3、4、5、6 d后所得铜表面的SEM图。
从图3可以看出,随着反应时间的延长,在铜箔表面沉积的纳米颗粒越来越多。 在表面自由能的驱动下,这些尺寸为100~300 nm不等的纳米颗粒以无规则聚集的形式沉积在铜表面上,形成具有微米级尺寸的岛状结构。 这些微米岛之间存在大量空隙,而这些空隙的尺寸会随着反应时间的延长而出现一定程度的减小。 与此同时,纳米颗粒之间同样存在尺寸更小的空隙。 这些微米级、亚微米级及纳米级空隙能捕获大量空气,使得水滴与这类双尺度粗糙表面相接触时,绝大部分接触面为液-气界面。 因此,这种同时具有微米和亚微米、纳米级双尺度的粗糙结构为铜箔表面超疏水性能的实现提供了表面形貌基础。
综上,反应时间的长短会对铜表面多尺度粗糙结构的形成及形貌产生影响。 一方面,反应时间会影响多尺度粗糙结构的形成,因为这种特殊结构的形成需要一定的时间;另一方面,反应时间会影响微晶及空隙的尺寸。 通过大量实验可知,铜箔与CH3CSNH2溶液反应1 d以上,就可得到超疏水性表面。反应时间过长虽然可以获得较好的超疏水性,但铜表面颗粒却容易脱落,从而失去超疏水性。同时,铜表面与水的静态接触角在4 d时已达到171.15°,继续延长反应时间接触角并无明显变化,故选取反应时间为4 d。
2.3 铜箔表面的浸润性分析
2.3.1 铜箔表面的静态接触角和滚动角
经过预处理的铜箔表面对水滴的静态接触角约为114.7°,表明铜箔经过充分干燥后具有一定的疏水性。当铜箔在0.5 mol/dm3CH3CSNH2溶液中浸泡4 d后,铜表面对水滴的静态接触角高达171.15°,对水滴的前进角为172.88°,后退角为169.42°,接触角滞后仅3.46°,表明铜表面已达到超疏水状态。 通过Wenzel方程计算可知,该表面的粗糙因子r高达2.36,表明该表面具有较大的粗糙度。但对于超疏水表面,除了拥有较大的静态接触角外,还应具有较低的滚动角。 图4为14 μL水滴在倾斜一定角度的超疏水铜表面上滚动的光学照片,滚动角约为3.5°,说明铜表面的接触角滞后很小,具有优异的超疏水性能。

图4 14 μL水滴在超疏水铜表面滚动时的光学照片Fig. 4 Optical photographs of a 14 μL water droplet rolling off a superhydrophobic copper surface
2.3.2 超疏水铜箔表面的黏附性能
图5是用超疏水铜表面逐渐挤压并离开悬挂在接触角仪滴头上的6 μL水滴的光学照片。

图5 6 μL水滴与超疏水铜表面靠近、接触、挤压及脱离时的光学照片Fig. 5 Approach, contact, deformation and departure processes of a 6 μL water droplet suspending on a syringe with respect to the superhydrophobic copper surface
无论超疏水铜表面与悬挂在针尖上的水滴如何挤压,都无法将水滴从针头上拉下,这表明该表面与水滴之间的黏附力很小。 此外,不管超疏水铜表面与水滴如何紧密接触,水滴离开铜表面后依然保持较完美的球形;即使针头深插入到水滴的内部,水滴依然保持球形,并且能轻易地离开超疏水铜表面而不残留任何水渍在铜表面上,充分说明超疏水铜表面具有较好的防水滴黏附性。 综上分析可知,由于所制备的硫化亚铜具有亚微米-纳米级颗粒结构,且这些颗粒结构又相互堆积形成微米级的簇状结构,从而具有了微米-亚微米/纳米双尺度或多尺度的阶层结构,该类结构又被称为“类荷叶结构”,从而既能表现出高的接触角,又具有较小的滚动角。 相对于其他相关报道,该方法制备过程极为简单,不需要低表面能物质的化学改性,且具有优良的超疏水性能和低的黏着性能。
2.4 超疏水铜箔表面XPS分析
铜箔与0.5 mol/dm3CH3CSNH2溶液反应4 d经充分干燥后,其表面的XPS全谱见图6a。从图6a可以看出,除了碳、氧与铜的衍射峰外,S 2p的衍射峰非常微弱,这也与其XRD图谱较弱的衍射峰相对应,说明硫化亚铜的结晶性并不好。 从其表面的C 1s 窄谱(图6b)可以看出,其主峰结合能为284.6 eV,对应于C—C键和C=C键。
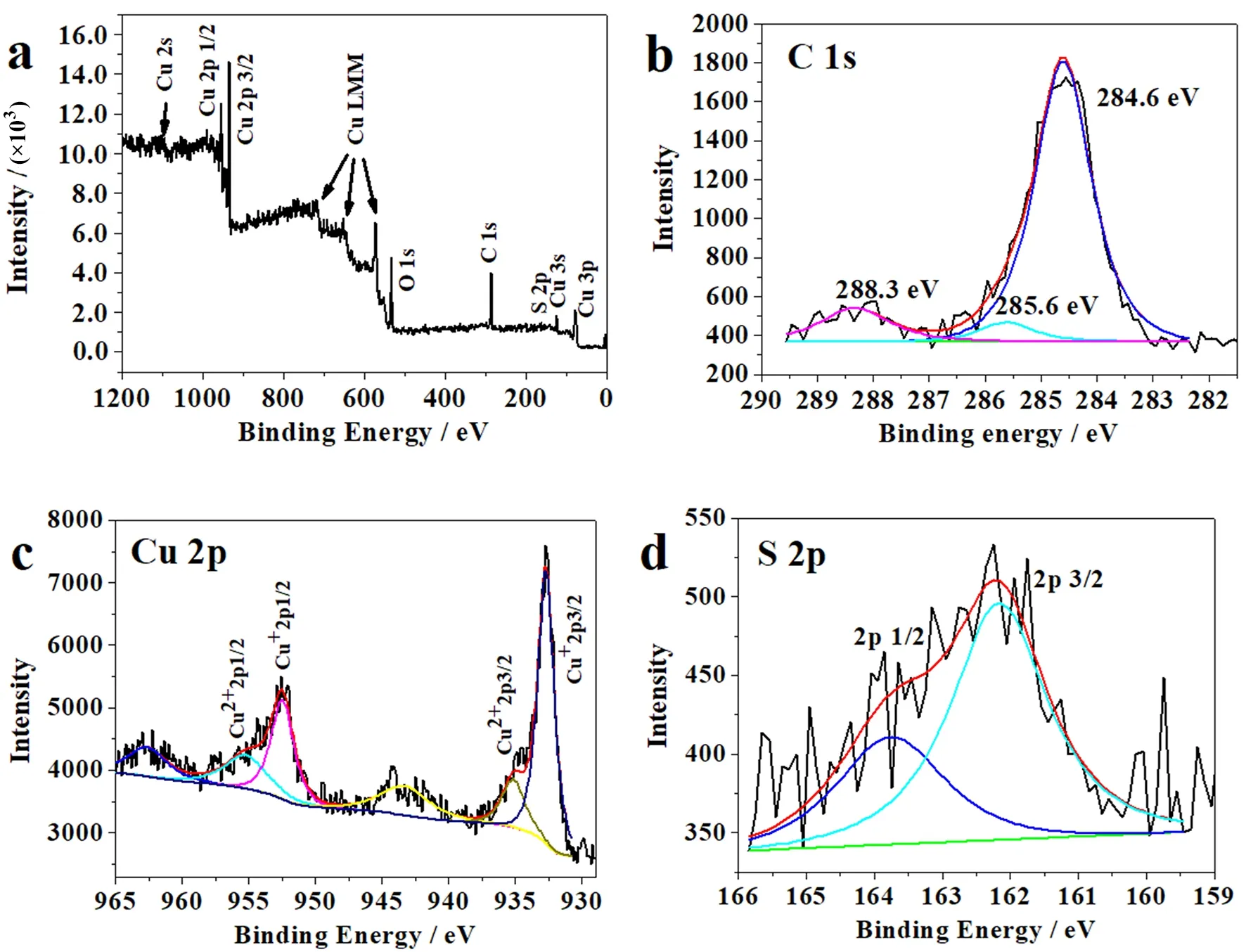
图6 超疏水铜表面的XPS谱图(a) XPS全谱;(b) C 1s窄谱;(c) Cu 2p窄谱;(d) S 2p窄谱Fig. 6 XPS spectra of the superhydrophobic copper surface(a) core-level spectra; (b) C 1s; (c) Cu 2p; (d) S 2p
在285.6 eV处对应于C=O键,而在288.3 eV处对应于COO键。从其衍射峰面积来看,C—C键和C=C键等非极性碳峰面积与C=O键和COO键等极性碳峰面积之和的比值高达4.58,说明超疏水硫化亚铜微纳米颗粒经充分干燥后,其表面主要是非极性碳,这可能也是硫化亚铜颗粒表面呈现出超疏水性的主要原因。
从Cu 2p窄谱(图6c)可以看出,Cu 2p 3/2分为两个峰,分别为932.72 eV和935.16 eV,对应于Cu+/Cu或Cu2+。Cu 2p 1/2分为两个峰,分别为952.48 eV和955.23 eV,对应于Cu+或Cu2+[14]。而在943.34 eV和962.66 eV处出现了两个峰,对应于Cu2+,说明硫化亚铜颗粒表面部分被氧化为Cu(Ⅱ),存在形式可能是CuS或铜基底裸露的表面被空气中的氧所氧化形成的CuO,暂不能具体确定。S 2p窄谱(图6d)可分为两个峰,峰位置分别在162.17 eV和163.76 eV处,分别对应于S 2p 3/2和S 2p 1/2[15],但峰的位置都相对较弱。
3 结论
采用简单的一步水溶液法,在铜基底上构筑了硫化亚铜微米-纳米双尺度的特殊粗糙结构,该表面表现出优异的超疏水性能,与水的静态接触角可高达171°,滚动角低至约3.5°,黏附性低。该方法简单,成本低廉,易于大规模工业生产。

