N-乙酰半胱氨酸对体外循环所致大鼠肺损伤的影响及机制研究
曹惠鹃,刘 敏,张晓东,孙莹杰*,刁玉刚
0 引言
体外循环(Cardiopulmonary bypass,CPB)诱发的肺损伤是心脏手术的常见并发症之一,严重影响患者预后。CPB过程中,全身炎症反应和缺血再灌注引起的氧化应激对肺组织造成损伤,可导致肺水肿、肺不张、急性呼吸窘迫综合征(ARDS)等严重疾病[1-2]。N-乙酰半胱氨酸(N-acetyl cysteine,NAC)具有抗炎、抗氧化作用,可减轻感染性休克小鼠肺损伤的严重程度[3],降低CPB下行心脏瓣膜置换术患者血浆肺表面活性物质相关蛋白A水平,并改善呼吸功能参数[4]。因此,本研究将NAC用于CPB大鼠,旨在探讨其对CPB 所致肺损伤的影响及机制。
1 材料与方法
1.1 实验材料 清洁级健康成年雄性SD大鼠24只,体重350~450 g,12~16周龄,由北部战区总医院医学实验动物中心提供。采用随机数字表法将大鼠分为假手术组(control组)、CPB组、NAC+CPB组,每组8只。本研究对实验动物的处置均符合动物伦理学标准(北部战区总医院实验动物伦理号:2014076)。
1.2 模型建立 大鼠饲养环境:安静,空气清新,温度18~25 ℃,相对湿度55%~60%,12 h光暗循环。每天更换垫料,大鼠可自由进食和饮水。术前禁食6 h,不禁饮。大鼠称重后,10%水合氯醛(300 mg/kg)腹腔注射麻醉,大鼠翻转反射消失后,将其固定于鼠板,行气管插管后,连接小动物呼吸机,设定呼吸参数:氧体积分数1.0,潮气量3 ml/100 g,呼吸频率60次/min,吸呼比1.0∶1.5,气道峰压9 cmH2O。穿刺部位备皮、消毒后,右股静脉穿刺置管,经微量输液泵补液;尾动脉穿刺置管后接压力传感器,行有创动脉血压监测;右颈静脉穿刺,将自制的带侧孔的18G导管置于右心房;22G套管针左股动脉置管,用于CPB过程中血液回输,进行预充和血气管理[5]。初始转流量为25~30 ml/(kg·min),逐渐增加至100~150 ml/(kg·min),将储血器液体平面控制在3~4 ml。转流开始将氧气与膜式氧合器相连,关闭呼吸机。转流期间,维持平均动脉压>60 mmHg,pH 7.35~7.45,动脉二氧化碳分压35~45 mmHg,碱剩余-3~3 mmol/L,红细胞压积>25%。转流时间达到1 h后,逐渐减小转流量至停止,开启小动物呼吸机,恢复机械通气。实验过程中,维持大鼠体温在35.5~36.5 ℃。转流结束2 h后,实验动物生命体征平稳视为模型建立成功。Control组只进行动静脉置管不进行CPB,CPB组、NAC+CPB组置管并进行CPB 1 h,转流结束后观察2 h。NAC+CPB组在预充液中加入NAC 100 mg/kg,然后以20 mg/(kg·min)持续泵注直至转流停止。CPB组在预充液中加入等容量的生理盐水,转流期间泵注等容量生理盐水。
1.3 观察指标 建模成功后,取大鼠股动脉血进行血气分析,计算氧合指数(Oxygenation index,OI)和呼吸指数(Respiratory index,RI)。麻醉状态下放血处死大鼠,开胸取左上肺叶进行湿/干重比值测定;左下肺叶经甲醛固定,梯度乙醇脱水,石蜡包埋,连续切片,HE染色,在光镜下进行病理学观察。参照Kim等[6]的标准,对肺组织损伤程度进行评分。右肺置于液氮中,采用ELISA法检测肺组织肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)和白细胞介素-6(Interleukin-6,IL-6)水平,试剂盒均购自美国R&D公司。比色法测定肺组织丙二醛 (Malondialdehyde,MDA)和超氧化物歧化酶(Superoxide dismutase,SOD)的水平,试剂盒均购自南京建成生物工程研究所。蛋白免疫印迹法检测肺组织紧密连接蛋白claudin-4的表达情况,一抗购自美国Abcam公司,二抗工作液购自碧云天生物技术研究所。
1.4 统计学方法 采用SPSS 24.0统计学软件对数据进行分析。符合正态分布的计量数据用均数±标准差表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理学情况 光镜下,control组肺组织结构清晰完整,未见明显异常,而CPB组和NAC+CPB组肺泡、肺泡腔、肺泡间隔均有不同程度的损伤。CPB组表现为部分肺泡壁断裂、肺泡腔塌陷,肺泡腔内可见炎症细胞、红细胞和水肿液渗出。NAC+CPB组表现为肺泡间隔略增宽,肺泡毛细血管略扩张,肺泡腔内有少许炎症细胞及红细胞渗出。与control组比较,CPB组和NAC+CPB组肺泡间隔变厚;与CPB组比较,NAC+CPB组肺泡间隔变薄,且差异均有统计学意义(P<0.05)。见图1和表1。

表1 各组大鼠肺泡间隔厚度、肺损伤评分、湿/干重比值及肺功能指标比较(n=8)
2.2 各组大鼠肺损伤评分、湿/干重比值及肺功能指标比较 与Control组比较,CPB组、NAC+CPB组的肺损伤评分、湿/干重比值、RI增高;与CPB组比较,NAC+CPB组上述指标显著降低,且差异均有统计学意义(P<0.05)。与Control组比较,CPB组、NAC+CPB组OI显著降低;与CPB组比较,NAC+CPB组OI显著升高,且差异均有统计学意义(P<0.05)。见表1。
2.3 各组大鼠肺组织MDA、TNF-α、IL-6、SOD水平比较 与Control组比较,CPB组、NAC+CPB组肺组织TNF-α、IL-6及MDA水平显著升高;与CPB组比较,NAC+CPB组上述指标显著降低,且差异均有统计学意义(P<0.05)。与Control组比较,CPB组、NAC+CPB组SOD水平显著降低;与CPB组比较,NAC+CPB组SOD水平显著升高,且差异均有统计学意义(P<0.05)。见表2。

表2 各组大鼠肺组织MDA、TNF-α、IL-6、SOD水平比较(n=8)
2.4 各组肺组织claudin-4蛋白表达情况比较 与Control组比较,CPB组、NAC+CPB组大鼠肺组织claudin-4蛋白的表达均下调,与CPB组比较,NAC+CPB组肺组织claudin-4蛋白的表达上调,且差异均有统计学意义(P<0.05)。见图2。
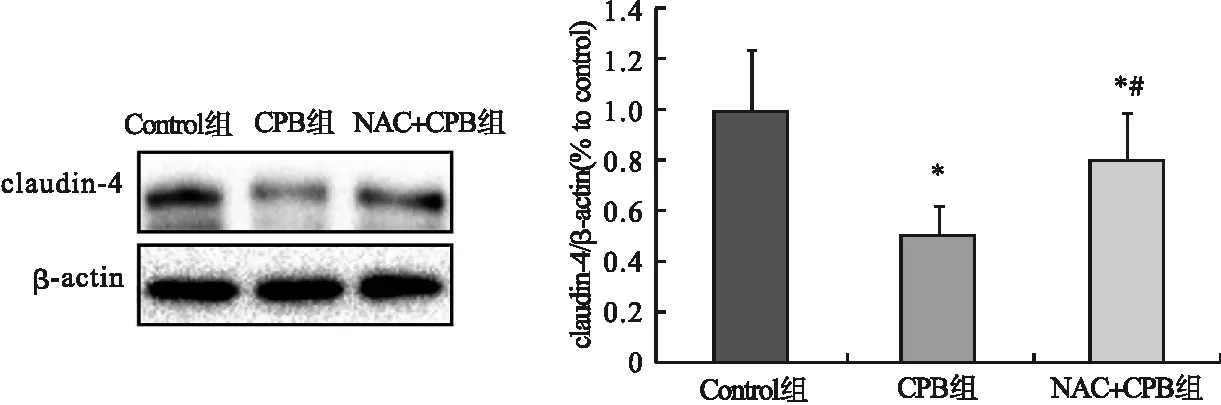
图2 各组肺组织claudin-4蛋白表达情况比较(n=8)注:*与Control组比较,P<0.05;#与CPB组比较,P<0.05
3 讨论
CPB可致多个器官损伤,肺损伤是常见的并发症之一。血液与CPB管路接触后,血细胞、炎症细胞及补体被激活,释放出多种炎症因子,诱发肺损伤;而缺血再灌注可破坏肺血管内皮细胞,造成肺水肿,进一步加重肺损伤[5,7]。动物实验表明,腹腔注射一定剂量的NAC,可在一定程度上降低脂多糖导致的感染性休克小鼠的肺组织炎性因子水平和肺组织病理学评分[8]。课题组的前期临床研究发现,在CPB前及CPB过程中应用一定剂量的NAC,可降低风湿性心脏病患者CPB下行心内直视术的血浆肺表面活性物质相关蛋白A水平[4],改善呼吸指数、氧合指数和气道阻力等呼吸功能参数,但NAC对CPB致肺损伤的具体保护作用及机制尚不明确。
目前,CPB 诱发的炎症级联反应被认为是CPB所致肺损伤的主要原因,而TNF-α、IL-6和IL-8可导致多脏器功能障碍且与患者预后密切相关[7,9]。有研究表明,在CPB过程中经肺动脉灌注TNF-α抗体,可降低兔肺组织TNF-α水平,改善氧合指数及减轻肺泡结构的损伤程度。此外,CPB过程中肺组织缺血,CPB结束后肺组织恢复灌注所致的再灌注损伤,以及CPB时肺组织的高氧耗状态[10],也可导致肺损伤。本研究发现,CPB后,肺组织发生了明显的损伤性改变,存在明显的氧化应激;而在CPB前及CPB中静脉应用一定剂量的NAC,可以降低肺组织MDA水平,上调肺组织SOD抗氧化酶的活性,显著减轻肺损伤。通过测量MDA、SOD及肺损伤评分评价损伤的情况,发现NAC通过清除氧自由基、过氧化氢等物质发挥保护作用,降低肺损伤评分。本动物实验发现,在CPB前和CPB过程中应用一定剂量的NAC,可显著降低大鼠肺组织中TNF-α和IL-6水平,提示NAC除抗氧化应激作用外,还在一定程度上降低CPB所诱发的肺组织炎症反应。临床研究表明,NAC可降低体外循环下换瓣患者血浆炎性因子水平[4],而本研究进一步在肺组织水平证明NAC的抗炎作用和肺保护作用。
紧密连接是调节细胞旁屏障对水、小分子和离子通透性的顶端连接复合体成分,而调节细胞旁通透性的主要决定因素是claudin家族跨膜蛋白。紧密连接蛋白claudin形成具有不同特异性和通透性的细胞旁离子通道,组织特异性 claudin 复合物决定器官的特异性细胞旁通透性[11]。紧密连接蛋白claudin的组成和结构也对环境应激(如炎症)敏感,其组成和结构的改变会影响细胞旁屏障功能,而肺泡上皮紧密连接表达下降会影响肺泡上皮细胞旁离子通道的特异性功能,无法正常转运物质和清除肺泡内的液体,导致肺水肿[12-13]。本研究结果表明,CPB可诱发肺组织氧化应激及炎性反应,下调大鼠肺组织claudin-4蛋白表达,导致肺水肿;而NAC具有抗氧化和抗炎作用,能够改善CPB大鼠的claudin-4蛋白表达和肺水肿情况。NAC可能通过抗氧化及抗炎作用减轻紧密连接蛋白claudin的环境应激,进而上调紧密连接蛋白claudin的表达,从而减轻肺水肿,发挥肺保护作用。
综上所述,在CPB过程中应用一定剂量的NAC,可减轻CPB诱发的肺损伤,其机制可能与其抗炎、抗氧化作用及上调紧密连接蛋白claudin-4的表达有关。

