细菌性血流感染鉴别诊断中PCT及IL-6水平检测的临床价值
谢中意 李致富 黄昀
细菌性血流感染为全身性感染疾病,通常是由金黄色葡萄球菌、大肠埃希菌、肺炎链球菌等入侵血液、参与血液循环引起的,公共场所较为常见[1]。疾病发生后,患者可出现不同程度发热、寒战、皮疹、呼吸急促症状,病情严重者可出现感染性休克和多脏器功能衰竭等情况,甚至危及生命安全[2]。因此,临床应重视疾病早期诊断,及时采取对症治疗措施,以延缓病程降低死亡风险。目前,临床主要以患者临床表现为判定依据来选择用药方式;但该方式过于依赖个人经验,加上疾病表现特异性不足,可能出现不合理用药情况,使得患者耐药性增加,影响抗菌效果。血培养为疾病诊断“金标准”,但耗时长,易为外界环境干扰;出现假阴性结果,影响疾病早期诊断,可耽误最佳治疗时机,增加疾病复杂程度和治疗难度[3]。分子生物学检测速度快、准确率高,但技术要求高、成本贵,无法应用至大范围筛查中。现阶段,免疫技术迅速发展,炎症因子在该疾病的诊断中被广泛应用。降钙素原(procalcitonin,PCT)为免疫调节蛋白,机体状态正常时,其水平极低,细菌感染后,其水平明显上升,可用于疾病鉴别诊断[4]。白细胞介素-6(interleukin-6,IL-6)是机体炎症反应的重要参与者,其水平可反映感染性疾病严重程度[5]。细菌性血流感染包括革兰阳性菌感染和革兰阴性菌感染,致病菌不同,发病机制也存在差异;需准确评估致病菌类型,鉴别诊断疾病,为治疗方案的选择提供依据[6]。为此笔者对PCT和IL-6在细菌性血流感染鉴别诊断中的应用情况进行了总结分析,现报道如下。
1 资料与方法
1.1 一般资料
文章纳入细菌性血流感染患者90例,就诊时间为2020年6月—2022年6月,设置同期90名健康体检者为对照组。观察组49例男性,41例女性,年龄22~75岁,平均(49.57±6.12)岁;病程3~12 d,平均(7.78±2.21)d;感染类型:革兰阳性菌47例(21例金黄色葡萄球菌感染,15例凝固酶阴性葡萄球菌感染,11例链球菌感染),革兰阴性菌43例(18例大肠埃希菌感染,15例肺炎克雷伯菌感染,6例鲍曼不动杆菌感染,4例铜绿假单胞菌感染);血培养结果评估感染严重程度:轻度35例,中度31例,重度24例。对照组44名男性,46名女性,年龄24~75岁,平均(50.16±6.24)岁。纳入标准:(1)观察组均为细菌性血流感染患者。(2)年龄>20岁。(3)患者意识清楚,主动配合研究。(4)资料较为完整,数据真实。排除标准:(1)心、脑、肝、肾结构与功能异常者。(2)免疫系统疾病患者或结缔组织病变患者。(3)其他类型感染疾病者。(4)血清标本不合格者。(5)恶性肿瘤患者。研究经医学伦理委员会审批通过,研究对象了解研究详情,且自愿参与。
1.2 方法
1.2.1 仪器与试剂
医用离心机(生产厂家:长沙高新技术产业区湘仪离心机仪器有限公司,备案号:湘长械备20160113号,型号规格:CTKI20C);全自动化学发光免疫分析仪(生产厂家:深北京热景生物技术股份有限公司,医疗器械注册证编号/产品技术要求编号:国械注准20183220505,型号规格:C200);IL-6测定试剂盒(磁微粒化学发光免疫分析法)(生产厂家:深北京热景生物技术股份有限公司,医疗器械注册证编号/产品技术要求编号:京械注准:20172400287,规格:90人份/盒)。
1.2.2 检测方法
检查前,逐项核对研究对象的姓名、年龄和编号等信息,向其说明检查流程,耐心解答研究对象的疑问,确保其情绪稳定;叮嘱研究对象检查前保持12 h空腹状态,抽取3~5 mL外周静脉血,使用离心机对血液样本行离心处理(速度为3000 r/min,时间为10 min),将分离所得清液作为待测标本。检测流程:(1)试剂准备:试剂平衡至室温开始,将500 μL校准品稀释液加入校准品1(calpain-1,CAL-1)和校准品2(calpain-2,CAL-2)中,室温平衡30 min后检测。(2)录入校准曲线数据:打开仪器软件,进入曲线添加界面,扫描添加或是手动输入。(3)加样:将100 μL校准品加入仪器对应样本孔,适量血清样本(>100 μL)加入仪器样本位,点击开始。(4)混样:仪器自动吸取样本、标记样本和包被抗体,各为50 μL,混匀。(5)温育:在37℃条件下温育混合样本30 min。(6)清洗:温育完成后反复清洗3次。(7)检测:仪器自动吸取底物液,混合均匀,测光,经仪器计算输出浓度数据。
1.3 观察指标
1.3.1 两组血清指标对比
比较对照组与观察组患者PCT与IL-6水平。
1.3.2 不同类型细菌感染患者血清指标水平
比较革兰阳性菌感染与革兰阴性菌感染患者PCT、IL-6水平。
1.3.3 不同程度感染患者血清指标水平
比较轻度、中度与重度患者PCT、IL-6水平。
1.3.4 诊断效能
采用受试者工作特征(receiver operating characteristic,ROC)曲线评估PCT和IL-6单独检测和联合检测在革兰阳性菌和革兰阴性菌血流感染鉴别诊断的临床价值。
1.4 统计学方法
数据处理软件为SPSS 25.0,计数资料以n(%)表示,检验采用χ2;计量资料符合正态分布,以(±s)表示,检验采用t或F检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清指标对比
与对照组比较,观察组PCT、IL-6水平更高,差异有统计学意义(P<0.05),见表1。
表1 观察组与对照组血清指标对比(±s)

表1 观察组与对照组血清指标对比(±s)
组别例数PCT(ng/mL)IL-6(pg/mL)对照组900.03±0.012.18±0.44观察组901.48±0.2160.96±7.16 t值-65.43077.735 P值-<0.001<0.001
2.2 不同类型细菌感染患者血清指标水平比较
革兰阳性菌与革兰阴性菌感染患者IL-6水平比较差异无统计学意义(P>0.05);与革兰阳性菌感染患者相比,革兰阴性菌感染患者PCT水平更高,差异有统计学意义(P<0.05),见表2。
表2 革兰阳性菌感染与革兰阴性菌感染患者血清指标水平比较(±s)

表2 革兰阳性菌感染与革兰阴性菌感染患者血清指标水平比较(±s)
组别例数PCT(ng/mL)IL-6(pg/mL)革兰阳性菌感染470.78±0.2559.18±7.45革兰阴性菌感染431.56±0.5261.78±7.72 t值-9.1911.625 P值-<0.0010.108
2.3 不同程度感染患者血清指标水平比较
与轻度患者比较,中度与重度患者PCT、IL-6水平更高,重度患者PCT、IL-6水平明显高于轻度和中度患者,比较差异均有统计学意义(P<0.05),见表3。
表3 轻度、中度与重度感染患者血清指标水平比较(±s)

表3 轻度、中度与重度感染患者血清指标水平比较(±s)
注:PCT:t轻度vs.中度=12.293,P轻度vs.中度<0.001;t轻度vs.重度=23.611,P轻度vs.重度<0.001;t中度vs.重度=13.860,P中度vs.重度<0.001;IL-6:t轻度vs.中度=26.796,P轻度vs.中度<0.001;t轻度vs.重度=68.975,P轻度vs.重度<0.001;t中度vs.重度=44.072,P中度vs.重度<0.001。
感染程度例数PCT(ng/mL)IL-6(pg/mL)轻度351.21±0.2424.54±5.32中度312.06±0.3262.27±6.12重度243.72±0.56150.24±8.68 t值-320.8022604.066 P值-<0.001<0.001
2.4 诊断效能
PCT联合IL-6鉴别诊断不同类型细菌性血流感染的灵敏度更高,参数见表4和图1。
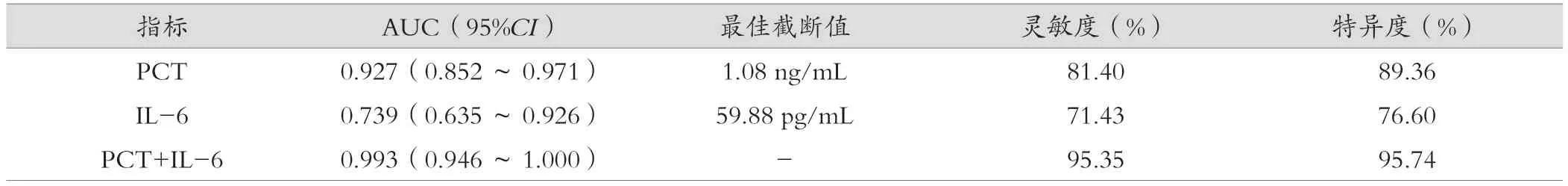
表4 诊断效能
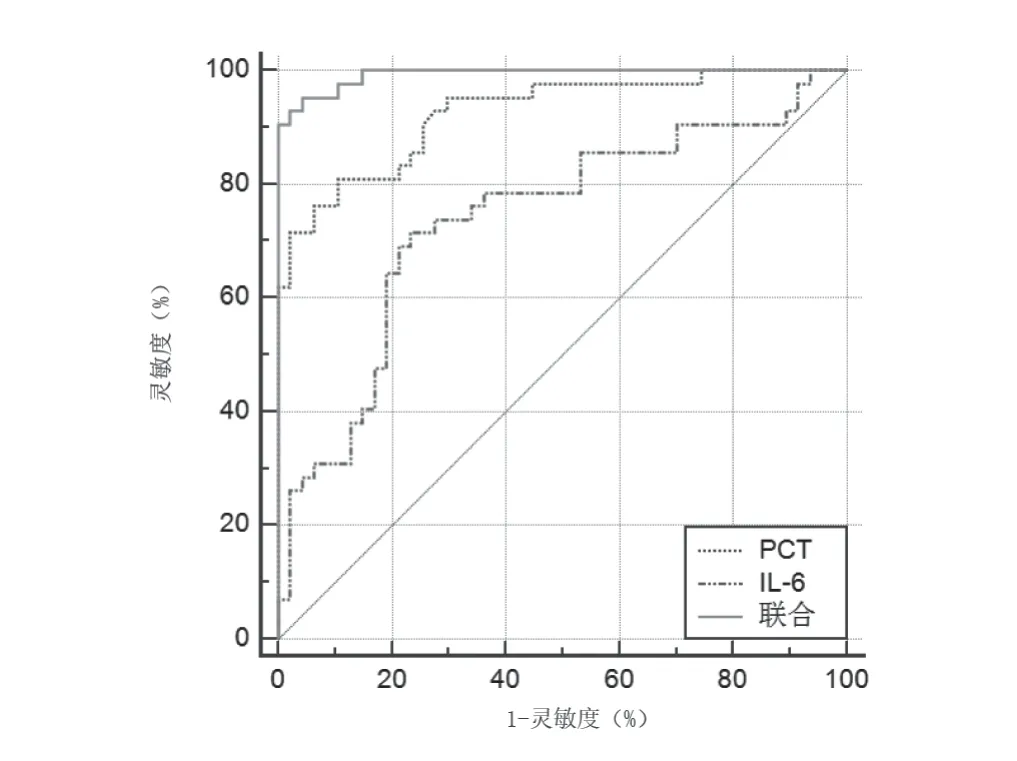
图1 PCT联合IL-6鉴别诊断细菌性血流感染ROC曲线图
3 讨论
血流感染是病原微生物(包括真菌、细菌在内)入侵血流所致全身性炎症反应综合征,菌血症、败血症、脓毒血症、全身炎症反应综合征均包括在内[7]。细菌性血流感染为疾病主要类型,机体免疫功能低下、侵入性操作等因素的影响,可增加致病菌入侵风险;在宿主血液内大量生长繁殖,并释放毒性代谢产物,导致全身性感染疾病。疾病发生后进展迅速,可使得多种组织系统受累,引起炎症损伤,甚至发展为感染性休克和多脏器功能衰竭等,对患者生命安全构成威胁[8]。现阶段,导管等医疗器械使用范围不断扩大、抗生素也在感染性疾病的治疗中被广泛应用,细菌性感染发生率明显上升;需注重疾病鉴别诊断,及时采取干预措施,以控制疾病发展进程,减少不良预后的发生。
研究发现,细菌感染发生发展与炎症因子水平有相关性。血清指标检测操作简便,方便快捷,可重复进行。机体处于炎症状态时,可改变炎症因子水平,可对相关指标水平进行检测,以判定患者有无感染情况,鉴别感染类型[9]。PCT为糖蛋白,由甲状腺C细胞分泌而来,其组成部分包括116个氨基酸,属于降钙素前肽物,细菌、真菌、寄生虫感染、脓毒症和多脏器功能衰竭等感染性病变均可导致其水平明显上升,不受病毒感染、自身免疫状态和过敏反应的影响[10]。此外,细菌感染局限性存在时或慢性炎症反应基本不影响其水平。该指标可准确反映全身炎症状态,被感染器官类型、大小、致病菌类型、炎症反应程度和宿主免疫状态均对其水平有影响。它是诊断与鉴别细菌炎性疾病感染的重要参数之一,可准确区分细菌性和非细菌性炎症反应,也可判定疾病严重性,评估治疗效果,预测疾病预后[11]。机体状态正常时,PCT水平极低(<0.05 ng/mL),在致病菌诱导下,2~4 h后其水平开始增加,6~8 h后迅速上升,12~48 h其浓度达到峰值;对症干预2~3 d后,可逐渐降至正常水平。细菌内毒素、肿瘤坏死因子-α等因素作用于神经内分泌细胞,可有PCT释放;其为次级炎症因子,并非脓毒血症直接参与者,但可加重病情,推动疾病发展。IL-6为趋化因子家族成员,由多种细胞产生,并在多种细胞上发挥作用;与血细胞生长因子联合,可有协调作用,可调节机体免疫状态;另外,它也在信息传递、免疫细胞调节、T细胞与B细胞活化、增殖分化和炎症反应中发挥作用。该细胞由Th2辅助细胞、单核巨噬细胞、成纤维细胞、血管内皮细胞产生,生物效应复杂;作为肝细胞刺激因子,可在感染所致急性炎症反应中诱导急性期反应蛋白合成,参与炎症反应。它是一种功能广泛的细胞因子,是炎症反应过程的重要参与者。细菌性血流感染发生后,IL-6首先生成,在此基础上诱导PCT产生,与炎症反应程度密切相关[12]。
上述对比显示,观察组PCT、IL-6水平更高,且患者病情越严重,血清因子水平越高;可见细菌性血流感染可导致机体大量释放炎症因子,使得PCT、IL-6水平在短时间内迅速上升,疾病严重程度增加,血清指标水平随之上升,既可用于疾病鉴别诊断,也可判定疾病严重性。
细菌主要分为革兰阳性菌和革兰阴性菌两类,前者可产生外毒素,对青霉素敏感,后者可产生内毒素,对链霉素、氯霉素敏感。微生物和毒素是导致血流感染后炎症级联反应的重要物质,脓毒症休克患者血液内毒素含量高,可导致全身炎症反应。本研究对比显示,两组IL-6水平差异无统计学意义(P>0.05),革兰阴性菌感染患者PCT水平更高(P<0.05);可见PCT可用于鉴别诊断革兰阳性菌和革兰阴性菌血流感染,主要因为革兰阴性菌壁上存在脂多糖,生物学效应广泛,为内毒素主要致病因素,可引发全身炎症反应,与凌利芬等[13]的研究结论一致。进一步对比显示,PCT联合IL-6鉴别诊断革兰阳性菌和革兰阴性菌血流感染的灵敏度和特异度最佳;主要是因为仅用PCT或IL-6鉴别诊断疾病,仅可反映细菌性血流感染某一方面的特征,获取的信息较为片面,联合检测方式可克服这一不足,获得更为丰富的信息,可全面评估疾病性质,实现疾病的准确诊断。文章中体现了《血流感染实验诊断与临床诊治》[14]中的临床参考或执行标准。
综上所述,PCT与IL-6可用于诊断细菌性感染,评估其严重程度,联合检测可区分细菌性感染类型,具有临床应用价值。

