补肾生血药对顺铂损伤的小鼠骨髓间充质干细胞的影响
巫 蓉 赵汗青 王文娟
(首都医科大学中医药学院/中医络病研究北京市重点实验室,北京,100069)
据国际癌症研究所的统计,世界范围内各种癌症将从2012年的1 400万人增加到2025年的1 900万人,到2035年预计将达到2 400万人,而近几年癌症在中国是主要致死原因,且新增病例数最多[1-2]。化疗在杀死肿瘤细胞的同时也会造成人体正常细胞的损伤。一般来说,损伤DNA的化疗引发骨髓抑制的作用最强,而损伤RNA的化疗次之,影响蛋白合成者最小[3-6]。化疗导致造血干细胞活性下降,表现为以白细胞下降为主的外周血全血细胞减少。
骨髓抑制的中医病机不外乎脾肾两虚、气血不足、瘀血搏结。若邪毒伤肾,肾精亏损,精不养髓,髓不化血则可致血液亏少[7]。临床研究显示骨髓抑制从肾论治,以扶正作为治疗大法,具有很好的疗效[8]。实验研究证实,补肾中药可以改善外周血象,促进骨髓造血干/祖细胞增殖分化,减少骨髓细胞凋亡,促进造血生长因子及其调控基因表达,改善骨髓造血微环境等[9-11]。
为进一步探讨补肾中药对骨髓造血支持细胞的影响,本研究采用顺铂致小鼠骨髓间充质干细胞(Bone Marrow Stem Cell,BMSC)损伤为实验模型,以补肾生血药进行干预,通过检测细胞凋亡率、细胞周期、造血调控因子含量,明确补肾生血药对化疗后BMSC的影响,为临床“从肾论治”化疗后骨髓抑制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 无特定病原体(Specific Pathogen Free,SPF)级(250±20)g雄性SD大鼠50只[许可证号SCXK(京)2016-0011],SPF级(20±2)g雄性BALB/c小鼠8只[许可证号:SCXK(京)2016-0006],由北京维通利华实验动物技术有限公司提供,饲养于首都医科大学实验动物中心国家标准实验室。所有动物实验均经首都医科大学动物伦理委员会批准(伦理审批号:AEEI-2018-054)。
1.1.2 药物 补肾生血药[北京康仁堂药业有限公司,各中药(批号):熟地黄(18002151),炒山药(18007841),枸杞子(18008012),山茱萸(17025331),川牛膝(18001591),菟丝子(18007002),鹿角胶(17025581),龟甲(18007921),生黄芪(18005751),当归(18003261)];顺铂(美国APExBIO,美国,批号:A8321)。
1.1.3 试剂与仪器 Cell Counting Kit-8试剂盒(日本同仁,批号:FH783);AnnexinV-FITC/PI细胞凋亡检测试剂盒,细胞周期检测试剂盒(江苏凯基生物技术股份有限公司,批号:20180416);小鼠肿瘤坏死因子-α(Tumor Necrosis Factor-α)、转化生长因子-β(Transforming Growth Factor-β,TGF-β)、γ干扰素(Interferon-γ,IFN-γ)、干细胞因子(Stem Cell Factor,SCF)、白细胞介素-3(Interleukin-3,IL-3)、粒细胞巨噬细胞集落刺激因子(Granulocyte Macrophage Colony-stimulating Factor,GM-CSF);酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)检测试剂盒(北京金海科隅生物科技发展有限公司,批号:20190901);流式细胞仪(BD公司,美国,型号:BD LSRFortessa定制型);酶标仪(上海科华生物工程股份有限公司,型号:ST-360)。
1.2 方法
1.2.1 分组与模型制备 大鼠含药血清的制备:将SD大鼠随机分为2组:空白对照组、补肾生血药组,每组25只。空白对照组每日按1 mL/100 g质量给予蒸馏水,补肾生血药组每日按1 mL/100 g质量给予相应药液,连续5天。于第5天给药1~2 h内由腹主动脉取血。室温静置2 h后,离心半径10 cm,1 000 r/min,4 ℃离心20 min,收集血清,同组混匀,56 ℃水浴灭活30 min,经0.22 μm滤膜抽滤除菌,2 mL冻存管分装,-80 ℃保存。
BMSC原代培养与分组:将小鼠用CO2麻醉后处死,浸泡于乙醇中。用剪刀剪开小鼠背部,将小鼠双下肢皮肉分离取出,浸泡于生理盐水中,移入细胞间。用剪刀和镊子分离肌肉和股骨、胫骨,将骨置于5 mL含20%胎牛血清的α最小基本培养基(Alpha Minimum Essential Medium,αMEM)完全培养基中,剪开骨两端暴露骨髓腔,用1 mL针管吸取培养基反复冲洗骨髓腔至骨髓发白。吹打细胞混匀,制成骨髓细胞悬液。放入培养箱培养48 h后半弃液,加入2 mL含10%胎牛血清的αMEM完全培养基中培养,2~3 d换液1次,至第7天细胞密度达到80%左右传代。3~5 d传代1次,传至第3~4代时冻存部分细胞,其余细胞用于开展后续实验。
1.2.2 给药方法 取处于对数生长期的BMSC,调整细胞密度,将细胞按106/mL浓度接种至6孔板,各孔均加入等量αMEM完全培养基(含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素)培养2 d至贴壁,吸除培养液,用磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)清洗各孔。施加各干预措施,于37 ℃、5% CO2、饱和湿度条件下培养48 h后收获细胞。
1.2.3 CCK-8检测顺铂、补肾生血血清对细胞增殖活性的影响 取对数生长期BMSC,调整细胞浓度为5×105,按每孔100 μL接种于96孔板中。分别加入25 μmol/L、50 μmol/L、75 μmol/L、100 μmol/L顺铂培养液,0%、2.5%、5.0%、7.5%、10.0%补肾生血血清,同时设置空白对照组,每组3个复孔,于37 ℃、5%CO2、饱和湿度条件下培养箱中培养48 h,向每孔加入10 μLCCK-8溶液,于培养箱中孵育2 h,酶标仪450 nm波长处测定OD值。
1.2.4 流式细胞仪检测骨髓细胞周期和细胞凋亡率 取对数生长期的BMSC,调整细胞密度为5×105,将细胞按2 mL/孔接种于6孔板中进行分组及干预。干预48 h后,冲洗消化成细胞悬液,离心半径10 cm,1 000 r/min,离心5 min去上清液。用Cell Staining Buffer清洗2次,再用PBS缓冲液清洗后离心去上清。加入1 mL Cell Staining Buffer重悬细胞,尼龙布滤膜过滤移至流式管中,于流式细胞仪上检测细胞周期。
同样方法收集细胞后加入500 μL Binding Buffer混匀,加入5 μL Annexin V-FITC混匀,再加入5 μL碘化丙啶染色(Propidium Iodide,PI)混匀,室温避光反应5~15 min后于流式细胞仪上检测细胞凋亡率。
1.2.5 培养液中造血调控因子含量检测 细胞培养后接种至孔板,每孔2 mL,空白组用培养基1.8 mL加空白血清0.2 mL,模型组用顺铂培养基1.8 mL加空白血清0.2 mL,补肾生血组用顺铂培养基1.8 mL加补肾生血血清0.2 mL。各组细胞按上述方法培养48 h后收集细胞,离心半径10 cm,1 000 r/min,离心5 min收集上清液。酶联免疫吸附试验试剂盒分别检测上清液中TNF-α、TGF-β、IFN-γ、SCF、IL-3、GM-CSF含量。

2 结果
2.1 不同浓度顺铂作用和不同浓度补肾生血血清作用48 h的OD值及细胞增殖率 作用48 h后,25 μmol/L顺铂能抑制BMSC的细胞增殖活性(P>0.05),50 μmol/L、75 μmol/L、100 μmol/L顺铂能显著抑制BMSC的细胞增殖活性(均P<0.001)。见图1。其中顺铂浓度为50 μmol/L时细胞增殖率降至50%~60%,因此将顺铂的用药浓度定为50 μmol/L。

图1 不同浓度顺铂作用48 h的OD值及细胞增殖率
作用48 h后,5%和10%补肾生血血清能明显增加细胞增殖活性(均P<0.01),7.5%补肾生血血清能显著增加细胞增殖活性(P<0.001)。见图2。因此,将补肾生血血清的用药浓度定为7.5%。

图2 不同浓度补肾生血血清作用48 h的OD值及细胞增殖率
2.2 各组TNF-α、TGF-β、IFN-γ、SCF、IL-3、GM-CSF含量比较 与空白对照组比较,模型对照组TNF-α、TGF-β、IFN-γ含量均显著升高(均P<0.05),SCF、IL-3、GM-CSF含量均显著降低(均P<0.05);与模型对照组比较,补肾生血血清组TNF-α、TGF-β、IFN-γ含量均显著降低(均P<0.05),IL-3含量明显升高(P<0.01)。见图3。

图3 细胞培养液中TNF-α、TGF-β、IFN-γ、SCF、IL-3、GM-CSF含量
2.3 流式细胞仪检测细胞凋亡率和细胞周期 与空白对照组比较,模型对照组各期细胞比例无明显变化(均P>0.05);与空白对照组、模型对照组比较,补肾生血血清组处于G1期的细胞比例显著降低(均P<0.05),处于增殖期的细胞比例显著增加(均P<0.05);补肾生血血清组较空白对照组处于S期的细胞比例显著增加(P<0.05)。见图4。

图4 各组流式细胞周期
顺铂作用48 h后,细胞凋亡率明显升高(P<0.01),补肾生血血清组骨髓细胞凋亡率明显降低(P<0.001)。见图5。
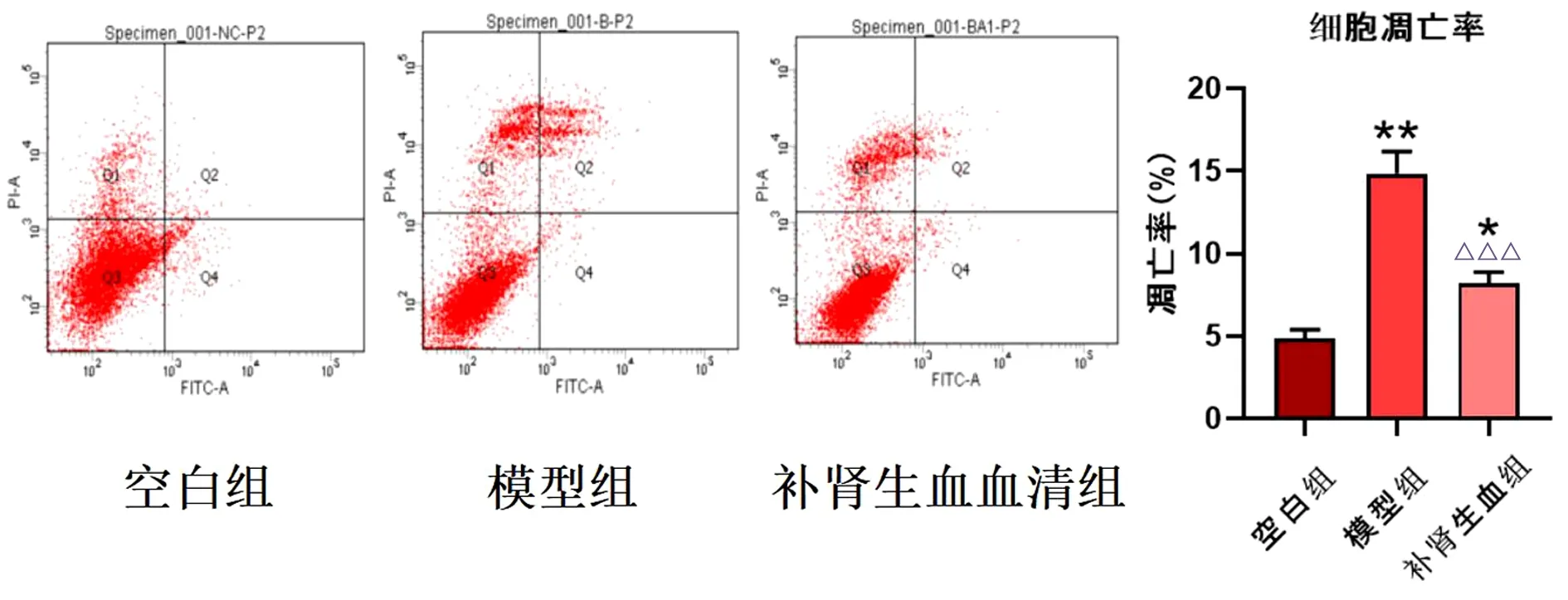
图5 各组流式细胞凋亡率(%)
3 讨论
补肾生血药由当归补血汤与左归丸组成。当归补血汤出自“金元四大家”之一李杲的《内外伤辨惑论》,为补益气血的代表方,功用在于补气生血,当归专能补血,阴中之阴,配合补益肺脾之气的黄芪,气旺则助血化生。黄芪用量5倍于当归,一则血虚阳浮,气不足则难以固里,阳气外亡,故而重用黄芪补气而专固肌表;再者有形之血不能速生,并生于无形之气,补气即为生血,气血相生,虚热自退,即《黄帝内经》所谓“阳生阴长”。左归丸见于《景岳全书》卷五十一,原文记载由熟地黄、山药、山茱萸、枸杞子、鹿角胶、龟甲胶、川牛膝、菟丝子组成。主要功用在于滋阴补肾,填精益髓。针对真阴不足证,重用熟地黄为君,大补真阴;山药之补脾,山茱萸之补肝,补肝阴以助肾阴,化生肝血,兼有通利之性,流通血脉之功;合以补肾精之枸杞子,协助峻补精髓,督任之元,配合血肉有情之品侧重补肾阳的鹿角胶和侧重补肾阴的龟甲胶。全方在补阴之中配伍补阳药,取“阳中求阴”之义。以上山药、山茱萸、枸杞子、鹿角胶和龟甲均为臣药,后加有补肾中之气的菟丝子,以及补血益肝肾、强腰膝、健筋骨的川牛膝,二者为佐药,进一步加强补肾益精的功效。方名虽曰左归,由方解可见实为三阴并补,水火交济之方,尤以滋补肾阴为主。
现代药理研究表明,当归补血汤中已知成分如当归多糖、阿魏酸、黄芪多糖、黄芪异黄酮和黄芪皂苷均直接或间接参与了血细胞的生成,能够多环节来促进实验动物造血细胞增殖分化;还一定程度提高化疗后患者的免疫力,最终改善患者的骨髓抑制[12]。现代临床研究显示:左归丸常用于治疗再生障碍性贫血及肿瘤放化疗反应,能明显升高肿瘤放化疗患者外周血白细胞数[13]。
造血因子分为造血生长因子、造血抑制因子。常见造血生长因子包括SCF、IL-3、GM-CSF等。研究报道,化疗可影响骨髓造血微环境,抑制SCF、IL-3、GM-CSF等造血生长因子分泌,从而抑制造血细胞增殖、分化[14],SCF所作用的靶细胞是极早期的、具有多向分化潜能的造血干细胞,促使这类细胞由静止的、休眠状态进入细胞周期或加快细胞周期的进程[15]。IL-3主要作用于早、中期造血祖细胞的增殖和分化,可刺激多种骨髓细胞生长和分化[16]。GM-CSF与GM-CSF受体结合后促进多种造血细胞增殖分化。GM-CSF主要起到维持粒-单系细胞的存活,促进生长和诱导分化的作用[17]。常见造血抑制因子包括TNF-α、IFN-γ、TGF-β等。作为造血抑制因子之一的TNF家族,主要有TNF-α和TNF-β,二者对干细胞和祖细胞的作用在不同的集落刺激因子刺激下各不相同[18]。TNF-α信号转导在调节成人造血功能方面也有报道[19]。IFN-γ是免疫介导的负性造血调控因子,其可抑制正常骨髓细胞分化、增殖,对造血干细胞生长也具有抑制作用[20]。体外实验研究发现,骨髓中的IFN-γ还可抑制人和鼠骨髓长期培养的原始细胞活性[21]。
本实验采用顺铂损伤的小鼠BMSC为模型,以补肾生血药进行干预,观察补肾生血血清对BMSC凋亡、细胞周期及造血调控因子的影响。干预48 h后BMSC凋亡率明显增高(P<0.01),SCF、IL-3、GM-CSF含量均显著降低(均P<0.05),TNF-α、TGF-β、IFN-γ显著升高(均P<0.05)。该结果与文献[22-23]报道相似,提示化疗可造成骨髓细胞凋亡,造血微环境受到一定的破坏。
根据中医“肾精化血”“肾生髓,髓养血”理论,结合骨髓抑制的临床表现,本课题组认为化疗后骨髓抑制的基本病机为“肾虚髓损、精血亏虚”,因此除健脾养血、补气生血等常规治疗外,还应重视从肾论治[24-25]。本研究结果显示,补肾生血血清组骨髓细胞凋亡率明显降低,G1期细胞比例显著降低,增殖期细胞比例显著增加,IL-3含量明显升高,TNF-α、TGF-β、IFN-γ含量显著降低。发现补肾生血血清可减轻化疗造成的骨髓细胞凋亡,促进细胞增殖,能促进造血生长因子分泌,并减少造血抑制因子分泌,提示补肾生血药对改善化疗后骨髓抑制具有一定的作用。但由于化疗药的不同,以及造血环境的复杂性,可能不同的化疗药对于造血因子有不同的调控作用,具体情况有待进一步研究。此外,由于补肾生血血清的成分较复杂,今后还需要进一步开展血清药理实验,以明确是补肾生血药发挥的药效作用,还是与血清的协同作用。
利益冲突声明:无。

