以发热、胸痛为首发表现的系统性红斑狼疮一例
许慧莹 李月红
患者,女,41岁,因“间断胸痛伴发热1月余”于2018年9月20日至我院就诊。患者1个月前无明显诱因出现心前区和前胸部闷痛、向双肩放射,伴寒战、高热(体温38 ℃~39 ℃,午后为主),伴双腕、掌指关节、膝、踝、掌趾关节痛,无咯血、盗汗、咳嗽、皮疹、出血,自服非甾体类抗炎药物后稍缓解。于本院查胸部CT示右肺中叶炎症伴双侧胸腔积液、纵隔多发淋巴结肿大(图1);支气管镜示右中叶、右下叶背段和基底段支气管黏膜略充血和水肿、黏膜下点片状出血灶。先后予多种抗生素治疗近1个月无好转,1周前出现四肢皮肤紫癜、牙龈和口腔黏膜出血。既往史:室间隔缺损修补术后35年,无传染性疾病接触史和疫区居住史。体格检查:T 38.2 ℃,P 98次/min,R 20次/min,BP 170/90 mmHg。神志清楚,颈部和双侧腋窝可触及肿大淋巴结,双肺呼吸音粗,双下肺可闻及湿啰音,心律齐,各瓣膜听诊区未闻及病理性杂音,腹软,肝脾肋下未触及,双下肢轻度凹陷性水肿,余无异常。实验室检查:血红蛋白87g/L(115~150g/L,括号内为正常参考值范围,以下相同),PLT 34.0×109/L(125.0~350.0×109/L),C反应蛋白(CRP)162mg/L(0~8mg/L),红细胞沉降率(ESR)99mm/h(0~20mm/h);凝血酶原时间15.6s(10.0~13.0s)、活化部分凝血活酶时间42.7s(23.3~32.5s);WBC计数、降钙素原(PCT)、肾功能、心肌损伤标记物、及外周血涂片均无异常。尿常规:蛋白+,白细胞阴性,红细胞+++,正常红细胞百分比为25%;24 h尿蛋白定量为694.2 mg(0~140.0 mg);呼吸道病毒、结核杆菌DNA、结核杆菌γ干扰素、1,3-β-D-葡聚糖试验、半乳甘露聚糖试验、血培养、EB病毒IgM抗体(EB-IgM)、巨细胞病毒IgM抗体(CMV-IgM)、支气管肺泡灌洗液培养均为阴性;血尿免疫固定电泳结果示多克隆免疫球蛋白增高;抗核抗体(ANA) 1∶1 280(均质型),抗双链(ds)DNA 1∶80;抗Sm抗体、抗可溶性核糖核蛋白(URNP)抗体、抗SSA、SSB抗体均为阳性;抗心磷脂抗体(ACL)为15.1 MPLU/ml(<8 MPLU/ml),抗β2糖蛋白1(β2-GP1)抗体为5.03 AU/ml(<4 AU/ml),C3 0.76 g/L(0.9~1.8 g/L);抗人球蛋白试验+++,冷球蛋白+;C4、抗中性粒细胞胞浆(ANCA)抗体、抗肾小球基底膜(GBM)抗体、肿瘤标记物检测结果均正常。超声检查示颈部、双侧腋窝多发肿大淋巴结;心电图检测结果无异常,超声心动图检查示肺动脉收缩压增高。患者转入肾内科进一步治疗,确定诊断:系统性红斑狼疮(SLE)、抗磷脂抗体综合征、继发干燥综合征、冷球蛋白血症、狼疮肾炎、狼疮肺炎、狼疮胸膜炎、肺动脉高压。予甲泼尼龙、丙种球蛋白治疗后患者体温、血红蛋白和PLT水平均恢复正常,复查胸部CT可见肺部炎症较前吸收、纵隔淋巴结较前减小、双侧胸腔积液减少。后加用环磷酰胺联合甲泼尼龙治疗后尿蛋白、潜血均转阴,肝肾功能正常,遂出院。
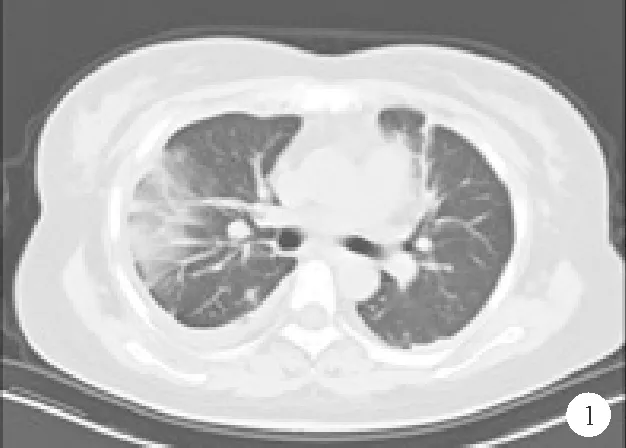
图1 2018年9月27日患者肺部CT检查结果
讨 论
SLE是自身免疫性疾病,可累及多个器官系统。SLE患者发热需警惕狼疮活动、合并感染和肿瘤等可能。本例患者WBC计数正常,多次血培养和肺泡灌洗液细菌培养、PCT、血清和支气管肺泡灌洗液G试验、GM试验和真菌培养、呼吸道病毒、CMV病毒、EB病毒、结核杆菌、支原体、衣原体等均为阴性,超声心动图和CT检查均未发现感染性病灶,曾先后应用大量广谱抗生素无明显改善,无传染性疾病接触史和疫区居住史,无咯血、盗汗、咳嗽、皮疹、出血等表现,感染性疾病证据不足。
非感染性疾病引起发热,病因主要包括结缔组织病、肿瘤、血液系统疾病、药物热和甲状腺功能亢进症等,年轻女性结缔组织病所占比例最高[1]。本例患者临床表现为发热、关节痛、血尿和蛋白尿、贫血和PLT减少等,查ANA 1∶1280(均质型),抗dsDNA 1∶80,抗Sm抗体、抗URNP抗体、抗SSA、SSB抗体均为阳性,考虑SLE处于活动期。其ESR明显升高,而SLE活动、贫血和高球蛋白血症均可引起ESR加快[2]。SLE活动所致发热主要为体内单核-巨噬细胞系统激活释放致热源引起,多表现为夜间体温升高,热型有弛张热、不规则热、间歇热等,多伴有浆膜炎、淋巴结肿大、肝脾肿大和肝功能异常等[3]。本例患者表现为不规则发热,伴有多浆膜腔积液、淋巴结肿大,多次查PCT均为阴性,考虑狼疮活动导致发热。
SLE可累及肺部和胸膜,尤其是肺血管,主要表现为胸膜炎、狼疮肺炎、间质性肺病、弥漫性肺泡出血、肺栓塞和肺动脉高压[4-5]。35%SLE患者出现胸膜炎,胸腔积液多为双侧,大量胸腔积液少见。急性狼疮肺炎可表现为发热、胸痛和呼吸道症状,CT检查可见肺实变、毛玻璃影和胸腔积液等[6]。本例患者主要表现为胸腔积液和肺部浸润影,采用甲泼尼龙和环磷酰胺治疗后胸腔积液减少、肺部病变吸收,符合SLE呼吸系统受累表现。SLE合并肺动脉高压的发生率为0.5%~17.0%,亚洲人群发生率约为4.2%~6.2%[7],发病机制主要包括肺血管收缩、缺氧和血管重塑。合并肺动脉高压的SLE患者多为女性,平均年龄45岁,肺动脉收缩压范围在40 ~60 mmHg[8]。研究发现雷诺现象、抗磷脂抗体、浆膜炎、狼疮肾炎是SLE患者发生肺动脉高压的危险因素[9]。合并肺动脉高压患者的预后较差,研究显示其1年、3年和5年生存率分别为83.7%、79.0%和60.2%[10]。糖尿病、胸腔积液、B型钠尿肽(BNP)升高、肺动脉压升高、PLT减少和妊娠均会降低SLE合并肺动脉高压患者的生存率。
约30%~40%SLE患者会出现ACL抗体阳性,Ünlü等[11]研究结果显示在抗磷脂抗体综合征患者中,狼疮抗凝物(LA)和抗心磷脂抗体(ACL)-IgG阳性者出现肺动脉高压的风险明显升高,而ACL-IgM和抗β2-GP1抗体阳性者与肺动脉高压的发生无明显相关性。Bernardoff等[12]研究显示合并抗磷脂综合征的SLE患者,PLT减少症和溶血性贫血的发生率升高2~4倍,以LA阳性和抗β2-GP1抗体阳性者风险最高。抗磷脂综合征肾活检病理可表现为肾脏小血管微血栓形成、管腔狭窄、纤维性内膜增生、动脉阻塞和局灶性皮质萎缩等[13]。
SLE合并干燥综合征发生率约9%~19%,50%患者会出现蛋白尿,肾病综合征范围蛋白尿少见[14]。SLE合并干燥综合征患者中SSA和SSB阳性率分别为70%和40%,而单SLE患者中SSA60抗体的阳性率约为30%[15]。研究结果显示SSA抗体多与狼疮患者口干、眼干症状及浆膜炎相关,肾脏受累患者更易出现血尿。本例患者SSA、SSB抗体均为阳性,且有多浆膜腔积液表现,肾脏受累以血尿为主、蛋白尿少见,符合上述特点。
综上,SLE患者合并抗磷脂综合征、继发性干燥综合征、冷球蛋白血症、狼疮肺炎、狼疮胸膜炎、肺动脉高压和肾脏损伤,以高热、肺部受损起病,抗生素治疗无效,考虑为肺部病变为主要表现的狼疮活动,经糖皮质激素和免疫抑制剂治疗后好转。可见SLE活动病情复杂多变,需临床综合分析评判。

