JAK2 V617F及exon12突变阴性的红细胞增多患者遗传性红细胞增多症相关基因变异分析
马强 胡蓉华 赵弘 兰晓曦 常晓丽 孙婉玲 苏力 惠吴函
红细胞增多症相对少见,主要表现为外周血血红蛋白(Hb)/红细胞压积(HCT)增高[1],分为原发性和继发性两类,获得或遗传性因素均可导致红细胞增多[2]。原发性红细胞增多以真性红细胞增多症(PV)最为常见,95%以上PV患者可检测到JAK2 V617F或exon12驱动突变,因此伴JAK2突变的红细胞增多症患者诊断为PV相对更容易[2]。然而,对于JAK2未突变的红细胞增多症患者,如何进行精准诊疗却是临床面临的重要挑战。尽管临床已开展促红细胞生成素(EPO)水平和Hb饱和度为50%时的氧分压(P50)测定,但有研究结果发现,EPO和P50检测有时并不能从根本上识别红细胞增多的原因[3]。对于这类患者,在临床实践过程中首先要除外可能造成继发性红细胞增多症的常见原因,如缺氧、可导致EPO过度生成的恶性肿瘤等[4];其次,要除外驱动基因突变阴性的PV[3];最后,要考虑罕见的先天性/遗传性红细胞增多症可能,如EPOR基因突变或与EPO生成相关的多种基因变异所致的红细胞增多等[5]。特别是,对于JAK2 V617F和exon12突变阴性的持续性红细胞增多的年轻患者或有家族史患者或原因不明患者,更推荐通过基因测序检测遗传性红细胞增多症相关基因以寻找红细胞增多原因[3]。本研究回顾性收集了31例JAK2 V617F及exon12突变阴性的红细胞增多症患者,通过基因测序方法分析遗传性红细胞增多症相关基因变异情况。
对象与方法
1.对象:纳入2021年6月~2022年11月于我院就诊、JAK2 V617F及exon12突变筛查结果为阴性且无继发性红细胞增多原因的红细胞增多症患者31例,其中男30例、女1例,年龄24~71岁,平均年龄(48.03±12.91)岁。纳入标准:(1)参照WHO 2016版红细胞增多症诊断标准,Hb>165 g/L(男)/160 g/L(女)或HCT>49%(男)/48%(女);(2)JAK2 V167F及exon12突变检测结果均为阴性。排除标准:(1)已明确诊断为PV;(2)具有其他继发获得性红细胞增多原因。本研究已通过我院伦理委员会审核批准。
2.方法:
(1)一般资料及实验室检查结果收集:包括年龄、性别、首诊日期、红细胞计数、Hb、HCT。
(2)DNA提取、扩增与Sanger测序:使用EDTA抗凝管采集患者外周静脉血,参照全血基因组DNA提取试剂盒说明书对EDTA抗凝血进行基因组DNA提取,Qubit 3.0用于提取后DNA浓度测定。高成功率PCR酶KOD FX(Code No.KFX-101)及T100TMThermal Cycler PCR仪(BIO-RAD)用于目的片段扩增,扩增产物经纯化后,使用Applied BiosystemsTM3730xl DNA分析仪进行测序。9个基因包括HIF2A、VHL、EPO、EPOR、PHD2、BPGM、HBB、HBA1/HBA2和SH2B3。
(3)变异识别与分析:应用Geneious软件将测序结果与基因组参考序列进行比对,识别变异。采用PolyPhen-2[6]、Mutation Assessor、FATHMM、Mutation Taster及SIFT等软件预测非同义突变的有害性。采用Exom Aggregation Consortium(ExAC)、1000 Genomes Project、dbSNP及ClinVar等数据库分析变异在人群中分布频率及临床意义。
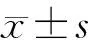
结 果
1.患者血常规结果及基因检测信息:31例患者血常规中WBC计数及PLT计数大致正常,平均红细胞计数(6.01±0.44)×1012/L,平均HCT(54.26±3.87)%。20例患者接受全部9个基因检测,11例患者接受5个基因检测(VHL、EPO、HIF2A、PHD2、EPOR)。见表1。
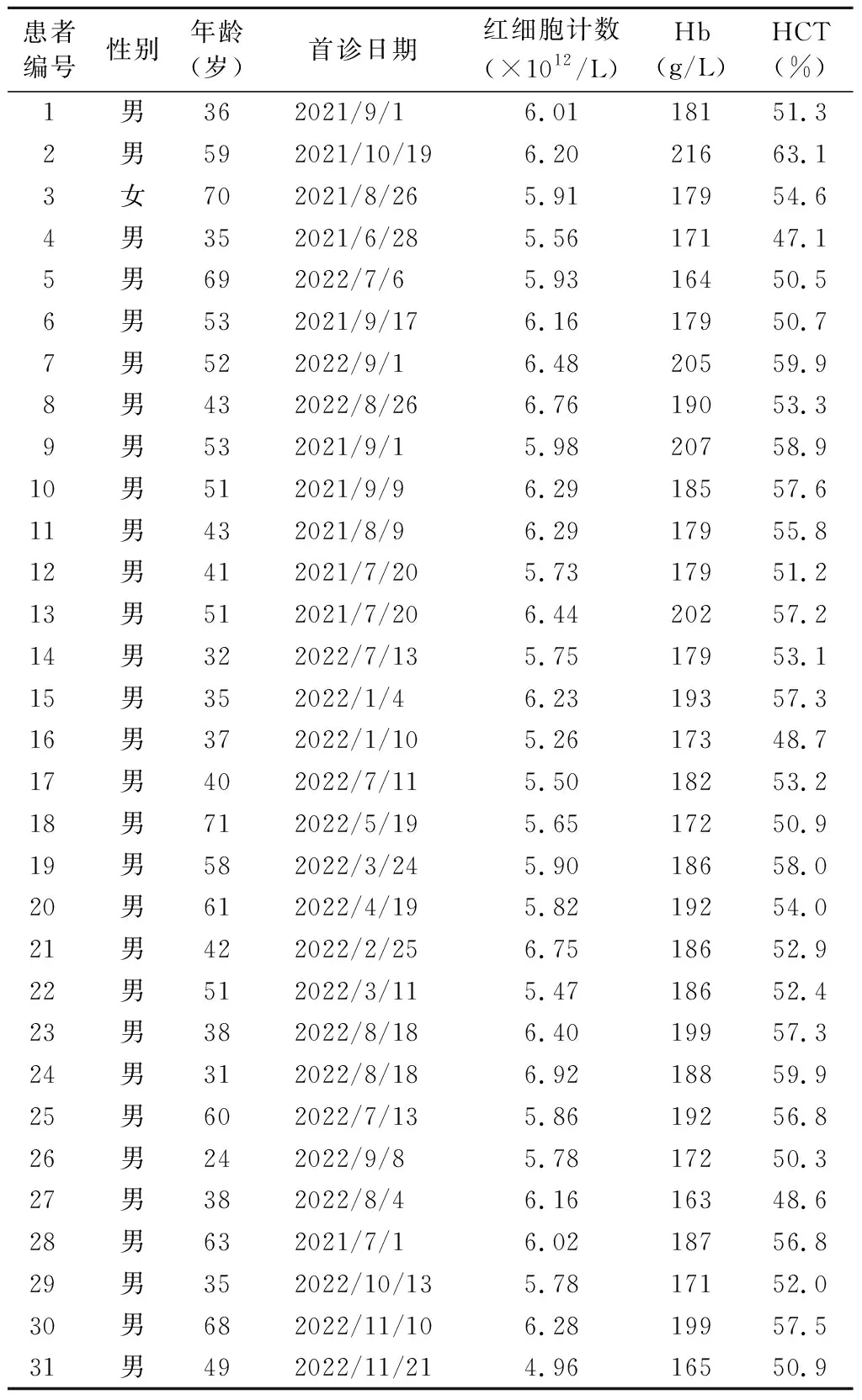
表1 31例患者基本信息及血常规部分结果
2.2例基因变异患者资料:通过与基因组参考序列比对,过滤同义突变及SNP位点后,2例患者检测到EPO基因变异,分别为NM_000799.4:c.401C>T p.Thr134Ile和NM_000799.4:c.-36C>A,相关临床信息如下:(1)编号6患者,男,53岁,自诉2017年9月发现红细胞增多,波动于175 g/L左右,其母亲患有红细胞增多症。2021年9月于我院门诊行红细胞增多症相关基因检测(5个基因),结果示患者携带NM_000799.4:c.401C>T p.Thr134Ile变异(杂合,图1)。该变异经SIFT软件预测提示Damaging,但Mutation Assessor软件预测提示Neutral,PolyPhen-2软件预测提示Benign,Mutation Taster软件预测提示Polymorphism,FATHMM软件预测提示Tolerated。人群数据库中该位点未被收录。患者2022年1月于外院再次复查血常规示红细胞计数 6.16×1012/L,Hb 179 g/L,HCT50.7%。(2)编号5患者,男,69岁,2019年7月发现红细胞增多,波动于175 g/L左右,2022年7月于我院门诊就诊,就诊时红细胞计数5.93×1012/L,Hb 164 g/L,HCT 50.50%,EPO 5.70 IU/L;其子也确诊为红细胞增多症。患者行红细胞增多症相关基因检测(9个基因),结果示其携带NM_000799.4:c.-36C>A变异(杂合,图2);2022年8月再次复查血常规示红细胞计数6.08×1012/L,Hb 170 g/L,HCT 49.10%。
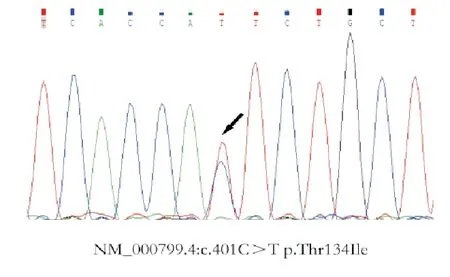
图1 编号6患者EPO基因测序结果(箭头所示位置发生碱基替换)
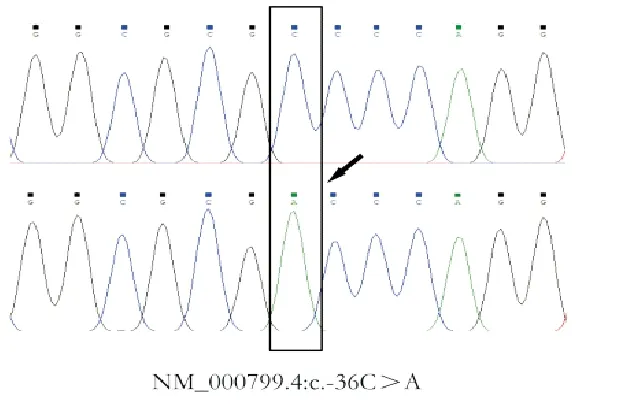
图2 编号5患者EPO基因TA克隆测序结果(上图为野生型克隆,下图为突变型克隆,如箭头所示)
3.患者基因SNP情况分析:在所有受检患者中,检测到PHD2和SH2B3基因共4个SNP位点,见表2。按发生率由高至低依次为SH2B3基因rs3184504、rs78894077、PHD2基因rs186996510及SH2B3基因rs140649197。使用Geneious软件比对6例患者测序结果与参考序列间差异,其SH2B3基因rs78894077变异峰图见图3。通过检索人群数据库发现,SH2B3基因rs78894077主要见于东亚人群,在其他种族中该基因变异发生率极低,但在本研究人群中该基因变异发生率(30%,6/20)显著高于1000 Genomes中东亚人群(6.35%)、ExAC中亚洲人群(0.10%)及gnomAD-Genomes中东亚人群(5.46%)。多种软件预测该变异可能有害,如Mutation Taster软件预测提示Disease causing,PolyPhen-2软件预测提示可能损害,Mutation Assessor软件预测提示Medium,但FATHMM软件预测提示Tolerated。
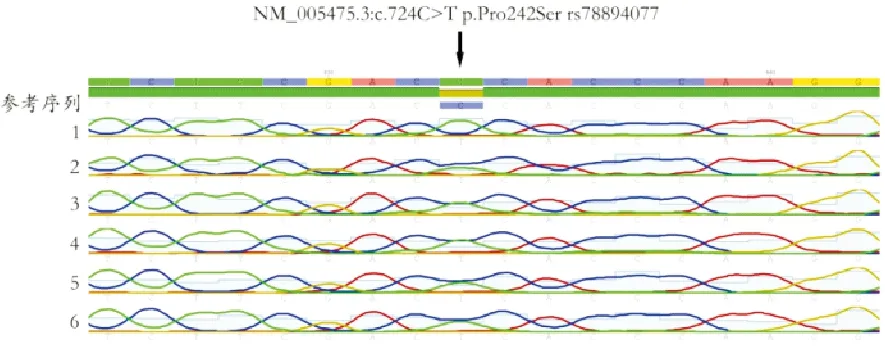
图3 6例患者SH2B3基因rs78894077变异峰图(箭头所示位置为SH2B3基因c.724C>T变异)

表2 红细胞增多症患者检测到的SNP位点及发生率
讨 论
对于初诊红细胞增多症患者,JAK2突变和EPO水平测定是目前比较推荐的一线检查方法,当JAK2突变为阴性时,有必要启动更加系统的综合检查作为二线方法。除外继发性获得性红细胞增多症,先天性红细胞增多症相关基因突变筛查就是其中最重要的一部分,这些基因通常涉及红细胞生成调节、氧感受器及Hb氧亲和力等[7]。如EPO为红细胞生成的主要刺激因子,EPO及EPOR基因突变可引起红细胞增多[8-9]。目前已报道EPOR基因有11种突变形式[10]。此外,SH2B3基因是Janus酪氨酸激酶/信号传导与转录激活因子(JAK/STAT)通路下游细胞因子信号通路的负调控因子,在遗传性红细胞增多症中已发现SH2B3突变[11]。而氧感知通路上的许多基因突变已被证明能引起遗传性红细胞增多,主要涉及希佩尔-林道-缺氧诱导因子2α-脯氨酰羟化酶2(VHL-HIF2A-PHD2)轴,这一通路的基因突变可导致缺氧诱导因子降解失败,增加EPO促进红细胞生成的作用。最早在俄罗斯发现VHL C598T纯合突变[12],此后在其他地区发现VHL外显子和剪接子的复杂突变[7]。在EGLN1(PHD2)基因上也发现了16种突变,大多为错义突变[10]。此外,HBA1/2、HBB、BPGM基因异常可通过增强Hb氧亲和能力引起组织缺氧从而导致红细胞数量增多。既往由于先天性红细胞增多症是一组罕见的异质性疾病,发生率相对较低,涉及到的基因变异范围广泛,加之相应的基因检测在临床并未普及,文献或数据库中已明确报道的具有致病性的位点仍然有限。近年来,随着二代测序的应用,已有研究发现红细胞增多症患者中,上述基因病理性变异并不少见。一项针对1 192例红细胞增多症患者遗传性红细胞增多基因的检测结果发现,12%患者存在可报告的遗传学变异,其中85个为致病性/可能致病性变异,58个是临床意义未明的变异,而其中大多数变异此前尚未报道[13]。Filser等[14]对270例红细胞增多症患者进行了EPAS、VHL、EPO、EPOR、EGLN、BPGM及SH2B3基因检测,其中23%患者存在氧感知通路基因的病理性变异。综上,探寻红细胞生成调节基因或氧感知通路或Hb氧亲和力相关基因突变对明确红细胞增多症患者的病因具有重要意义。因此,本研究采用Sanger测序方法进一步分析上述基因在31例JAK2突变阴性的红细胞增多症患者中的变异情况。
在所测基因中,我们发现两个新的EPO基因变异,1例为编码序列的错义突变,另外1例为非编码序列单核苷酸替换。EPO突变与家族性红细胞增多症研究已被陆续报道,如c.32delG变异致EPO功能获得性突变,通过影响转录导致EPO过度产生,进而促进红细胞增多[8]。此外,其他不同类型EPO基因变异也在红细胞增多症患者中被报道,包括NM_000799.2:c.-1306C>A(rs1617640)、c.-136G>A、c.19delC,p.P7fs、c.250G>C,p.G84R(rs137953994)、c.296A>G,p.E99G及rs551238等[15]。而本研究中发现的EPO c.401C>T p.Thr134Ile变异在人群数据库中尚未被收录,SIFT软件预测结果为损害,但其他多个软件预测结果为良性且ClinVar数据库暂未收录,因此该变异的临床意义尚不明确;本研究中的另1例EPO基因突变(NM_000799.4:c.-36C>A)在ClinVar数据库也未见报道。尽管上述两种变异临床意义尚不明确,但两例患者在后期随访过程中Hb/HCT仍高于正常上限,EPO水平正常,所以变异与先天性红细胞增多间的关系仍需进一步确定,也提示临床中对于高度怀疑先天性红细胞增多症患者应扩展这些基因的检测区域,对于没有检测到基因突变的患者可考虑进行全外显子测序探寻可能存在的基因变异,以进一步明确先天性红细胞增多症的病因。
SNP与疾病易感性间的关系已被广泛报道,部分疾病相关SNP可导致其所在基因及相关基因转录和蛋白表达水平发生变化,增加某些良性疾病的易感性[16],进而参与疾病的发生与发展。陈郁等[17]发现EPAS1基因SNP(rs6756667)与汉族男性高原红细胞增多症的发生相关,GG基因型可能是高原红细胞增多症的危险因素。据此,我们推测部分原因不明红细胞增多症患者也可能存在红细胞生成调节、氧感知通路基因SNP,导致患者对红细胞增多易感。在本研究中,我们检测到了PHD2基因及SH2B3基因多个SNP位点,其发生频率与数据库中人群发生频率大致相同,但SH2B3基因rs78894077引起了我们的兴趣。经数据库检索,该变异主要见于东亚人群,在其他种族中发生率极低。重要的是,在本研究中rs78894077的发生率远高于数据库中东亚人群发生率(约5~6倍)。通过文献检索发现,该基因变异曾在MPN中有报道,与ET的发生风险有关[18];本研究发现rs78894077同样可发生在部分JAK2未突变的红细胞增多症患者中,不能除外其与红细胞增多间具有潜在联系。为进一步明确该变异是否会影响蛋白质功能,我们借助多种计算机软件进行预测分析,结果多种软件测试结果均提示rs78894077变异为有害突变。因此,rs78894077与红细胞增多症之间的关系值得我们深入探索。
本研究局限性在于:(1)尚未完善家族史信息及亲属样本收集;(2)所纳入基因数量及检测位点有限,主要以热点区域突变为主,检测结果不能全面反映红细胞增多症患者的分子遗传学全貌,结果解释具有局限性;(3)样本数量有限,结论可能尚不具有普适性。
总之,本研究通过分析JAK2野生型红细胞增多症患者先天性/遗传性红细胞增多症相关的分子遗传学异常,首次报告了2个新的EPO基因突变,并发现SH2B3单核苷酸多态性rs78894077在入组患者中具有更高的发生率,这些结果可能会为原因不明的红细胞增多症的分子诊断、病因学研究及临床的精准诊治提供理论基础。

