长链非编码RNA Blnc1在糖尿病肾脏疾病患者血清中的表达及临床意义
彭佳欣 刘爽 左秀玲 王志宏
糖尿病是一种以高血糖为主要特征的慢性炎症性疾病,近年来其患病率逐年升高,预计至2035年因糖尿病死亡的患者人数达到5.92亿[1]。有研究显示,糖尿病肾脏疾病(DKD)是糖尿病最常见的微血管并发症,早期针对性治疗能够延缓DKD的发生和发展,若治疗不及时DKD将导致终末期肾脏疾病[2-3]。因此,早期评估筛查、尽早干预DKD对降低医疗费用、改善预后有重要意义。既往研究显示,DKD病理过程与多种长链非编码RNA(LncRNA)异常表达有关[4-6]。LncRNA Blnc1作为LncRNA中的一员,已有研究证实其在DKD中出现异常表达,参与DKD发展中的炎症反应、肾纤维化及氧化应激反应[7]。本研究通过探究LncRNA Blnc1与DKD的关系,探讨其在评估DKD中的作用。
对象与方法
1.对象:选取2019年4月~2021年4月我院内分泌科收治的56例DKD患者作为DKD组,同期收治的50例单纯2型糖尿病(T2DM)患者作为T2DM组,同期于本院体检的56例健康者作为对照组。诊断标准:参考《中国糖尿病肾脏病防治指南(2021年版)》,在明确糖尿病作为肾损害的病因并排除其他原因引起CKD的情况下,至少符合下列其中1项即可诊断为DKD:(1)排除干扰因素情况下,在3~6个月内的3次检测中至少出现2次尿白蛋白/肌酐比值(UACR)≥30 mg/g;(2)估算的肾小球滤过率(eGFR)<60 ml·min-1·(1.73 m2)-1;(3)肾活检符合DKD病理改变[8]。T2DM患者均符合《中国2型糖尿病防治指南(2020年版)》中T2DM诊断标准[9]。排除标准:(1)既往肾脏疾病史;(2)肝功能异常;(3)合并糖尿病非酮症高渗综合征、糖尿病酮症酸中毒等急性并发症;(4)合并泌尿系统感染、结缔组织病等导致的肾脏损害。本研究已通过我院伦理委员会审核批准,所有受试者均签署知情同意书。
2.方法:收集所有受试者的一般临床资料[BMI、性别、年龄、收缩压(SBP)、舒张压(DBP)、糖尿病病程]、实验室检查结果[血肌酐(SCr)、eGFR、糖化血红蛋白(HbA1c)、24 h尿蛋白、UACR]及血清LncRNA Blncl表达水平。采用实时荧光定量PCR技术检测血清LncRNA Blnc1表达水平。
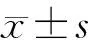
结 果
1.3组受试者一般临床资料、实验室检查结果及LncRNA Blnc1表达水平比较:T2DM组和DKD组患者SCr、HbA1c水平及血清LncRNA Blnc1表达水平均高于对照组(P<0.05)。DKD组患者SCr、HbA1c、UACR、24 h尿蛋白水平、糖尿病病程及血清LncRNA Blnc1表达水平均明显高于T2DM组,eGFR低于T2DM组(P<0.05)。见表1。
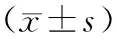
表1 3组受试者一般临床资料、实验室检查结果及LncRNA Blnc1表达水平比较
2.T2DM患者发生DKD的危险因素分析:多因素logistic回归分析结果显示,糖尿病病程、UACR、HbA1c、24 h尿蛋白及血清LncRNA Blnc1表达水平升高、eGFR降低是T2DM患者发生DKD的独立危险因素(P<0.05)。见表2。
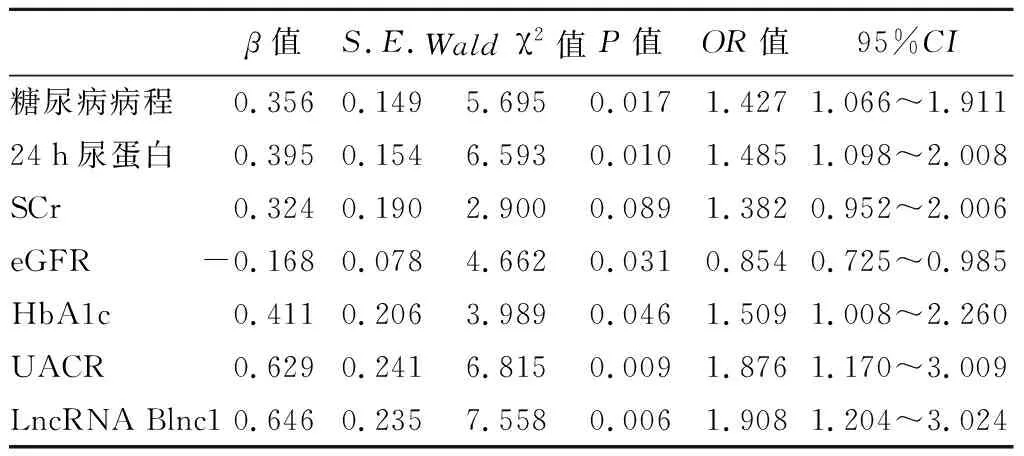
表2 T2DM患者发生DKD的危险因素
3.DKD患者血清LncRNA Blnc1表达水平与临床指标的相关分析:Pearson相关分析结果显示,DKD患者血清LncRNA Blnc1表达水平与eGFR呈负相关(r=-0.688,P<0.001),与UACR(r=0.651)、HbA1c(r=0.704)、24 h尿蛋白(r=0.593)呈正相关(P<0.001);与SBP(r=0.274)、DBP(r=0.138)、SCr(r=0.217)不相关(P>0.05)。
4.血清LncRNA Blnc1对DKD的诊断价值:血清LncRNA Blnc1在DKD组与T2DM组间诊断DKD的曲线下面积(AUC)为0.835(95%CI0.750~0.919),特异度为96.00%,敏感度为76.80%,最佳截断值为1.50。血清LncRNA Blnc1在DKD组与对照组间诊断DKD的AUC为0.944(95%CI0.903~0.984),特异度为98.20%,敏感度为83.90%,最佳截断值为1.26。
讨 论
据统计,2021年全球20~79岁人群糖尿病患病率约为10.5%,而至2045年患病人数可能上升为7.832亿[10],糖尿病导致的DKD发病率同样迅猛增加[11]。早期诊断DKD,并进行针对性治疗能有效延缓其进展为终末期肾病,降低死亡率[12]。目前,临床需要更多方法积极有效进行早期预测DKD发生风险。
研究结果显示,LncRNA通过炎症反应、肾小管上皮细胞凋亡、氧化应激、肾组织纤维化等过程参与DKD发生和发展[13-14]。其中,LncRNA Blnc1被鉴定为一种保守的富含棕色脂肪组织的LncRNA,可促进棕色和米色脂肪细胞分化。2019年,Feng等[7]有关DKD的研究结果显示,LncRNA Blnc1在患者血清、高浓度葡萄糖诱导的人肾(HK-2)细胞和链霉素诱导的DKD小鼠中均上调表达。但LncRNA Blnc1在DKD中作用及其临床意义尚未阐明。本研究结果显示,DKD组患者血清LncRNA Blnc1表达水平升高,表明LncRNA Blnc1参与糖尿病肾损伤的发生发展,对DKD进展起着积极推动作用。干扰LncRNA Blnc1后,高糖诱导的HK-2细胞中炎症因子肿瘤坏死因子(TNF)-α、IL-6和IL-1β水平减少、抑制氧化应激、阻止肾纤维化,LncRNA Blnc1可能通过核因子相关因子(NRF)2/血红素加氧酶(HO)-1和核因子(NF)-κB通路调节DKD进展[7]。另有研究证实,LncRNA Blnc1的沉默通过激活过氧化物酶体增殖物激活受体(PPAR)-γ/沉默信息调节因子(SIRT)6/人类叉头框O3(FOXO3)通路减轻脑出血引起的神经损伤、炎症反应和血肿[15]。本研究logistic回归分析结果显示,LncRNA Blnc1水平升高是影响T2DM患者进展为DKD的独立危险因素,说明血清LncRNA Blnc1异常表达与DKD形成密切相关,其具有作为临床诊断DKD标志物的潜能。根据以上研究内容,推测LncRNA Blnc1在DKD血清中水平增加可能是通过调控炎症反应及氧化应激,诱导肾小球及肾小管凋亡增加,促进肾间质纤维化,从而参与DKD发病过程。目前已发现C反应蛋白、TNF、胱抑素-C等均可用于评估DKD,但其对肾脏损伤严重程度的判定特异度低,诊断价值有限[16]。本研究进一步采用ROC曲线分析发现,LncRNA Blnc1在DKD组与T2DM组间诊断DKD的AUC为0.835,在DKD组与对照组中诊断DKD的AUC为0.944,说明血清LncRNA Blnc1作为无创指标,对于诊断DKD有较好应用价值。
eGFR、UACR、HbA1c、24 h尿蛋白均为临床反应糖尿病及肾功能的一般性指标[17-18]。多因素logistic回归分析结果发现,UACR、HbA1c、24 h尿蛋白水平升高、eGFR降低是T2DM患者发生DKD的独立危险因素,说明及时监控以上指标变化有助于诊断DKD。糖尿病病程增加,T2DM患者合并肾脏病的风险增高,主要是由于长期的高血糖导致肾脏血流动力学异常,造成肾功能损伤,因而糖尿病病程延长也是DKD的危险因素[19]。进一步采用Pearson相关分析探讨临床指标与LncRNA Blnc1的相关性,发现血清LncRNA Blnc1表达水平与eGFR呈负相关,与UACR、HbA1c、24 h尿蛋白均呈正相关,因而我们有理由推测LncRNA Blnc1在DKD的发生发展中有着重要作用,其高表达可反映肾脏受损程度,再次证明血清LncRNA Blnc1有作为DKD检测标志物的潜能。
综上所述,LncRNA Blnc1在DKD患者血清中高表达,DKD患者血清LncRNA Blnc1表达水平与eGFR、UACR、HbA1c、24 h尿蛋白相关,其中LncRNA Blnc1诊断DKD的价值较高,有望成为临床早期诊断DKD的无创性生物标志物。但本研究为单中心、小样本研究,可能导致结果偏倚,今后需扩大样本量,选取更多检测指标,排除可能混杂因素,以进一步阐明LncRNA Blnc1与DKD的关系。

