长非编码RNA HOXD-As2通路抑制直肠癌细胞增殖、转移作用机制研究
叶鹏程, 杨钧淞, 唐 锦, 谭 淼, 吴东津, 魏寿江
川北医学院附属医院 胃肠外一科,四川 南充 637000
在世界癌症发病率与病死率排名中,直肠癌分别位于第3位与第4位[1]。每年有超过100万的直肠癌新病例,约70万患者死于直肠癌[2]。直肠癌的发生、发展涉及多种因素,包括癌基因的激活与抑癌基因的失活[3]。肿瘤抑制基因的突变对于非侵袭性疾病向侵袭性疾病的转变至关重要。侵袭性直肠癌中的突变频率与恶性肿瘤程度相关[4-5]。长非编码RNA(long noncoding RNA,LncRNA)是一类长度>200 bp的RNA,没有编码蛋白质的能力[6]。与microRNA及其他小的非编码RNA不同,LncRNA可以通过转录和翻译来调控下游的目标基因[7]。LncRNA HOXD-As2位于2号染色体上,为homeobox D基因的反义链[8]。本研究旨在探讨LncRNA HOXD-As2通路抑制直肠癌细胞增殖、转移的潜在机制。现报道如下。
1 材料与方法
1.1 实验材料及设备 直肠癌细胞HCT116购自广州群贤科技有限公司(货号:CH1101)。HT29细胞购自广州悦行生物科技有限公司(货号:T1028)。Trizol试剂购自上海玻尔化学试剂有限公司(货号:B645504)。HOXD8抗体购自广州市鲁诚生物科技有限公司。上皮性钙粘蛋白(E-Cadherin)抗体购自沈阳万类生物科技有限公司(货号:WLH4321)。神经性钙粘蛋白(N-Cadherin)抗体购自广州硕恒生物科技有限公司(货号:sc-59987)。基质金属蛋白酶9 (matrix metalloproteinase 9,MMP-9)抗体购自广州文奇生物科技有限公司(货号:ab38898)。蛋白激酶B(protein kinase B,AKT)抗体购自昆明皇宝商贸有限公司(货号:AA326)。雷帕霉素机械靶蛋白(mechanistic target of rapamycin,mTOR)抗体购自北京依珊汇通科技有限公司(货号:mTOR001)。磷脂酰肌醇-3-激酶(phosphoinositide-3 kinase,PI3K)抗体购自北京沃格东方科技有限公司(货号:PI3K001)。磷酸化磷脂酰肌醇-3-激酶(phosphorylated phosphatidylinositol 3-kinase,p-PI3K)抗体购自广州永诺生物科技有限公司(货号:YNKT099)。磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)抗体购自北京伊诺凯科技有限公司(货号:05-1003)。磷酸化雷帕霉素机械靶蛋白(phosphorylated mechanistic target of rapamycin,p-mTOR)抗体购自广州沃亘生物科技有限公司(货号:OGCP-04-54)。
1.2 研究方法
1.2.1 细胞培养与分组 直肠癌细胞HCT116或HT29在DMEM培养基中培养,加入10%胎牛血清,37℃培养箱。检测前2 d,将HOXD8与LncRNA HOXD-As2过表达质粒通过Lipofectamine 2000转染至HCT116或HT29细胞中。其中,转染阴性设为对照组,转染LncRNA HOXD-As2过表达质粒设为HOXD-As2组;转染空载体Vector设为Vector组,转染HOXD8过表达质粒设为HOXD8组。
1.2.2 RNA抽取与实时荧光定量聚合酶链式反应 采用Trizol试剂从直肠癌细胞HCT116或HT29中分离RNA,用反转录系统合成cDNA。采用Power SYBR Green PCR Master Mix检测HOXD8的mRNA表达,以GAPDH作为内源对照。
1.2.3 荧光素酶报告实验 含有HOXA-AS2推定靶点的HOXD8野生体(HOXD8-WT)序列片段被合成并插入pmirGLO载体中。使用QuikChange Ⅱ位点定向诱变试剂盒产生HOXD8突变体(HOXD8-MT),突变位点为HOXA-AS2的结合位点。将含有HOXD8-WT的载体、HOXD8-MT的载体、HOXA-AS2过表达载体以及对照载体转染至直肠癌细胞HCT116或HT29。转染后48 h,使用双荧光素酶报告系统检测Renilla荧光素酶和萤火虫荧光素酶的活性。相对荧光素酶的活性被标准化为Renilla荧光素酶的活性。
1.2.4 细胞活力与细胞增殖水平检测 处理过的直肠癌细胞HCT116或HT29置于96孔板中24、48、72或96 h,采用0.5 mg/ml四氮唑盐溶液培养3 h,然后用0.01 mmol/L氯化氢缓冲液后用细胞组织快速裂解液裂解细胞,用酶标仪测量450 nm处吸光度。将有指定转染的直肠癌细胞HCT116或HT29置于6孔板中,每3 d更换1次培养基。2周后,采用0.4%结晶紫对甲醛固定的细胞进行染色,然后在光学显微镜下进行计数。
1.2.5 细胞侵袭和细胞迁移水平的检测 将指定转染的直肠癌细胞HCT116或HT29置于6孔板中,并通过吸管划伤。24 h后,清除碎片,在显微镜下拍摄伤口宽度,并通过Image J软件计算。在涂有Matrigel的Transwell试验室的上腔填充100 μl无胎牛血清DMEM中的直肠癌细胞HCT116或HT29悬浮液。将含有15%胎牛血清的DMEM(600 μl)放入下腔。48 h后,用0.1%水晶紫对下腔室中的甲醛固定细胞进行染色,并在显微镜下进行计数。
1.2.6 免疫印迹 直肠癌细胞HCT116或HT29在细胞组织快速裂解液裂解和提取缓冲液中进行裂解。酸性蛋白试剂盒被用来测定细胞裂解液中的蛋白浓度。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离细胞裂解液,然后将蛋白质样品电转到聚偏二氟乙烯膜上。采用5%牛血清白蛋白溶液阻断膜,然后采用一级抗体过夜。采用相应的辣根过氧化物酶标记的二抗(1∶5 000)孵育后,用增强化学发光法检测膜上条带的免疫活性。通过Image J软件以β-actin为内参计算条带灰度值。
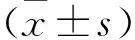
2 结果
2.1 对照组与HOXD-As2组荧光素酶活性及相应的mRNA、蛋白表达比较 与对照组相比,HOXD-As2组荧光素酶活性下降,而mRNA、蛋白相对表达情况增加,差异均有统计学意义(P<0.05)。见表1。
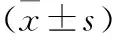
表1 对照组与HOXD-As2组荧光素酶活性及mRNA、蛋白相对表达情况比较
2.2 LncRNA HOXD-As2对直肠癌细胞增殖及转移影响 与对照组相比,HOXD-As2组直肠癌细胞HCT116、HT29细胞活力、细胞增殖、细胞侵袭、细胞迁移水平及N-cadherin、MMP-9蛋白表达均下降,E-cadherin蛋白表达增加,差异均有统计学意义(P<0.05)。见图1。
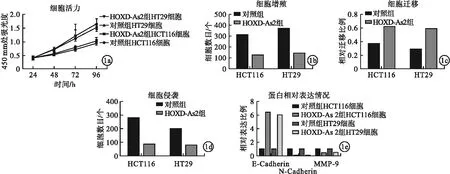
图1 LncRNA HOXD-As2对直肠癌细胞增殖及转移影响(a.不同时间点HCT116与HT29细胞活力水平;b.LncRNA HOXD-As2对细胞增殖水平影响;c.LncRNA HOXD-As2对细胞侵袭水平影响;d.LncRNA HOXD-As2对细胞迁移水平影响;e.LncRNA HOXD-As2对细胞E-cadherin、N-cadherin与MMP-9蛋白相对表达情况影响)
2.3 LncRNA HOXD-As2靶向HOXD8对直肠癌细胞增殖及转移影响 与对照组相比,HOXD-As2组直肠癌细胞HCT116、HT29中HOXD8的mRNA与蛋白表达水平均显著上升,差异均有统计学意义(P<0.05)。与Vector组相比,HOXD8组直肠癌细胞HCT116、HT29细胞活力、细胞增殖、细胞侵袭、细胞迁移水平及N-cadherin、MMP-9蛋白表达均显著下降,E-cadherin蛋白表达增加,差异均有统计学意义(P<0.05)。见图2。
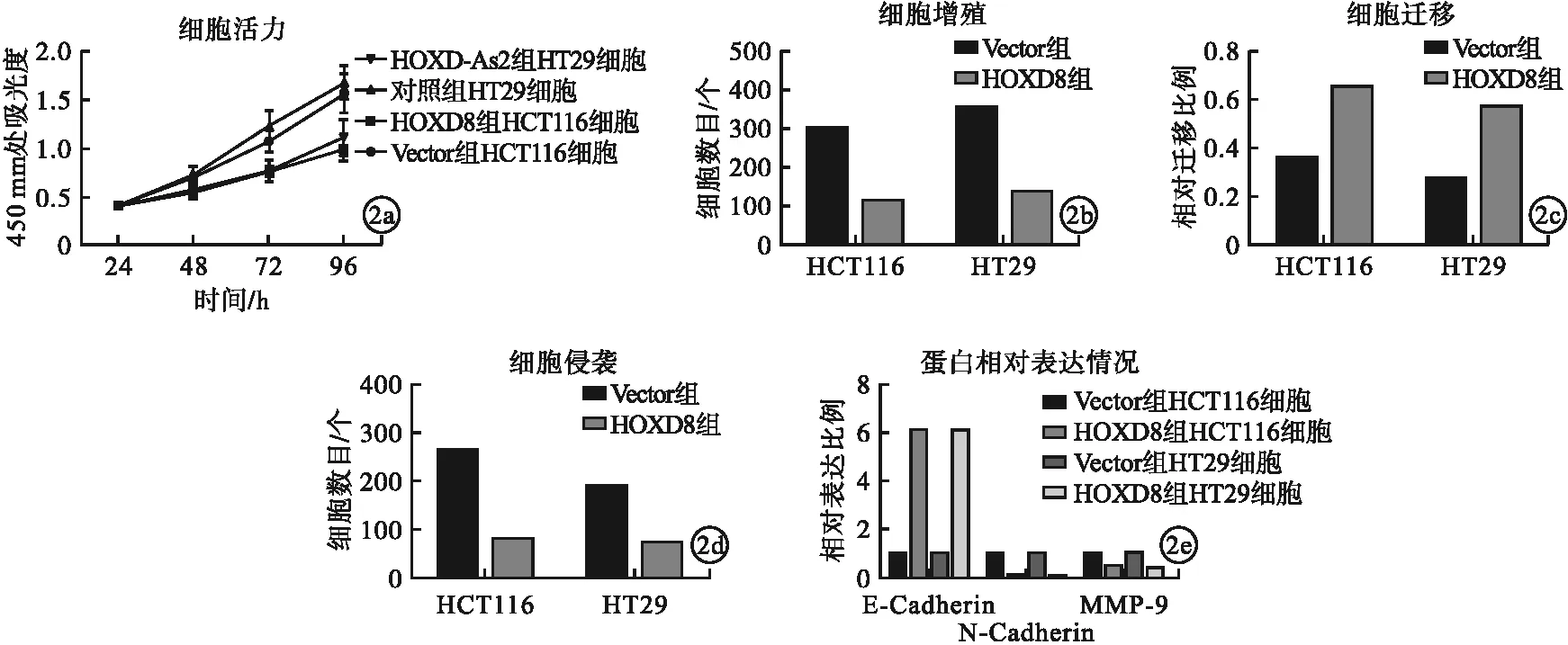
图2 LncRNA HOXD-As2靶向HOXD8对直肠癌细胞增殖及转移影响(a.不同时间点LncRNA HOXD-As2靶向HOXD8对细胞活力水平;b.LncRNA HOXD-As2靶向HOXD8对细胞增殖水平;c.LncRNA HOXD-As2靶向HOXD8对细胞侵袭水平;d.LncRNA HOXD-As2靶向HOXD8对细胞迁移水平;e.LncRNA HOXD-As2靶向HOXD8对细胞E-cadherin、N-cadherin和MMP-9蛋白相对表达情况)
2.4 LncRNA HOXD-As 对直肠癌细胞增殖及转移机制影响 HOXD-As2组直肠癌细胞HCT116、HT29中p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR水平均低于对照组,差异均有统计学意义(P<0.05)。HOXD8组直肠癌细胞HCT116、HT29中p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR水平均低于Vector组,差异均有统计学意义(P<0.05)。见图3。

图3 LncRNA HOXD-As对直肠癌细胞增殖及转移机制影响(a.过表达LncRNA HOXD-As2对 细胞p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR相对表达水平影响;b.过表达HOXD8对细胞p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR相对表达水平影响)
3 讨论
肿瘤作为一种多基因疾病,其主要机制为细胞逃避正常的生长控制进行自主增殖;同时,通过原癌基因的激活或肿瘤抑制基因的突变或缺失而表现出一定的侵袭性[9]。癌症的发生存在许多调节因素,这些调节因子可以控制癌基因或抑癌基因的表达,发挥促进或抑制肿瘤发展作用。LncRNA作为一类没有编码蛋白质的能力的RNA,其在人体中可以通过调控各种细胞因子、促凋亡和抗凋亡基因等信号分子的表达,控制细胞的增殖、分化和凋亡。LncRNA与肿瘤的发生、发展及预后密切相关[10]。HOXD-AS2作为Homeobox D基因的反义链,主要定位于人染色体2q31.1,长度为692 bp。有研究报道,LncRNA HOXD-AS2在神经胶质瘤中高表达,并与神经胶质瘤分级和预后不良[11]。Yang等[12]研究发现,LncRNA HOXD-AS1可以通过抑制HOXD3诱导的整联蛋白β3转录激活和MAPK/AKT信号通路来调控大肠癌的生长和转移,但具体机制并不清楚。
本研究结果发现,与对照组相比,HOXD-As2组直肠癌细胞HCT116、HT29细胞活力、细胞增殖、细胞侵袭、细胞迁移水平及N-cadherin、MMP-9蛋白表达均下降,E-cadherin蛋白表达增加,差异均有统计学意义(P<0.05)。这提示,LncRNA HOXD-As2可能通过调控E-cadherin、N-cadherin和MMP-9蛋白表达参与直肠癌细胞增殖、侵袭及迁移。有研究报道,LncRNA HOXD-AS2的表达下降通过靶向HOXD8促进胃癌进展[13]。在胶质瘤中,LncRNA HOXD-AS2的下调通过抑制肿瘤细胞的增殖及迁移改善胶质瘤患者的预后[14]。Homeobox基因作为发育调节基因,在胚胎发育过程中给予细胞位置信息[15]。有研究报道,HOX基因参与肺癌、乳腺癌、口腔癌、食道癌以及黑色素瘤肿瘤的发展[16-17]。在直肠癌中,与原发组织相比,HOXD8的表达在临床癌症组织中特别是在转移灶中被下调[18]。本研究结果显示,与Vector组相比,HOXD8组直肠癌细胞HCT116、HT29的细胞活力、细胞增殖、细胞侵袭、细胞迁移水平及N-cadherin、MMP-9蛋白表达均显著下降,E-cadherin蛋白表达增加,差异均有统计学意义(P<0.05)。这提示,LncRNA HOXD-As2可能通过与靶基因HOXD8相互作用,抑制PI3K/Akt通路影响直肠癌细胞增殖和转移。这可能是由于PI3K/AKT信号通路作为人体中调控肿瘤生长、转移的一个关键通路,激活PI3K/AKT信号通路可明显的抑制肿瘤细胞的凋亡[19-20]。
综上所述,LncRNA HOXD-As2通过与靶基因HOXD8相互作用,上调HOXD8的mRNA与蛋白表达水平,抑制PI3K/Akt通路,降低直肠癌细胞增殖与转移水平。

