土家药竹节参多糖通过Nrf2-ARE信号通路对四氯化碳致大鼠急性肝损伤的抗氧化保护作用
唐 浪,宋添力,吴广阳,王一民,石廷玉,刘 绪,黄 胜
• 药理与临床•
土家药竹节参多糖通过Nrf2-ARE信号通路对四氯化碳致大鼠急性肝损伤的抗氧化保护作用
唐 浪,宋添力#,吴广阳,王一民,石廷玉,刘 绪,黄 胜*
湖北民族大学医学部,湖北 恩施 445000
基于核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)信号通路研究竹节参多糖(polysaccharide)保护四氯化碳(carbon tetrachloride,CCl4)所致大鼠急性肝损伤的作用机制。通过CCl4间隔诱导法建立急性肝损伤大鼠模型,给予水提醇沉法制备的竹节参多糖治疗7 d后取材,通过苏木素-伊红(HE)染色观察肝组织病理变化;全自动生化仪检测大鼠血清中肝功能相关指标;ELISA法检测肝组织氧化应激水平;免疫组化法观察大鼠肝组织Nrf2表达;Western blotting测定大鼠肝组织Nrf2-ARE通路相关蛋白表达。与模型组比较,竹节参多糖组大鼠血清中肝功能相关指标呈不同程度的降低(<0.05、0.01),肝组织中Nrf2-ARE信号通路明显激活(<0.01),肝脏中脂类过氧化产物丙二醛(malondialdehyde,MDA)水平降低(<0.01),抗氧化酶活性明显升高(<0.05、0.01),细胞质中氧化应激效应物Nrf2阳性的细胞数有所减少(<0.01),大鼠肝脏损伤程度明显减轻。竹节参多糖可激活Nrf2-ARE信号通路,增强机体的抗氧化酶系表达,减轻CCl4引起的氧化损伤。
竹节参多糖;急性肝损伤;Nrf2-ARE信号通路;氧化应激;氧化损伤
急性肝损伤(acute liver injury,ALI)是指各种因素引起的突发性肝细胞大面积坏死或严重肝功能损害,出现以黄疸、腹水、凝血功能障碍或肝性脑病等为主要特征的一种临床综合征,部分患者可能进一步发展为急性肝衰竭(acute liver failure,ALF)[1]。ALI发病机制与氧化应激、炎症反应、细胞纤维化和细胞凋亡等的进程有关,在酒精、中毒、病毒性肝炎、免疫、血管障碍或药物的影响下,肝脏氧化与抗氧化系统的平衡被打破,物质倾向于被氧化,进而导致氧化应激,产生大量的活性氧、活性氮等自由基[2-3]。大量自由基的产生引起蛋白质、核酸和脂类等生物大分子被不同程度的氧化,导致蛋白质变性、DNA断裂、脂类过氧化等改变,引起脂类过氧化产物丙二醛(malondialdehyde,MDA)的升高,进而致使细胞内的相关结构破坏及功能异常[4]。
核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)信号通路的激活是机体内一种重要的细胞适应性应答抵制氧化应激和其他类型应激的抗氧化防御机制,参与细胞增殖、3大营养物质代谢、细胞衰老和凋亡等多种生物学过程,是预防和治疗机体氧化应激和炎症的一条重要途径[5-8]。土家族药用植物竹节参为五加科人参属植物竹节参C. A. Mey.的干燥根茎,其性温,味甘、微苦,有活血化瘀、滋补强壮、祛风除湿的功效[9-10]。现代药理学研究表明,竹节参有保护肝损伤的作用,其多糖成分有减轻自由基损伤、提高过氧化物酶系统活力、减少炎症相关因子表达等药理学活性[11-13]。本研究通过建立四氯化碳(carbon tetrachloride,CCl4)间隔诱导的急性肝损伤模型,探究竹节参多糖对肝损伤的保护作用,并基于Nrf2-ARE信号通路探讨竹节参多糖改善肝损伤的作用机制,为竹节参多糖作为护肝药物的药理学机制研究和临床防治ALI提供理论参考。
1 材料
1.1 动物
SPF级雄性SD大鼠36只,体质量(200±20)g,8周龄,购自辽宁长生生物技术股份有限公司,实验动物质量合格证编号No.210726210100500171,许可证号SCXK(辽)2020-0001。动物饲养于温度(23±2)℃、相对湿度(55±5)%、明暗循环12 h的环境中,自由进食饮水。动物实验伦理批准号(2021)56。
1.2 药材
竹节参购自湖北省宣恩县椿木营竹节参培育种植基地,经湖北民族大学文德鉴副教授鉴定为五加科植物竹节参C. A. Mey.的干燥根茎。
1.3 药品与试剂
联苯双酯滴丸(批号H11020980)购自北京协和药厂;CCl4购自天津市天力化学试剂有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号S03030)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号S03040)购自深圳生命科学股份有限公司;总胆红素(total bilirubin,TBil)试剂盒(批号C120)、直接胆红素(direct bilirubin,DBil)试剂盒(批号C119)购自生物技术有限公司;MDA试剂盒(批号A003-1)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号A001-1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(批号A005)、过氧化氢酶(catalase,CAT)试剂盒(批号A007-1)均购自南京建成生物工程研究所;超敏ECL发光液(批号KR0016)、HRP标记的山羊抗兔IgG抗体(批号152203)购自科技有限公司;苏木素-伊红(HE)染色试剂盒(批号C0105S)、BCA蛋白定量试剂盒(批号P0010)、HRP标记的山羊抗小鼠IgG抗体(批号A0216)购自;免疫组织化学染色(immunohistochemical staining,IHC)试剂盒(批号16I14B07G2622)、二氨联苯胺(diaminobenzidine,DAB)显色试剂盒(批号16C08A17)购自武汉生物工程有限公司;Cul3多抗(批号11107-1-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单抗(批号60004-1-Ig)购自Proteintech公司;Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)多抗(批号WL03285)、Nrf2多抗(批号WL02135)、还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶1(nicotinamide adenine dinucleotide phosphate quinone oxidoreductase 1,NQO1)多抗(批号WL04860)均购自沈阳万类生物科技有限公司。
1.4 仪器
Chemray 380型全自动生化检测仪(深圳雷杜生命科学股份有限公司);1510型全波长酶标仪、A44116型凝胶成像系统(美国Thermo公司);RM2245型组织切片机(德国Leica公司);CX41RF型正置光学显微镜(日本Nikon公司);B212AT04E型电泳及转膜系统(美国Bio-Rad公司);JA2003N型高精度天平(上海精密科学仪器有限公司);5811型高速冷冻离心机(德国Eppendorf公司)。
2 方法
2.1 竹节参多糖的制备及含量测定
竹节参多糖的制备参考文献方法[12-14]并加以改进:取一定质量的干燥竹节参药材碎末,以20倍体积的95%乙醇80 ℃回流3 h,脱脂;以20倍体积的80%乙醇60 ℃回流2 h,脱单糖和低聚糖;滤过,收集药渣后,10倍体积的纯化水磁力搅拌80 ℃回流提取3次,每次2 h;合并3次滤液过D101大孔树脂柱,脱皂苷、色素;收集滤液减压浓缩至一定体积,用Svage法除蛋白(4 ℃、10 000 r/min离心4 min)直至无蛋白层出现,合并上清液,加无水乙醇(慢加快搅)直至乙醇体积分数达90%,4 ℃过夜,滤过,收集沉淀干燥,即得精制竹节参多糖。应用苯酚-硫酸法[15]测定竹节参多糖含量。
2.2 动物分组、造模与给药
SD大鼠随机分为正常组、模型组、联苯双酯(100 mg/kg)[16]组和竹节参多糖低、中、高剂量(50、100、200 mg/kg)组,每组6只。依据《中国药典》2020年版中竹节参成人生药剂量(6~9 g)与“实验动物与人的体表面积换算关系”进行剂量确定,计算得到的剂量作为中剂量组,并按照0.5∶1∶2比例设置低、中、高剂量组[9,17]。采取间隔诱导法建立ALI大鼠模型[18],除正常组ip生理盐水外,其余各组大鼠在第1、4、7天ip 12% CCl4生理盐水溶液(5 mL/kg)。此期间除正常组和模型组ig生活饮用水外,其余各组大鼠ig相应药物(5 mL/kg),2次/d。第7天给药后,晚上禁食不禁水,次日麻醉收集大鼠血清与肝脏组织。大鼠血液在4 ℃、4000 r/min离心15 min,分离血清于−80 ℃保存。
2.3 肝脏指数计算
大鼠肝脏称定质量后,切取约1 cm×1 cm大小于4%多聚甲醛中固定,剩余肝组织分装若干于−80 ℃下冻存后用于肝脏相关指标检测。
肝脏指数=肝脏质量/体质量
2.4 血清肝功能相关指标测定
使用全自动生化仪检测各组大鼠血清中AST、ALT活性及TBil、DBil水平。
2.5 肝组织病理学观察
大鼠肝组织经多聚甲醛固定24 h后,脱水、包埋,制作石蜡切片(5 μm),HE染色,使用光学显微镜对比观察各组大鼠肝组织病理学变化。
2.6 肝组织中MDA水平及SOD、GSH-Px、CAT活性测定
大鼠肝组织与生理盐水以1∶9的比例制成匀浆,4 ℃、10 000 r/min离心5 min,取上清液,按照试剂盒说明书测定MDA水平及SOD、GSH-Px、CAT活性。
2.7 免疫组化法检测肝组织Nrf2表达
大鼠肝组织石蜡切片(5 μm),经二甲苯脱蜡、梯度乙醇复水,5% H2O2进行内源性过氧化物酶淬灭处理,于0.01 mol/L枸橼酸盐中进行高压抗原修复,5%牛血清白蛋白封闭;滴加一抗(1∶200),4 ℃孵育过夜;滴加二抗(1∶100),37 ℃孵育30 min;滴加链霉亲和素-生物素复合物(streptavidin-biotin complex,SABC),37 ℃孵育30 min;DAB染色5 min,苏木素复染10 min,饱和碳酸锂返蓝50 s;经梯度乙醇脱水、二甲苯透明,中性树脂封片后于显微镜下观察并拍照,用Image J软件分析Nrf2相对阳性表达面积。
2.8 Western blotting检测肝组织Nrf2-ARE通路蛋白表达
提取大鼠肝脏中总蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭1 h,加入一抗(1∶1000),4 ℃孵育过夜;次日室温孵育0.5 h回收一抗,加入二抗(1∶2000),室温孵育1 h,使用超敏ECL化学发光底物显影。用Image J软件分析条带灰度值。
2.9 统计学分析
3 结果
3.1 竹节参多糖的提取与含量测定
取200 g竹节参,按照“2.1”项下提取流程后获得14.62 g精制竹节参多糖,提取率为7.31%;配制75.8 μg/mL精制竹节参多糖,用苯酚-硫酸法测得中性多糖的质量分数为91.84%。
3.2 竹节参多糖对CCl4致肝损伤大鼠肝脏指数及血清中肝功能指标的影响
如图1所示,与正常组比较,模型组大鼠肝脏指数显著升高(<0.01),血清中ALT、AST活性及TBil水平显著升高(<0.01),提示在肝细胞坏死的情况下,肝脏对间接胆红素(indirect bilirubin,IBil)代谢失常,IBil反流入血而致使TBil水平增高;与模型组比较,联苯双酯组和竹节参多糖中、高剂量组肝脏指数显著降低(<0.05、0.01),血清中ALT和AST活性均显著降低(<0.05、0.01),竹节参多糖高剂量组TBil水平显著降低(<0.05)。与联苯双酯组比较,竹节参多糖高剂量组上述各指标并无统计学上的差异。各组DBil水平无统计学差异。以上结果说明竹节参多糖对CCl4诱导的ALI大鼠肝功能有明显改善作用。
3.3 竹节参多糖对CCl4致肝损伤大鼠肝组织病理变化的影响
如图2所示,正常组大鼠肝组织细胞形态正结构正常,无炎性细胞浸润,以汇管区为中心周围肝细胞索呈放射状排列。模型组大鼠肝脏细胞可见融合性坏死,空泡样病变,汇管区形态结构紊乱,肝细胞索消失。与模型组相比,各给药组肝脏组织坏死及空泡样病变有不同程度的减轻,肝索形态结构相对改善。说明竹节参多糖对CCl4导致的肝组织细胞形态损伤具有保护作用。
3.4 竹节参多糖对CCl4致肝损伤大鼠肝组织氧化应激水平的影响
如图3所示,与正常组比较,模型组大鼠肝组织MDA水平显著升高(<0.01),SOD、CAT和GSH-Px活性显著降低(<0.01),说明模型组氧化损伤严重,抗氧化酶系活性下降;与模型组比较,联苯双酯组和竹节参多糖中、高剂量组肝组织MDA水平显著降低(<0.01),SOD和GSH-Px活性显著升高(<0.05、0.01),竹节参多糖高剂量组CAT活性显著升高(<0.05)。与联苯双酯组比较,竹节参多糖高剂量组SOD、GSH-Px和CAT活力虽呈一定的提高,但差异无统计学意义。说明竹节参多糖增强了大鼠肝脏抗氧化酶的表达,对CCl4导致的肝损伤具有抗氧化应激的保护作用。

与正常组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同

融合性坏死(→),空泡样病变(↓),汇管区(←)

图3 竹节参多糖对CCl4致肝损伤大鼠肝组织MDA水平及SOD、CAT、GSH-Px活性的影响(, n = 6)
3.5 竹节参多糖对CCl4致肝损伤大鼠肝组织Nrf2表达的影响
为进一步探索竹节参多糖导致的抗氧化酶系活性的上调作用是否是通过上游调节因子Nrf2的激活引起的,通过免疫组化法观察各组大鼠肝组织中Nrf2的表达情况。如图4所示,正常组大鼠肝组织细胞内基本未见Nrf2阳性;与正常组比较,模型组细胞中Nrf2阳性明显增加(<0.01);与模型组比较,经给药治疗干预后,肝组织内Nrf2的表达显著降低(<0.01),其中竹节参多糖高剂量组和联苯双酯组最佳。提示竹节参多糖可能通过对肝脏组织Nrf2的表达产生影响,进而诱导细胞抗氧化酶系的表达以抑制氧化应激,改善氧化应激水平。
3.6 竹节参多糖对CCl4致肝损伤大鼠肝组织Nrf2-ARE通路相关蛋白表达的影响
如图5所示,与正常组比较,模型组大鼠肝脏Nrf2表达显著减少(<0.01);与模型组比较,竹节参多糖中、高剂量组Nrf2表达显著增加(<0.01),该结果与免疫组化的结果不一致,进而对Nrf2的结合蛋白Keap1、支架蛋白Cul3及其下游的效应蛋白NQO1的表达进行进一步的研究。与正常组比较,模型组大鼠肝脏Cul3表达无显著性差异,Keap1、NQO1表达显著减少(<0.01);与模型组比较,竹节参多糖中、高剂量组Keap1、NQO1表达显著升高(<0.05、0.01),提示竹节参多糖在治疗过程中可能增强了机体Keap1、Nrf2的合成,在面对自由基团攻击时启动NQO1等抗氧化酶系的表达,进而降低了肝脏氧化应激水平。与模型组比较,联苯双酯组Keap1、Nrf2、NQO1的表达均无明显差异,提示联苯双酯改善抗氧化酶活力的作用机制可能受其他因素的调节。
3.7 各组大鼠肝组织Keap1/Nrf2值比较
鉴于Keap1与Nrf2之间特殊的结构关联性,拟将两者与各自内参的相对比值进行比较,即分别用Keap1/GAPDH相对量与Nrf2/GAPDH相对量的比值进行两两处理,然后取平均值得Keap1/Nrf2的相对值,观察各组两者比值的相对变化,分析不同处理组对Keap1与Nrf2的整体影响(图6)。结果显示,与正常组比较,模型组Keap1/Nrf2值减小(<0.05),提示可能通过减少Keap1的量,进而相对增加Nrf2的激活来应对CCl4所致的氧化应激,而从图5来看,可能在持续的氧化诱导下,即便机体减少了Keap1的量,但Nrf2的量也存在不可避免的被降解而减少,同时提示机体新Nrf2合成不足,出现了Keap1与Nrf2表达同时减少的情况。与模型组一致,联苯双酯组Keap1/Nrf2值减小,进一步揭示,联苯双酯可能并无通过Nrf2蛋白发挥改善肝损伤的作用,其增加抗氧化的机制可能与其他因素有关。竹节参多糖各剂量组相对于正常组而言,其Keap1/Nrf2值无明显差异,提示在机体减少Keap1的量以及Nrf2也因CCl4持续诱导肝损伤而减少的情况下,竹节参多糖治疗后可能存在使新Nrf2合成增加的作用,同时增加了Keap1合成以锚定Nrf2,进而增加了肝组织细胞的抗氧化能力,缓解肝损伤。竹节参多糖促进Nrf2表达增加的更深层次分子作用机制有待进一步探究。

图4 竹节参多糖对CCl4致肝损伤大鼠肝组织Nrf2表达的影响(, n = 3)

图5 竹节参多糖对CCl4致肝损伤大鼠肝组织Nrf2、Keap1、Cul3和NQO1蛋白表达的影响(, n = 3)

图6 各组大鼠肝组织Keap1/Nrf2值比较(, n = 3)
4 讨论
本研究通过间隔式诱导肝损伤的方法模拟现实生活中ALI发病的突然性及长期处于有毒环境持续诱导造成ALI的持续性,并采取治疗性给药方式,探究竹节参多糖通过Nrf2-ARE信号通路对CCl4诱导ALI大鼠的保护作用机制。结果表明,竹节参多糖可改善肝损伤大鼠的肝功能,通过激活Nrf2-ARE信号通路增强抗氧化酶系的活力而发挥抗氧化作用(图7)。
血清转氨酶ALT、AST是评价肝功能损伤的有效指标,当肝细胞受损时,ALT和AST大量释放到血液中,血清ALT和AST活性升高。本实验中模型组血清ALT、AST活性均显著升高。竹节参多糖治疗后血清ALT、AST活性显著降低,说明竹节参多糖可在一定程度上缓解CCl4诱导的ALI,与组织病理学结果一致。同时,竹节参多糖中、高剂量组的降酶效果与联苯双酯组相比无明显差异。作为脂质过氧化的最终代谢产物,MDA水平反映了由CCl4引起的氧化应激的程度[19]。SOD、GSH-Px、GSH和CAT等是体内重要的抗氧化酶,能有效清除自由基,抑制自由基引起的脂质过氧化[20-21]。本研究结果表明,竹节参多糖可以通过增加肝组织细胞SOD、GSH-Px和CAT活力并降低MDA含量改善CCl4诱导的肝损伤,表明竹节参多糖的护肝作用可能与抗氧化应激有关。此外,与联苯双酯组比较,竹节参多糖高剂量组抗氧化酶活力无统计学差异。为了进一步探究上述竹节参多糖增加了肝组织抗氧化酶活力结果的原因,了解竹节参多糖改善CCl4诱导的ALI可能的作用机制,以Nrf2、NQO1、Keap1和Cul3作为研究对象,检测了各组大鼠肝组织中Nrf2、NQO1、Keap1和Cul3的表达。
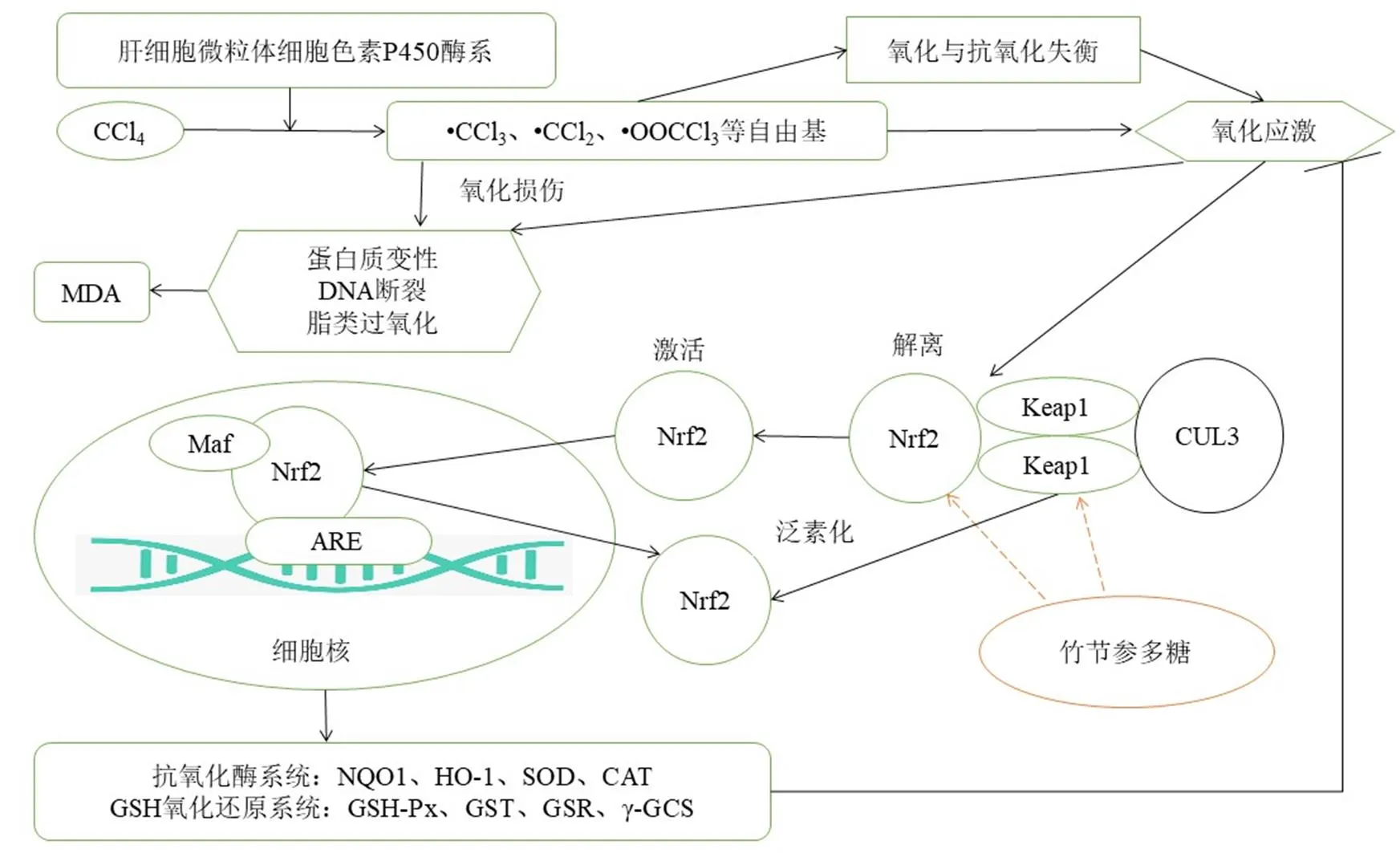
图7 竹节参多糖治疗CCl4致肝损伤大鼠的作用机制
Nrf2是抗氧化防御系统重要调节因子[22-23]。SOD、GSH-Px、GSH、CAT和NQO1、HO-1等抗氧化酶的基因受Nrf2调控。正常情况下,Nrf2被Keap1锚定在细胞质中,少部分进入细胞核与ARE结合,调控机体抗氧化酶的正常表达,维持氧化与抗氧化的动态平衡。出核后Keap1能够使Nrf2发生泛素化被蛋白酶体降解,在这个过程中机体反馈调节合成新的Nrf2以维持基础水平。当存在较为剧烈或持续的氧化刺激或损伤时,细胞通过增加Nrf2的合成、降低出核Nrf2的泛素化及减缓Nrf2的降解,使已出核的Nrf2重新入核以应对氧化损伤,即便如此Nrf2入核次数也是有限的,依然会被降解,这种应对氧化损伤的策略也是有一定限度的[24-28]。Western blotting实验结果中,与正常组比较,模型组Keap1、Nrf2减少可能是由于在间断诱导氧化损伤情况下,肝细胞需要不断地合成足够的Nrf2去应对氧化应激,而持续的损伤使Nrf2合成不足,机体可能通过减少Keap1的含量使Nrf2泛素化降低维持Nrf2的相对水平,从而出现了Keap1、Nrf2蛋白总量都减少的情况,致使胞质中Nrf2以持续解离状态对抗氧化损伤,在IHC结果中表现出Nrf2的高阳性,而氧化损伤未得到治疗性改善。竹节参多糖中、高剂量组Keap1、Nrf2表达量高于模型组,Keap1/Nrf2值也高于模型组,提示竹节参多糖组可能在治疗过程中通过增加Keap1、Nrf2的合成,使之基础水平得到提升,在面对自由基团攻击时更有能力提高下游NQO1及SOD、GSH-Px和CAT等抗氧化酶系的活力,减轻CCl4间断性诱导的肝脏损伤,使机体氧化应激水平降低或逐渐趋于正常,进而反馈调节Nrf2的泛素化和降解,而同时新合成的Nrf2则被Keap1锚定维持动态平衡,从而使Nrf2游离态减少,在免疫组化结果中表现出比之模型组低的阳性水平。联苯双酯组与模型组相比,Keap1、Nrf2和NQO1的表达均无明显差异,提示联苯双酯改善抗氧化酶活力的作用机制可能并非通过Nfr2-ARE信号通路发挥作用,可能与其他抗氧化调节机制有关。对于Cul3表达的影响,各组之间无显著性差异,可能与其作为支架蛋白参与构成泛素连接酶复合物的有关,泛素-蛋白酶体系统是生物体内高度保守且不可或缺的生物过程,调控体内多种生物学过程[26]。
本研究中竹节参多糖对Nrf2更深的影响机制尚未完全阐明,仍有待进一步的探究。竹节参具有滋补强壮、活血化瘀、祛风除湿的功效,竹节参多糖可能通过增加Nrf2调控ARE提升了机体抗氧化能力,增强了正气对肝损伤致病邪气的抵抗能力,从而达到扶正祛邪的治疗效果。本研究在一定程度体现了竹节参的滋补强壮功效与抗氧化药理作用的适应性。同时,联苯双酯作为短期降酶药有着其局限性和不足,竹节参多糖对转氨酶降低作用的长期性影响或可做进一步的研究,竹节参多糖可能具有成为长期降酶药的潜能,将对天然降酶药物和抗氧化护肝药物的研究与开发具有积极意义。
利益冲突 所有作者均声明不存在利益冲突
[1] European Association for the Study of the Liver. EASL clinical practical guidelines on the management of acute (fulminant) liver failure [J]., 2017, 66(5): 1047-1081.
[2] 卢伟, 潘梦, 方亦可, 等. 中药治疗急性肝损伤作用机制研究进展 [J]. 中南药学, 2019, 17(9): 1504-1507.
[3] Chandrasekaran A, Idelchik M D P S, Melendez J A. Redox control of senescence and age-related disease [J]., 2017, 11: 91-102.
[4] Ayoub K F, Pothineni N V K, Rutland J,. Immunity, inflammation, and oxidative stress in heart failure: Emerging molecular targets [J]., 2017, 31(5/6): 593-608.
[5] 李慧, 杨林. Nrf2抗氧化的分子调控机制 [J]. 生物信息学, 2018, 16(1): 1-6.
[6] 张红娜, 周玉法, 刘敬博, 等. 基于NF-κB和Nrf2信号通路探讨槲皮素的护肝功效及其作用机理 [J]. 西北农业学报, 2020, 29(1): 143-149.
[7] Wardyn J D, Ponsford A H, Sanderson C M. Dissecting molecular cross-talk between Nrf2 and NF-κB response pathways [J]., 2015, 43(4): 621-626.
[8] Shu G W, Qiu Y H, Hao J,. γ-Oryzanol alleviates acetaminophen-induced liver injury: Roles of modulating AMPK/GSK3β/Nrf2 and NF-κB signaling pathways [J]., 2019, 10(10): 6858-6872.
[9] 中国药典. [S]. 一部. 2020: 144.
[10] 宋雪成, 郝润璇, 孟艳, 等. 土家族方药治疗风湿病研究现状 [J]. 湖北民族大学学报: 医学版, 2020, 37(1): 69-71.
[11] 杨小林, 陈平. 竹节参多糖、总皂苷对小鼠急性肝损伤保护作用的研究 [J]. 中国中医基础医学杂志, 2011, 17(1): 65-66.
[12] 江善青, 段欢, 舒广文, 等. 竹节参多糖对LPS/-GalN诱导小鼠急性肝损伤的保护作用 [J]. 中药材, 2017, 40(5): 1170-1173.
[13] 徐瑞, 刘钊, 付千, 等. 竹节参多糖对对乙酰氨基酚诱导的小鼠肝损伤的保护作用 [J]. 中南民族大学学报: 自然科学版, 2020, 39(1): 51-55.
[14] 俞启扬, 舒畅, 袁帅, 等. 竹节参水溶性多糖提取的研究 [J]. 农业开发与装备, 2018(9): 129-130.
[15] 张杰, 李春艳, 李劲平, 等. 蒽酮硫酸法与苯酚硫酸法测定竹节参多糖含量的比较研究 [J]. 中南药学, 2012, 10(6): 421-424.
[16] 庄会艳. 联苯双酯的药理作用机制进展分析 [J]. 医学食疗与健康, 2019(16): 203-204.
[17] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算 [J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.
[18] 陶艳艳, 陈高峰, 刘成海. 常用急性肝损伤动物模型评价及其在中药药理研究中的应用 [J]. 上海中医药杂志, 2019, 53(11): 11-19.
[19] Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: Analytical and biological challenges [J]., 2017, 524: 13-30.
[20] Kundu J K, Surh Y J. Nrf2-Keap1 signaling as a potential target for chemoprevention of inflammation-associated carcinogenesis [J]., 2010, 27(6): 999-1013.
[21] Hou Y H, Wang Y T, He Q,. Nrf2 inhibits NLRP3 inflammasome activation through regulating Trx1/TXNIP complex in cerebral ischemia reperfusion injury [J]., 2018, 336: 32-39.
[22] 胡流芳, 王迎, 任汝静, 等. Keap1-Nrf2/ARE信号通路的抗氧化应激作用及其调控机制 [J]. 国际药学研究杂志, 2016, 43(1): 146-152.
[23] 孟祥慧, 张伯礼, 李玉红, 等. 中药基于Nrf2/ARE通路改善糖尿病心肌病的研究进展 [J]. 中草药, 2022, 53(1): 250-260.
[24] Tonelli C, Chio I I C, Tuveson D A. Transcriptional regulation by Nrf2 [J]., 2018, 29(17): 1727-1745.
[25] Bellezza I, Giambanco I, Minelli A,. Nrf2-Keap1 signaling in oxidative and reductive stress [J]., 2018, 1865(5): 721-733.
[26] Sajadimajd S, Khazaei M. Oxidative stress and cancer: The role of Nrf2 [J]., 2018, 18(6): 538-557.
[27] Chen Q M, Maltagliati A J. Nrf2 at the heart of oxidative stress and cardiac protection [J]., 2018, 50(2): 77-97.
[28] Guo Z, Mo Z H. Keap1-Nrf2 signaling pathway in angiogenesis and vascular diseases [J]., 2020, 14(6): 869-883.
Anti-oxidative protection ofpolysaccharide on CCl4-induced acute liver injury in rats based on Nrf2-ARE signaling pathway
TANG Lang, SONG Tian-li, WU Guang-yang, WANG Yi-min, SHI Ting-yu, LIU Xu, HUANG Sheng
Department of Medicine, Hubei Minzu University, Enshi 445000, China
To study the protective mechanism ofpolysaccharide (PSPJ) against carbon tetrachloride (CCl4) induced acute liver injury in rats through nuclear factor E2 related factor 2 (Nrf2)-antioxidant response element (ARE) signal pathway.A rat model of acute liver injury was established using the CCl4interval induction method. After 7 d of treatment with PSPJ prepared by water extraction and alcohol precipitation method, samples were taken and liver tissue pathological changes were observed by hematoxylin eosin (HE) staining; Liver function related indicators in serum of rat were detected by fully automated biochemical analyzer; ELISA method was used to detect oxidative stress level in liver tissue; Immunohistochemical method was used to observe the expression of Nrf2 in liver tissue of rats; Western blotting was used to determine the expressions of Nrf2-ARE pathway related proteins in liver tissue of rats.Compared with model group, liver function related indicators in serum of rats treated with PSPJ showed varying degrees of decrease (< 0.05, 0.01), Nrf2-ARE signaling pathway was significantly activated in liver tissue (< 0.01), level of lipid peroxidation product malondialdehyde (MDA) in liver was reduced (< 0.01), and activity of antioxidant enzymes was significantly increased (< 0.05, 0.01), the number of cells with Nrf2 positive oxidative stress effector in cytoplasm was decreased (< 0.01), and the degree of liver damage in rats was significantly reduced.PSPJ can activate the Nrf2-ARE signaling pathway, enhance the expression of antioxidant enzymes in body, and alleviate oxidative damage caused by CCl4.
polysaccharide; acute liver injury; Nrf2-ARE signal pathway; oxidative stress; oxidative damage
R285.5
A
0253 - 2670(2023)15 - 4866 - 08
10.7501/j.issn.0253-2670.2023.15.012
2023-02-24
湖北省自然科学基金青年项目(2019CFB358);国家自然科学基金青年基金项目(81801979)
唐 浪(1995—),男,硕士研究生,研究方向为常用土家族药的制剂开发与应用。E-mail: 1411992456@qq.com
通信作者:黄 胜(1987—),男,博士,硕士生导师,湖北民族大学医学部基础医学院副院长,从事天然药物的药理学、细胞生物学及分子机制研究。E-mail: hs19870604@163.com
宋添力(1998—),男,硕士研究生,研究方向为天然植物对肝病的防治。E-mail: stl15234839197@163.com
[责任编辑 李亚楠]

