菌黄保肠合剂对脓毒症大鼠肠道微生态调节作用的影响※
铁明慧 陈 斌 庞永诚 李巽华 刘 明 陈维军
(云南中医药大学第三附属医院重症医学科,云南 昆明 650500)
脓毒症是由细菌等病原微生物侵入机体引起的全身炎症反应综合征,严重者可出现器官功能及循环障碍[1]。研究表明,炎性反应及治疗干预措施(如抗生素、质子泵抑制剂、肠外营养等)等可引起肠道微生态环境发生剧烈变化,导致正常的肠道微生物组成结构和功能丧失,细菌肠道易位和毒力基因转化,是脓毒症器官功能障碍的独立危险因素[2-3],并有越来越多的实验及临床研究结果显示,通过改善肠道微生物组成结构可减轻脓毒症炎性反应,提高患者生存率[4-5]。菌黄保肠合剂是我院重症团队20世纪80年代研制而成的医院特色制剂,具有健脾益气生津、清热利湿行气的功效,前期的临床及药理研究已证实菌黄保肠合剂具有治疗肠道感染,促进肠道免疫及生物屏障修复的作用[6-7]。本实验旨在探讨菌黄保肠合剂对脓毒症模型大鼠肠道微生态的调节作用,以期阐明菌黄保肠合剂在脓毒症治疗中的作用机制及实际应用价值。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级雄性SD大鼠80只,10周龄,体质量275~315 g,经适应性喂养2周后进行实验,由湖南斯莱克景达实验动物有限公司提供,合格证号:SYXK(湘)2016-0002,饲养在云南中医药大学动物实验中心,实验动物设施使用许可证号:SYXK(滇)2017-005,本实验获得云南中医药大学动物实验伦理委员会审核批准,批准编号:R-06201903。
1.2 实验药物 菌黄保肠合剂(主要由黄芪、太子参、茯苓、白术、酒炒黄连、薏苡仁、神曲、茵陈、石菖蒲等组成,云南中医药大学第三附属医院药剂科辅助加工制作,滇药制字[Z]20082615A);双歧杆菌活菌胶囊(丽珠集团丽珠制药厂,批号2018020488-1);盐酸头孢噻呋钠注射液(江西正和生物科技有限公司,批号20180802)。
1.3 主要实验试剂及仪器
1.3.1 实验试剂 细菌基因组总DNA抽提试剂盒(德国QIAGEN公司,货号12888);肠道微生物样本核酸纯化试剂盒(德国QIAGEN公司,货号51531);聚合酶链式反应(PCR)用DNA聚合酶(日本TaKaRa公司,货号R060B);定量DNA浓度检测的荧光试剂(美国Thermo公司,货号Q32854)。
1.3.2 主要仪器 实时荧光定量PCR(Real-time PCR)仪(美国 Bio-Rad公司,型号580BR10905);核酸电泳仪(上海天能科技有限公司,型号HE-120);凝胶成像仪(上海天能科技有限公司,型号2500);QubitTMFlex荧光计(美国Thermo公司);高通量核酸纯化工作站(德国QIAGEN公司,型号SN002358);Agilent 2100生物芯片分析系统(美国Agilent公司)。
1.4 实验方法
1.4.1 分组与模型制备 造模前禁食不禁水24 h,称质量后运用SPSS 21.0软件进行完全随机化分成4组:假手术组、模型组、菌黄保肠合剂组及双歧杆菌组,每组各20只。采用盲肠结扎穿刺(CLP)法制备大鼠脓毒症模型[8]。以2%戊巴比妥钠40 mg/kg腹腔注射麻醉大鼠,麻醉满意后大鼠无翻正反射,用碘伏常规消毒腹部区域,铺无菌洞巾,用手术刀沿腹正中线作一长约3~4 cm纵行切口,逐层分离肌肉、筋膜、腹膜,无菌镊探查并仔细分离盲肠。将分离的盲肠置于0.9%氯化钠注射液湿润的纱布上,在盲肠全长1/2处用4号线结扎,然后用20 G套管针将盲肠贯通穿孔2次,避免损伤肠系膜及盲肠血管,挤出少许粪便并确保针孔通畅,将盲肠回纳腹腔,简单缝合关腹后使用金属夹临时夹闭皮肤。其中假手术组仅分离并拖出暴露盲肠后直接回纳腹腔,不进行结扎及穿刺操作。术后各组大鼠皮下注射预热的0.9%氯化钠注射液50 mL/kg补充手术中丢失的体液,并将其置于保温垫上直至麻醉苏醒后送回饲养室正常饲养。于CLP术后24 h时重新开腹,仔细切除坏死的盲肠,用60 mL预热的0.9%氯化钠注射液冲洗腹腔后逐层缝合,同时连续3天皮下注射盐酸头孢噻呋钠抗感染治疗,剂量为5 mg/(kg·d)。
1.4.2 动物给药 CLP术后48 h对各组大鼠开始给药处理,参照药理试验中大鼠与人体间的等效剂量换算[9],菌黄保肠合剂组按4.0 g/(kg·d)(成人等效剂量2倍)予菌黄保肠合剂灌胃,双歧杆菌组按0.1 g/(kg·d)予双歧杆菌活菌胶囊灌胃,假手术组和模型组予3 mL纯净水灌胃,各组均连续灌胃7天。灌胃结束后处死大鼠,采集的大鼠肠内容物(空肠上段、回肠下段)样本,备用。
1.5 观察指标及方法
1.5.1 肠道内容物细菌DNA提取 采集大鼠肠内容物新鲜样本后立即放入液氮中,2 h后储存于-20 ℃冰箱。使用细菌基因组总DNA抽提试剂盒对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳和荧光计测定样本DNA浓度。
1.5.2 DNA文库构建及高通量测序 采用细菌16S V4(引物343F-798R)特异引物对DNA样品进行PCR扩增,产物经纯化后构建文库。使用Agilent 2100生物芯片分析系统测定文库平均分子长度及浓度,并通过Real-time PCR对文库进行量化。采用Illumina HiSeq 2500平台对合格文库进行Paired-end测序生成原始双端序列,测序类型为PE250。
1.5.3 生物信息学分析 使用Trimmomatic 软件对原始双端序列进行去杂;使用Vsearch软件聚类得到OTUs的代表序列;使用QIIME软件将代表序列与数据库进行比对注释[10];物种比对注释采用RDP分类算法[11]对代表序列与数据库进行比对,进行物种注释,得到相应的物种信息和基于物种丰度的分布情况。计算细菌群落在门分类学相对丰度、Alpha多样性指数,分析beta多样性,使用R软件绘制出主坐标成分分析图(PCoA),并采用在线分析程序LEfSe寻找组间在丰度上有显著差异的物种[12]。
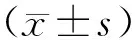
2 结果
2.1 各组大鼠7天生存率 除假手术组外,其余各组大鼠于CLP术后48 h开始陆续死亡,最后假手术组20只大鼠均存活,模型组11只大鼠存活,存活率55%,菌黄保肠合剂组14只大鼠存活,存活率70%,双歧杆菌组13只大鼠存活,存活率65%。与假手术组比较,模型组、菌黄保肠合剂组、双歧杆菌组大鼠存活率显著降低,比较差异均有统计学意义(P<0.05)。模型组、菌黄保肠合剂组、双歧杆菌组3组大鼠存活率组间比较差异均无统计学意义(P>0.05)。见图1。
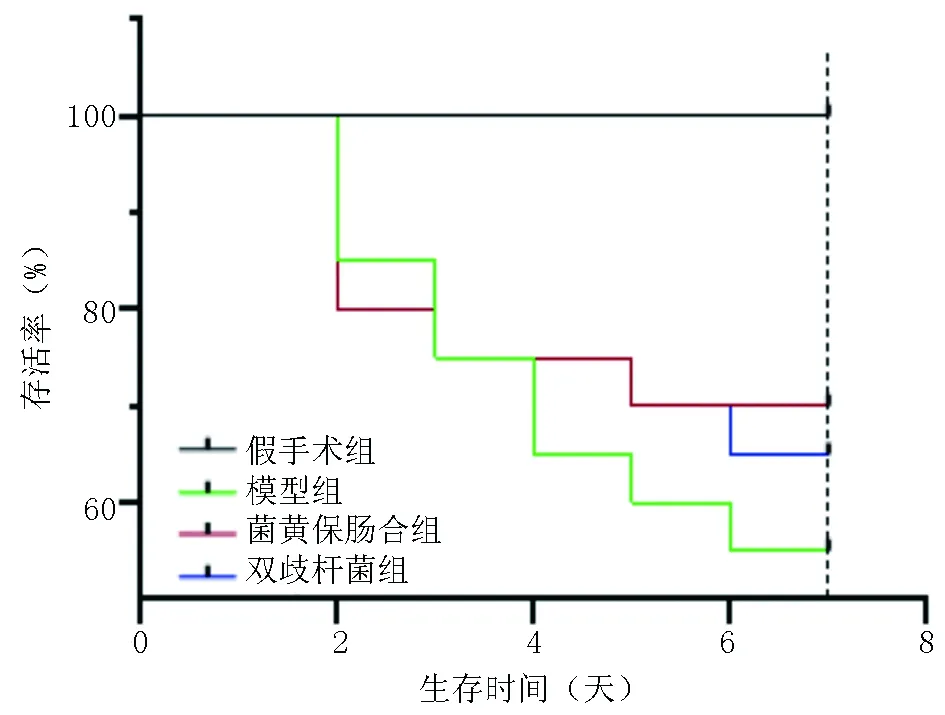
图1 各组大鼠术后7天生存率情况(n=20)
2.2 各组大鼠肠道细菌群落在门分类学水平上相对丰度比较 进行物种注释后,假手术组大鼠通过高通量测序总共检测到了14个门166个属的细菌,门水平相对丰度排在前4位的依次为:厚壁菌门、拟杆菌门、变形杆菌门、放线菌门,它们构成了约99%的序列。模型组、菌黄保肠合剂组及双歧杆菌组大鼠均以厚壁菌门、拟杆菌门、变形杆菌门、放线菌门为优势菌门,但各组组间主要菌门的相对丰度构成比明显不同。与假手术组比较,模型组拟杆菌门、变形杆菌门相对丰度明显上调,厚壁菌门、放线菌门相对丰度明显下调,比较差异均有统计学意义(P<0.05),说明脓毒症造模后肠道微生物群落结构发生显著改变。与模型组比较,菌黄保肠合剂组厚壁菌门相对丰度明显上调,拟杆菌门、变形杆菌门相对丰度明显下调,双歧杆菌组仅变形杆菌门相对丰度明显下调,比较差异均有统计学意义(P<0.05)。与双歧杆菌组比较,菌黄保肠合剂组拟杆菌门相对丰度明显下调,比较差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠肠道细菌群落在门分类学水平上相对丰度比较
2.3 各组大鼠肠道微生态alpha多样性分析 利用Chao1和PD_whole_tree指数评估alpha多样性的参数,鉴于alpha多样性数据不符合正态分布,采用Kruskal-Wallis秩和检验。结果显示,各组组间Chao1和PD_whole_tree指数alpha多样性差异明显。与假手术组比较,模型组Chao1指数和PD_whole_tree指数均有下降,比较差异有统计学意义(P<0.05)。与模型组比较,菌黄保肠合剂组及双歧杆菌组Chao1指数和PD_whole_tree指数上升,比较差异有统计学意义(P<0.05 )。菌黄保肠合剂组与双歧杆菌组Chao1指数和PD_whole_tree指数比较差异均无统计学意义(P>0.05 )。见表2。

表2 各组大鼠肠道微生态alpha多样性分析 M(P25,P75)
2.4 各组大鼠肠道微生态beta多样性分析 将去除嵌合体的序列标准化1800条,随机抽样处理,以Unweighted Unifrac距离进行RDP分类算法与Silva(version123 )数据库比较,得到组间肠道菌群物种组成差异,采用PCoA展示各样品差异性。结果显示,假手术组、模型组、菌黄保肠合剂组及双歧杆菌组大鼠肠道菌群差异通过PCoA分析进行归类,假手术组与模型组在PCoA图上均能各自聚类未发生重叠,说明2组大鼠的肠道菌群beta多样性具有差异。而菌黄保肠合剂组和双歧杆菌组的肠道菌群菌落分布距离部分重叠,说明菌黄保肠合剂组与双歧杆菌组beta多样性差异相对较小。见图2。
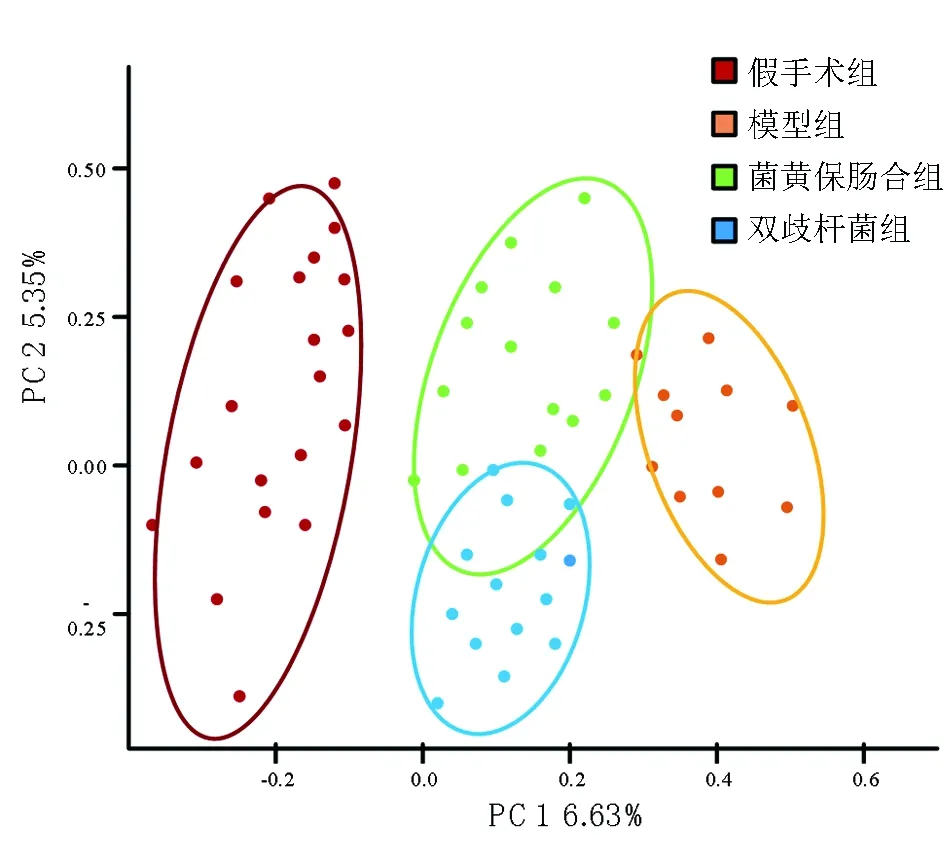
图2 各组大鼠肠道微生态beta多样性分析
2.5 各组大鼠肠道菌群特定菌属的差异分析 使用 LEfSe 软件分析各组之间肠道菌群特定菌属的差异。将LDA值(LDA)设为2.0,大于设定值的为具有统计学差异物种,寻找细菌可能存在的生物标志物差异。结果显示,在属水平分类上,假手术组中厚壁菌门下的Anaerostipes属、Blautia属和疣微菌门下阿克曼氏菌属(Akkermansia)富集;模型组中变形杆菌门下的莫拉氏菌属(Moraxella)、埃希氏菌属(Escherichia),拟杆菌门下的Odoribacter属,普雷沃氏菌 Ga6A1(Prevotellac-eae_Ga6A1_group )富集;菌黄保肠合剂组中厚壁菌门下的粪球菌属(Coprococcus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、瘤胃球菌属(Ruminococcus),毛螺菌科NK4A136(Lachnospiraceae_NK4A136_group),放线菌门下的放线菌属(Actinomycetaceae)富集;双歧杆菌组厚壁菌门下的乳杆菌属(Lactobacillus)、罗斯伯里氏菌属(Roseburia),放线菌门下的双歧杆菌属(Bifidobacterium),拟杆菌门下的副拟杆菌属(Parabacteroides)富集。表明在菌属水平上4组大鼠的肠道菌群特定菌属具有差异。见图3。
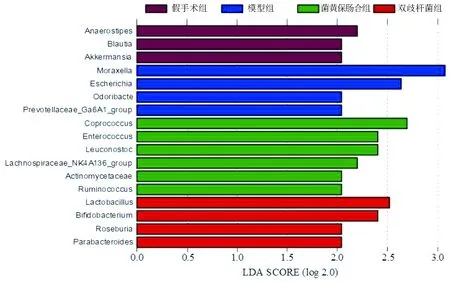
图3 各组大鼠肠道菌群特定菌属的差异分析
3 讨论
脓毒症的发病机制涉及感染、炎症、免疫、凝血等一系列病理生理机制,建立具有脓毒症相似病理生理机制和临床特点的动物模型是开展相关研究的前提条件。CLP模型表现出与人类脓毒症发病因素、病理生理机制以及临床症状的相似特点:宿主对严重感染的反应失调而导致血流动力学改变及全身器官功能障碍,而非细菌和内毒素对机体的直接损伤[13-16]。传统CLP模型具有较高的自然死亡率,动物模型48 h死亡率达到50~70%[17]。从脓毒症模型制备到出现多器官功能障碍并由此引发肠道微生态改变需要一定时间,故本研究在传统CLP模型基础上加入坏死盲肠切除和广谱抗生素抗感染等操作,以建立更符合人类临床脓毒症致肠道菌群微生态变化过程特点的实验模型[18-20]。结果显示,CLP术后12 h大鼠开始出现竖毛、活动减少、嗜睡、蜷缩、饮食减少等表现,术后24 h再次开腹发现结扎端盲肠肿胀,表面颜色紫黑,被网膜包裹,周围肠管表面充血等腹腔内感染表现,通过控制感染治疗后,模型组存活时间延长,病死率下降,与相关文献报道结果基本一致[21]。
肠道微生态由肠道、肠道上皮及黏液、肠内容物质以及肠道菌群构成[22],是肠道菌群与其宿主相互作用的统一体。近年来越来越多的研究显示,中医药与肠道微生态关系密切,两者可互相影响,运用益气健脾、渗湿利水等中药干预后可增加肠道有益菌数量,抑制病原菌生长,维持肠道黏膜上皮完整,提高机体免疫并减轻炎性反应[23-25]。本研究所采用的菌黄保肠合剂是在四君子汤基础上根据大量临床试验研制的医院特色制剂,该方由黄芪、太子参、茯苓、白术、酒炒黄连、薏苡仁、神曲、茵陈、石菖蒲等组成。方中黄芪温补中土而强脾胃,行营气而理脾胃,健中焦而不伤阴;太子参旨在补益脾胃之气而敛阴生津,与黄芪配伍,二者均入脾、肺二经,健运中气而益阴生津,共为君药。白术为补脾胃之要药,长于补气而复健运,除湿并补中土;薏苡仁与茯苓共用,补脾健中,渗湿利水,可“利小便而实大便”。三者并列为臣药,可使君药补益脾胃之功得到进一步加强。黄连归心、脾、胃经,本制剂用炒制,降低其寒性,可用于清中焦湿热而使脾胃得到调和;茵陈善清脾胃湿热;石菖蒲辛温芳香,达醒脾胃、消气滞、化湿浊之功。以上三者为伍,辛开苦降,祛除邪实,标本兼治,共为佐药。神曲作为使药,健脾开胃,可调理气机而缓解食滞。诸药配伍,可顾护脾胃,促进脾胃之气恢复,兼以祛除邪实,寒温并施,标本兼治,使脾胃功能得到进一步加强。从现代药理学的研究上看,该方不仅能够增加人体免疫力[26-27],还兼具调节肠道菌群,促进胃肠功能恢复的作用[28-30]。
脓毒症可改变肠道微生态环境,引起肠道菌群由共生模式向致病模式转变,表现为肠道菌群多样性降低,厚壁菌门和拟杆菌门细菌丰度降低,而艰难梭菌、葡萄球菌属、埃希氏菌属、志贺氏菌属、沙门氏菌属和肠球菌属过度生长[31]。本研究观察到脓毒症大鼠模型中厚壁菌门、拟杆菌门、变形杆菌门、放线菌门等主要菌群结构比例改变,肠道菌群丰度和多样性都有不同程度下降。进一步利用LEfSe法分析假手术组与模型组细菌的群落组成时,发现在属的水平上,厚壁菌门Anaerostipes属和Blautia属、疣微菌门阿克曼氏菌属等维持健康的菌属在假手术组相对富集,而变形杆菌门莫拉氏菌属、埃希氏菌属、拟杆菌门Odoribacter属等条件致病菌和致病菌在模型组增多,与既往文献报告结果相同[32-33]。同时变形杆菌门作为细菌中最大的一个门,包括大肠杆菌、幽口螺杆菌、沙门氏菌等许多致病菌,正常人肠道内不含或含有少量变形杆菌门细菌,而肠道中变形杆菌大量繁殖则反映肠道微生物群落结构失稳[34]。通过补充益生菌可调节肠道菌群平衡,促进肠黏膜的微生物屏障修复,阻止致病菌的入侵从而减轻肠道炎症[35]。本研究中将双歧杆菌活菌胶囊作为阳性对照药对菌黄保肠合剂进行的药效学评价,结果发现两者对肠道菌群结构、外生态多样性影响作用相当,但菌群种属富集方面存在差异,推测双歧杆菌活菌胶囊作用机制为补充正常菌群,而菌黄保肠合剂从细菌与宿主双方因素产生代谢、免疫、炎症等多方面的作用机制选择性刺激正常菌群生长繁殖[36-37]。另有研究发现益生菌双歧杆菌能够保护宿主抵御大肠杆菌感染,但只有能产生醋酸盐的双歧杆菌可发挥这种保护作用,表明在益生菌中细菌行使的功能远重要过细菌所属的种类[38]。因此,研究可进一步深入,明确中药复方在维持脓毒症肠道稳态的靶点机制。
综上所述,脓毒症大鼠肠道菌群结构改变,菌群多样性下调,条件致病菌菌群种类增加,肠道黏膜上皮损伤,是造成脓毒症内源性感染和细菌易位的重要机制,菌黄保肠合剂能够上调有益菌相对丰度,抑制条件致病菌过度生长,减少机会性感染,具有调节脓毒症大鼠肠道微生态的作用。

