国内葡萄白粉病菌对戊唑醇的抗药性研究
高 琪,刘 梅,谭海芸,王 琦,李兴红,张 玮
(1北方果树病虫害绿色防控北京市重点实验室/北京市农林科学院植物保护研究所,北京 100097;2中国农业大学植物保护学院,北京 100193)
0 引言
葡萄白粉病由葡萄钩丝壳菌(Erysiphe necator)引起,广泛分布于世界主要栽培区[1],在国内各葡萄产区均有发生[2]。葡萄白粉病主要为害叶片、幼果等幼嫩器官组织,一般造成减产15%~30%,严重时达70%~80%,在适宜发病的条件下产量损失可达100%[3],严重威胁着葡萄的产量和质量,是葡萄生产上最具破坏性的病害之一[4]。已有研究报道了一些葡萄白粉病的抗病基因,但主要集中在野生葡萄中,到目前为止,生产中尚无高抗白粉病商品化葡萄品种的应用[5]。国内实际生产中的主栽葡萄品种以欧亚种为主,对白粉病普遍较敏感[6-8],因此,化学防治仍然是当前国内葡萄白粉病防治的主要措施。
甾醇脱甲基抑制剂类杀菌剂(sterol C14-demethylase inhibitors,DMIs)因具有田间药效稳定、持效期长、对白粉病的控制效果好等特点,近年来一直是国内葡萄白粉病防控的首选药剂类型[9]。DMIs 类杀菌剂通过杂环上的氮原子与甾醇上的14α-脱甲基酶的血红素-铁活性中心形成配位键[10-11],抑制由14α-脱甲基酶催化的脱甲基反应[12],从而破坏麦角甾醇的合成,造成细胞膜的功能异常和结构损坏,使细胞非正常死亡[13],该类药剂由于作用位点专一和较强的靶标特异性,在田间实际生产中易导致病原菌产生抗药性[14-16]。戊唑醇是国内防治葡萄白粉病使用较多的一种DMIs类杀菌剂,由德国拜耳公司于1986 年研发,2008 年在中国登记用于防治葡萄白粉病。2005年Colcol等[17]最早在美国弗吉尼亚州检测到了葡萄白粉病菌对戊唑醇的抗性。国内已有葡萄白腐病菌[18]、葡萄炭疽病菌[19]等病原菌对戊唑醇产生抗性的报道,尚无葡萄白粉病菌对戊唑醇敏感性的研究。近年来,国内葡萄生产中偶发药剂防控失败的现象,但迄今未见关于葡萄白粉病菌抗药性的报道。检测国内葡萄白粉病菌对戊唑醇的敏感性,对于指导葡萄白粉病的科学用药具有重要意义。
实时荧光定量PCR(quantitative real-time PCR,qPCR)作为一种核酸定量技术,具有快速、高灵敏性、高特异性、高精准度等优点,已被应用于多种病原微生物对杀菌剂抗药性的检测和定量分析[20-21]。此外,由于qPCR 不依赖于微生物的培养,对于专性寄生菌的检测、监测等相关研究具有重要意义。qPCR 方法已用于葡萄霜霉病菌(Plasmopara viticola)[22]、小麦白粉病菌(Blumeria graminis)[23]等对甲氧基丙烯酸酯类杀菌剂抗性等位基因的定量分析。研究表明,戊唑醇抗性菌株的产生主要是由于病原菌内CYP51基因序列的第495 位碱基由A 突变成T(A495T),使得翻译过程中139 位的酪氨酸(Tyr) 被苯丙氨酸(Phe) 取代(Y139F)[24-25]。近年来,已经基于A495T 开发出了葡萄白粉病菌(E.necator)[21]、小麦白粉病菌(B.graminis)[26]对DMIs 类杀菌剂抗药性的快速定量分析方法。Pintye 等[21]使用qPCR 技术对葡萄白粉病菌抗性位点进行检测,表明A495T突变是导致白粉病菌对戊唑醇产生抗性的主要原因,且qPCR 技术可显著提高检测速率并降低成本,比直接测序灵敏度更高[27]。
本研究以葡萄白粉病菌为研究对象,利用qPCR技术检测国内主要葡萄产区葡萄白粉病菌对戊唑醇的抗药性,同时采用孢子萌发法测定其对戊唑醇的敏感性,比较2种方法结果的相关性,探索国内葡萄白粉病菌对戊唑醇抗性动态检测的最适方法,旨在为科学合理使用药剂防控该病害提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株2020 年8—11 月,在国内不同葡萄产区的葡萄白粉病病样上分离纯化得到134株葡萄白粉病菌,其中北京87株、湖南岳阳6株、宁夏银川3株、云南元谋3株、江苏苏州35株。
1.1.2 接种材料 接种材料来自北京市农林科学院温室种植的盆栽葡萄植株,品种为‘夏黑’,选取自上而下第2~4片嫩叶。
1.1.3 药剂及试剂(盒)97%戊唑醇原药,上虞颖泰精细化工有限公司生产。称量0.1000 g原药溶于9.7 mL丙酮中,配制成浓度为1×104μg/mL的母液,4℃保存备用。真菌基因组DNA 提取试剂盒(D1090-02,OMEGA 公司)、QIAquick 胶回收试剂盒(28704,QIAGEN 公司)、pEASY®-T5 Zero Cloning Kit(北京全式金生物技术有限公司)、质粒提取试剂盒(AP-MN-P-250,康宁有限公司)、TB Green®Premix Ex TaqTM(TaKaRa公司)。试验所用试剂均为国产分析纯。
1.1.4 培养基及仪器 水琼脂培养基,琼脂15 g,蒸馏水定容至1000 mL;血球计数板,上海市求精生化试剂仪器有限公司;RXZ-380D 人工气候箱,宁波江南仪器厂;Nanodrop 2000c核酸浓度测定仪,ABI 7500实时荧光定量PCR仪,美国Thermo Fisher公司。
1.2 方法
1.2.1 样品采集与葡萄白粉病菌的纯化扩繁 每个地区至少选择1 个采样点,每个采样点用五点取样法采集病样,选取具有新鲜霉层且病斑分散的病叶,每个采样点采集2~3片葡萄白粉病叶,每个采样点之间间隔50~100 m或选择不同地块。田间采集的每一片葡萄白粉病叶使用自封袋单独包装,在保温箱中用冰袋保鲜带回实验室。葡萄白粉病菌的纯化扩繁参考贾静怡等[8]的方法,在整张叶片上进行。
1.2.2 葡萄白粉病菌对戊唑醇抗性的qPCR检测 采用DNA提取试剂盒提取葡萄白粉病菌的DNA。使用核酸浓度测定仪对提取的葡萄白粉病菌基因组DNA 进行核酸浓度测定,剔除波峰杂乱、杂质多的不合格样品。葡萄白粉病菌对戊唑醇抗性的qPCR 检测参考Pintye等[21]的方法,略有改动。
戊唑醇抗药性检测qPCR 内参基因载体的构建。选择对戊唑醇EC50值最高的5 个菌株,假设其中存在A495T 突变的菌株,使用 EnCYP89F(5'-ATGCATGGGTCCAAGAATT-3')和EnCYP1752R(5'-AACCCTAACACCTGCCATAAA-3')扩增葡萄白粉病菌CYP51基因片段,将其转入pEASY®-T5 Zero 克隆载体,挑取阳性克隆送北京擎科生物公司测序,对测序结果进行序列比对分析,含A495T突变的质粒即为内参基因载体,-20℃保存备用。
qPCR检测。将葡萄白粉病菌的DNA浓度稀释至20~40 ng/μL,利用 L502(5'-CGCCGA AGAGATTTACACTA-3') 和 qEN136R Reverse(5'-TGAGTTTGGAATTTGGACAATCAA-3')检测供试菌株中是否存在A495T 点突变。20 μL 反应体系:TB Green Premix Ex Taq 10 μL、Rox Reference Dye II 0.4 μL、10 μmol/L 正反向引物各0.4 μL、RNase Free ddH2O 6.8 μL、DNA 模板2 μL。反应条件:60℃反应前处理1 min;95℃预变性1 min;95℃变性45 s,60℃退火45 s,共40 个循环;60℃反应后处理1 min。反应结束后检测内参基因质粒和每一供试菌株DNA的扩增曲线和解离曲线,记录循环阈值(Ct值)。
1.2.3 葡萄白粉病菌对戊唑醇的敏感性测定 采用水琼脂平板孢子萌发法进行。将戊唑醇母液用无菌水稀释成适宜的有效成分浓度梯度,混入水琼脂培养基,分别制备成终浓度为0、1、10、25、50、100、200 μg/mL 的含药平板。挑选新鲜、分生孢子状态一致、单斑纯化扩繁的葡萄白粉病叶片,抖动病叶使白粉病菌分生孢子均匀铺在含药水琼脂平板上。每个浓度梯度重复3 皿,以加入相同体积无菌水的水琼脂平板为对照。25℃人工气候箱中培养24 h(对照孢子萌发率在90%以上时),调查各处理的分生孢子萌发情况,当芽管长度超过孢子短半径的一半时视为萌发,每处理随机观察3个以上视野,调查孢子总数不少于200个,分别记录萌发分生孢子数和调查分生孢子总数,计算孢子萌发率(R)、分生孢子相对萌发抑制率(I),见式(1)、(2)。
1.2.4 数据分析 根据内参质粒基因与每一株葡萄白粉病菌DNA经过扩增得到的Ct值,计算出质粒均值,根据式(3)~(4),计算△Ct、△△Ct,求出2-△△Ct。若结果大于1,则视为阳性发生突变,即抗性菌株;若结果小于1,视为阴性为突变,即敏感菌株[21,28]。采用Excel 软件进行数据分析。以含药平板中药剂浓度对数数值为横坐标,分生孢子萌发相对抑制率为纵坐标,进行回归分析,求出戊唑醇的毒力回归方程、相关系数和EC50值。根据各葡萄白粉病菌菌株对戊唑醇的EC50值,与qPCR方法的抗感结果进行相关性分析,见式(3)、(4)。
2 结果与分析
2.1 qPCR法检测国内葡萄白粉病菌对戊唑醇的抗性
使用孢子萌发法测定菌株对药剂的EC50值,不同浓度戊唑醇含药平板对孢子萌发抑制作用如图1 所示。使用qPCR 分子检测技术对国内北京、湖南、江苏、云南和宁夏5 个葡萄种植地134 株经DNA 检测合格的葡萄白粉病菌进行A495T 检测,将检测到A495T突变的菌株确定为抗性菌株,结果表明,134株供试的葡萄白粉病菌菌株中,抗性菌株为47 株,抗性频率为35.07%,敏感菌株87 株,占比64.93%(表1)。所有省份都出现了对戊唑醇表现抗性的葡萄白粉病菌菌株,不同地区菌株的抗性差异较大。

表1 国内葡萄白粉病菌对戊唑醇的抗性
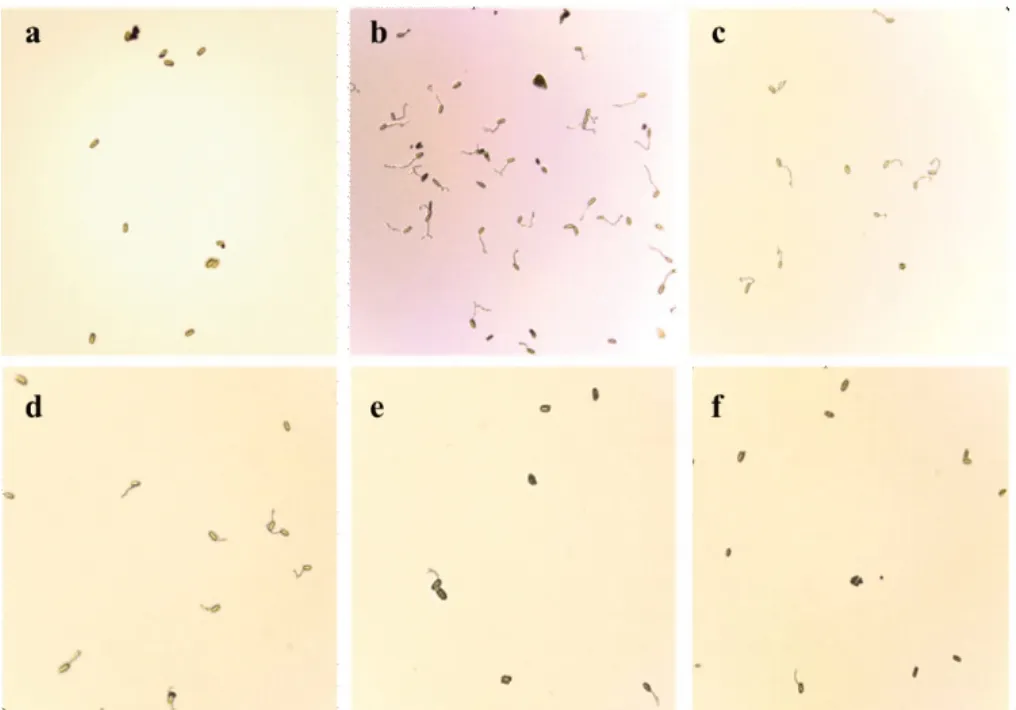
图1 不同浓度戊唑醇含药平板葡萄白粉病菌分生孢子抑制萌发情况
2.2 孢子萌发法检测国内葡萄白粉病菌对戊唑醇的敏感性
使用孢子萌发法测定了国内北京、湖南、江苏、云南和宁夏5个葡萄种植省份134株葡萄白粉病菌对戊唑醇的敏感性,EC50值的范围在0.085~280.917 μg/mL之间,最大值是最小值的3304 倍,整体平均EC50值为(24.208±28.039) μg/mL,标准差较大说明群体中病菌总体的敏感性差异较大。同一省份不同区县菌株对戊唑醇的敏感性差异较大,其中宁夏自治区银川市的菌株间敏感性差异最大,差异倍数达3304;其次分别为北京市房山区、江苏省昆山市,差异倍数分别为22.9和15.5。
将134株菌株的EC50平均值24.208 μg/mL设为1,各地区菌株均值与其比较,北京市朝阳区、平谷区、通州区、房山区,湖南省,云南省,江苏省张家港市菌株的敏感性低于全国供试菌株的平均水平;北京市密云区、江苏省昆山市的菌株敏感性处于居中水平;宁夏自治区菌株的敏感性高于全国供试菌株的平均水平(表2)。

表2 国内葡萄白粉病菌对戊唑醇的敏感性
2.3 葡萄白粉病菌对戊唑醇敏感性2种检测方法的相关性
使用孢子萌发法生物学检测,和通过对已有A495T突变菌株进行克隆连接载体进行的qPCR分子检测,共判定了国内5个葡萄产区134株葡萄白粉病菌对戊唑醇的抗药性。在较高的戊唑醇EC50值下,发生A495T突变的菌株比例逐渐增加(图2)。根据葡萄白粉病菌对戊唑醇EC50值的范围及均值,划分了均值≤1倍(0<EC50≤24.2 μg/mL)、1<均值≤5 倍(24.2<EC50≤121 μg/mL)和>5倍(EC50>121 μg/mL)3个范围。在均值≤1 倍的86 株病菌中,有6 株发生A495T 突变,占6.98%;1<均值≤5 倍的47 株病菌中,有40 株发生A495T 突变,占85.11%;均值>5 倍有1 株病菌发生了A495T突变。
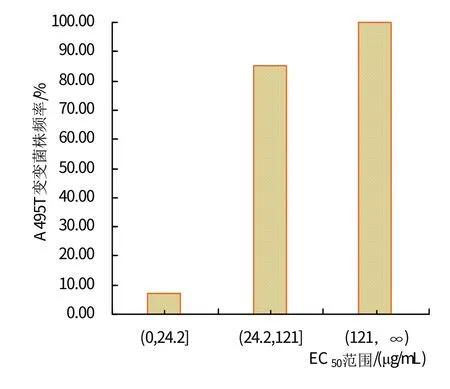
图2 不同EC50范围A495T突变频率
同时检测了2 种方法结果的相关性,将抗性菌株赋值为1,敏感菌株赋值为0,使用SPSS中Spearman相关性分析检测相关性,结果表明相关系数为0.798**,在0.01水平(双侧)上显著相关。
3 结论与讨论
戊唑醇是一种高效的DMIs 类杀菌剂,但频繁使用会使病原菌产生抗药性,甚至导致药剂防效完全丧失。早在1986年,在加利福尼亚就报道了三唑酮对葡萄白粉病的药效下降的现象[29],其次是在纽约、欧洲、加拿大等其他地区出现相关报道[30-32]。近年来欧美国家已经减少DMIs 类杀菌剂的使用,但是抗药性现象依然不容小觑。现阶段已有大量数据表明其所属的DMIs 类杀菌剂抗药性的产生是发生A495T 突变,导致相应蛋白质发生Y136F 突变[25]。本研究采用的qPCR 方法即通过检测葡萄白粉病菌中是否存在A495T突变来判定菌株是否对戊唑醇药剂产生抗性。
明确不同地区菌株对戊唑醇的敏感性,可以用于指导不同地区科学使用戊唑醇防治葡萄白粉病。本研究中采用孢子萌发法和qPCR方法,分别检测了国内5个葡萄种植省份134株葡萄白粉病菌对戊唑醇的敏感性,表明国内葡萄白粉病菌已经出现了对戊唑醇敏感性降低的现象。孢子萌发法检测结果显示,戊唑醇对供试的134株葡萄白粉病菌菌株的EC50范围为0.085~280.917 μg/mL,平均EC50为(24.208±28.039) μg/mL。不同省份(区县)的菌株对戊唑醇EC50的最大值和最小值之比为1.29~3304倍。不同省份(区县)葡萄白粉病结果存在差异。江苏和宁夏2个采样点葡萄白粉病菌对戊唑醇的抗性水平较高,与采样葡萄园频繁使用DMIs类药剂对葡萄白粉病有关,建议当地葡萄生产中减少戊唑醇等DMIs 类药剂的使用,选择其他类型杀菌剂替代和轮换使用;对于云南、北京等抗药性水平较低的地区,建议加强DMIs类杀菌剂的抗药性监测,科学合理使用DMIs 类杀菌剂防治葡萄白粉病,以减缓葡萄白粉病菌对DMIs类药剂抗性的产生。
qPCR检测结果表明,在134株葡萄白粉病菌菌株中,抗性菌株为47 株,抗性频率为35.07%。随着戊唑醇EC50值的增加,具有A495T突变的菌株比例不断增大,说明A495T突变是导致白粉病菌对戊唑醇产生抗性的主要原因,这与Delye等[25]和Pintye等[21]的研究结果一致。Rallos等[24]在研究中发现了无A495T突变,但对DMIs类杀菌剂表现中等至高抗性表型的葡萄白粉病菌菌株,推断CYP51的过量表达可能也是引起葡萄白粉病菌对DMIs类杀菌剂抗性的原因之一。本研究中,在具有较高EC50值的菌株中,即EC50值为均值1~5倍的47 菌株中,有7 株在qPCR 检测方法中未检测到A495T突变,这也可能是CYP51的过量表达造成的。
此外,本研究结果显示,孢子萌发法测定的葡萄白粉病菌对戊唑醇的敏感性结果与qPCR方法检测获得的抗性结果显著相关,因此,上述2种方法均可用于葡萄白粉病菌对戊唑醇抗药性的检测,2 种方法结合应用的结果还可能在对戊唑醇表现抗性的菌株中发现新的抗性位点。而当需在短时间内快速完成大量病原菌的抗药性检测时,可单独采用qPCR方法。

