分离自屠宰场的肺炎克雷伯菌的耐药性分析
赵菲菲,李 杰,韩 宁,谢仕廷,曾振灵*
(1.华南农业大学兽医学院,广州 510642;2.广东省兽药研制与安全评价重点实验室,广州 510642;3.国家兽医微生物耐药性风险评估实验室,广州 510642)
肺炎克雷伯菌(Klebsiellapneumonia) 属肠杆菌科、克雷伯菌属的革兰阴性菌,兼性厌氧,无鞭毛,有较厚的荚膜,已成为仅次于大肠埃希菌的第二大条件致病菌[1]。近年来,由于饲养管理不规范、免疫抑制性疾病频发、滥用抗生素、畜舍饲养密度不合理等,肺炎克雷伯菌对常用抗菌药物的耐药性日益严重,不但呈现多重耐药(multidrug resistant,MDR)现象,且分离率呈逐年上升趋势[2-3],因而限制了细菌感染的治疗选择。同时,肺炎克雷伯菌可致使猪、牛、羊、鸡、水貂、狐狸等动物及人发病,临床上通常表现为脑膜炎、肺炎、败血症、支气管炎等多种病症,造成巨大的经济损失[4-6]。
1875年,Edwin Klebs首次在一例肺炎患者的气道分泌物中分离得到肺炎克雷伯菌;1882年,肺炎克雷伯菌由德国微生物学家和病理学家Carl Friedlander首次报道,因此该细菌一度被称为Friedländer菌[7];1989年和1990年夏秋季,C型肺炎克雷伯氏杆菌病在福建省福州地区部分猪场暴发[8];高倞[9]对河南驻马店地区患呼吸道疾病猪肺、鼻拭子等74份样本中分离得到43株肺炎克雷伯菌,研究发现菌株对氨苄西林、阿莫西林、大观霉素等7种药物耐药性较高,耐药率均在51.2%以上,且呈现多重耐药性。欧冠标等[10]对广西南宁地区采集存栏生猪肛拭子样品125份及宰后生猪肉类样品50份,分别分离得到32及4株肺炎克雷伯菌,发现其对四环素、氯霉素耐药性最高。谭耀荣等[11]从发病母猪组织中分离得到一株肺炎克雷伯菌,菌株接种在血琼脂培养基上会发生α溶血现象,且具有多重耐药性,能够使小鼠在22 h内死亡,表明其具有严重的耐药性和强致病性。
为了解猪源肺炎克雷伯菌的耐药情况,本试验2021年3月从广州市白云区某屠宰场采集猪肺样本150份,通过对菌株的形态学观察、khe基因PCR检测,筛选并鉴定出116株肺炎克雷伯菌。通过对116株肺炎克雷伯菌血清型、耐药性、耐药基因和毒力基因进行检测,为猪源肺炎克雷伯菌的防控提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源 本试验在2021年3月于广州市白云区某屠宰场(猪来源于广东省、湖南省和江西省)采集猪肺样本150份,质控菌株大肠埃希菌ATCC 25922由本药理教研室保存。
1.1.2 主要试剂 LB营养肉汤、麦康凯肌醇阿东醇羧苄西林均购于海博生物技术有限公司,MH琼脂购于广东环凯微生物科技有限公司,引物、DNA Marker均购于擎科生物技术有限公司,2×PCR Mix购于东盛生物科技有限公司,核酸染料购于广州蓝泽生物科技有限公司,革兰染色液购于北京索莱宝科技有限公司,琼脂糖购于西班牙Biowest公司,氨苄西林(含量96.0%)、美罗培南(含量98.0%)、四环素(含量95.0%)等均购于大连美伦生物技术有限公司。
1.1.3 主要仪器 涡旋仪购于杭州海沛仪器有限公司,恒温摇床购于上海智城分析仪器制造有限公司,PCR仪购于苏州东胜兴业科学仪器有限公司,核酸电泳仪购于上海天能科技有限公司,数控恒温培养箱、高速冷冻离心机等均购于赛默飞世尔科技公司。
1.2 试验方法
1.2.1 细菌的分离与纯化 无菌操作取猪肺样本置于LB营养肉汤中,恒温37 ℃、180 r·min-1培养12~16 h用于增菌,再将菌液划线接种于麦康凯肌醇阿东醇羧苄西林琼脂培养基,置于37 ℃恒温培养箱中,培养18 h后挑取呈粉色、菌落湿润、黏液样、拉动呈丝状的疑似菌落转接于麦康凯肌醇阿东醇羧苄西林琼脂培养基中进行纯化,最后挑取纯化后的单菌落于麦康凯肌醇阿东醇羧苄西林琼脂中进行增菌培养,刮取菌苔于30%甘油肉汤中,-20 ℃保存,备用。
1.2.2 形态学观察 一般通过革兰染色进行形态学观察及鉴别菌株。取擦拭干净的载玻片,滴加一滴生理盐水,取纯培养在麦康凯肌醇阿东醇羧苄西林琼脂培养基中的单菌落涂布在载玻片中,烤片固定,经结晶紫初染(1 min,水洗)、碘液媒染(1 min,水洗)、95%乙醇脱色(20 s,水洗)、番红液复染(2 min,水洗)后,镜检观察菌株形态。
1.2.3 样品DNA提取 利用煮沸法[12]提取细菌DNA模板。取增菌培养的菌液50 μL复苏后,置于103 ℃恒温金属浴中加热15 min,转放-20 ℃冰箱中冰浴15 min,高速冷冻离心机中12 000 r·min-1离心2 min,吸取上清液,即为DNA模板,-20 ℃保存,备用。
1.2.4 细菌PCR鉴定 参照参考文献[13]报道的特异性引物(表1),以提取的样品DNA模板进行khe基因扩增,预扩增片段大小为428 bp。PCR扩增体系(总体积为20 μL):2×PCR Mix 10 μL,上、下游引物各0.5 μL,DNA模板2 μL,ddH2O 7 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃再延伸5 min,4 ℃保存。扩增后反应产物经1%的琼脂糖电泳检测,将阳性产物送至广州擎科生物技术有限公司进行测序。

表1 细菌分离鉴定及血清型分型引物Table 1 Primers for bacterial isolation, identification and serotype identification in this study
1.2.5 血清型分型 根据文献[14]设计合成引物,采用PCR方法扩增6种常见的荚膜血清型(K1、K2、K5、K20、K54、K57),引物序列见表1。PCR扩增程序:98 ℃预变性3 min;98 ℃变性15 s,Tm退火15 s,72 ℃延伸20 s,共30个循环;72 ℃再延伸5 min,8 ℃保存。扩增后反应产物经1%的琼脂糖电泳检测,将阳性产物送至广州擎科生物技术有限公司进行测序,结果提交 NCBI(https://blast.ncbi.nlm.nih.gov/)比对。
1.2.6 药敏试验 根据美国临床实验室标准化委员会(CLSI)标准,以大肠埃希菌ATCC 25922为质控菌,利用琼脂扩散法检测13种抗菌药物对肺炎克雷伯菌分离株的最小抑菌浓度(minimum inhibitory concentration,MIC)[15]。检测的抗菌药物:氨苄西林、头孢他啶、头孢噻肟、美罗培南、黏菌素、庆大霉素、阿米卡星、四环素、多西环素、替加环素、环丙沙星、恩诺沙星、复方新诺明。
1.2.7 耐药基因的检测 根据文献[16-19]设计合成引物,对超广谱β-内酰胺酶基因(extended spectrum β-lactamases,ESBLs)(blaCTX-M1)、碳青霉烯类耐药基因(blaKPC-2、blaNDM-1、blaNDM-5)、四环素类耐药基因(tetA、tetB)、磺胺类耐药基因(sul1、sul2)、喹诺酮类耐药基因(oqxA、qnrB、aac(6′)-Ib-cr)进行PCR扩增,PCR扩增引物序列见表2。
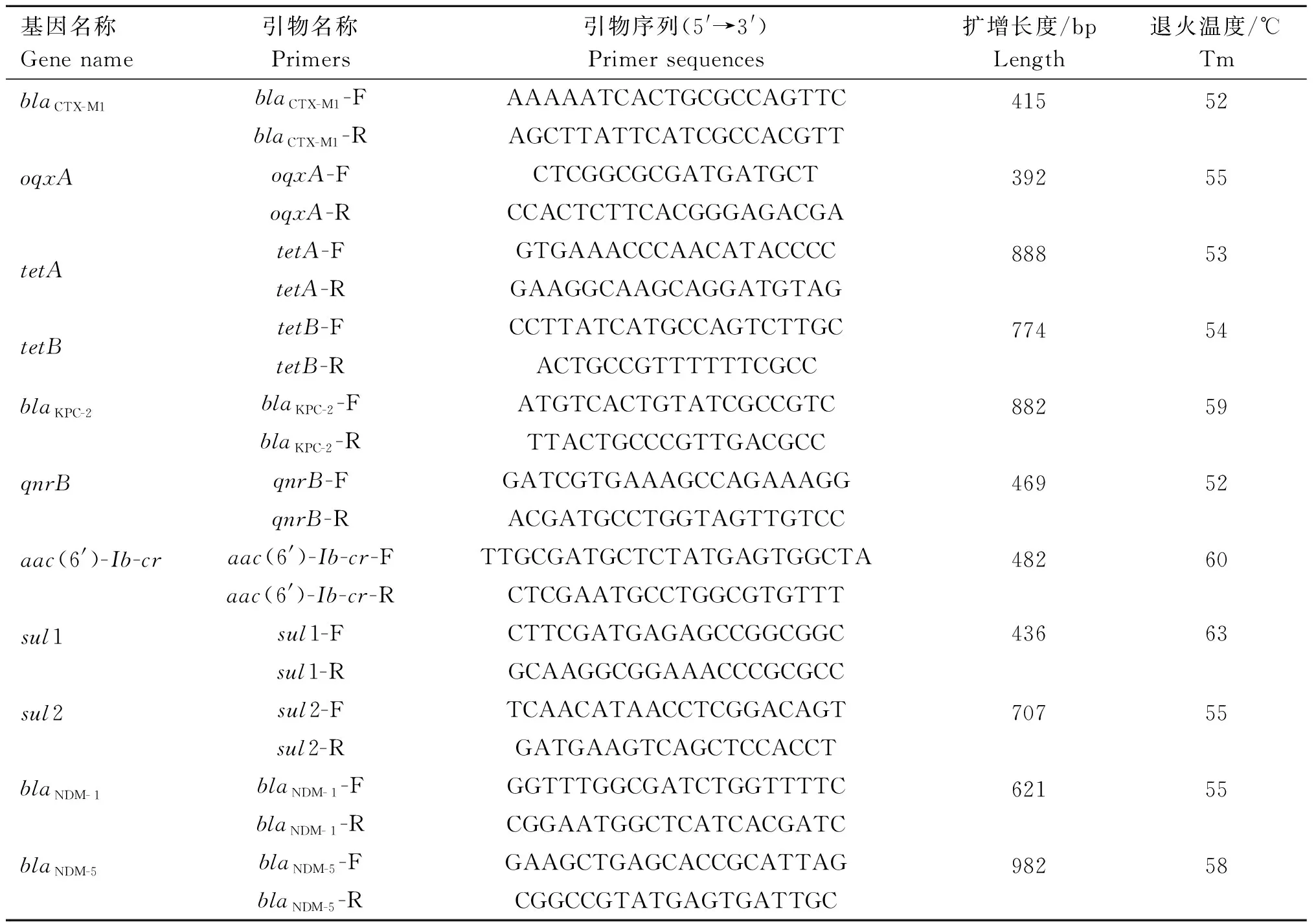
表2 肺炎克雷伯菌耐药相关基因的PCR引物Table 2 PCR primers for drug-resistant genes of Klebsiella pneumoniae
1.2.8 毒力基因的检测 根据文献[16,20-22]设计合成引物,利用PCR扩增技术检测8种常见的毒力基因,包括荚膜多糖生成调节基因(rmpA),铁载体基因(entB、iucA、iroN),菌毛定植黏附基因(ycfM、fimH、mrkD),脂多糖形成相关基因(wabG),PCR扩增引物序列见表3。

表3 肺炎克雷伯菌毒力相关基因的PCR引物Table 3 PCR primers for virulence genes of Klebsiella pneumoniae
2 结 果
2.1 肺炎克雷伯菌分离及鉴定结果
无菌状态下将分离株划线培养于麦康凯肌醇阿东醇羧苄西林平板,可见红色、较大且黏稠的菌落,用接种环挑取时有拉丝的现象。革兰染色镜检菌体呈现红色短杆状,单个排列,偶见两个链状排列,符合肺炎克雷伯菌的形态特征(图1A);样本通过DNA提取及PCR鉴定,116个样品扩增出大小约428 bp的特异性条带,分离率为77.3%,测序结果经过比对分析,确定分离株为肺炎克雷伯菌(图1B),其中,共84株检出常见的血清型,以K57型(59株,50.9%)为主,其次为K5型(20株,17.2%)和K2型(4株,3.5%),未检出K1、K20和K54型(图1C)。
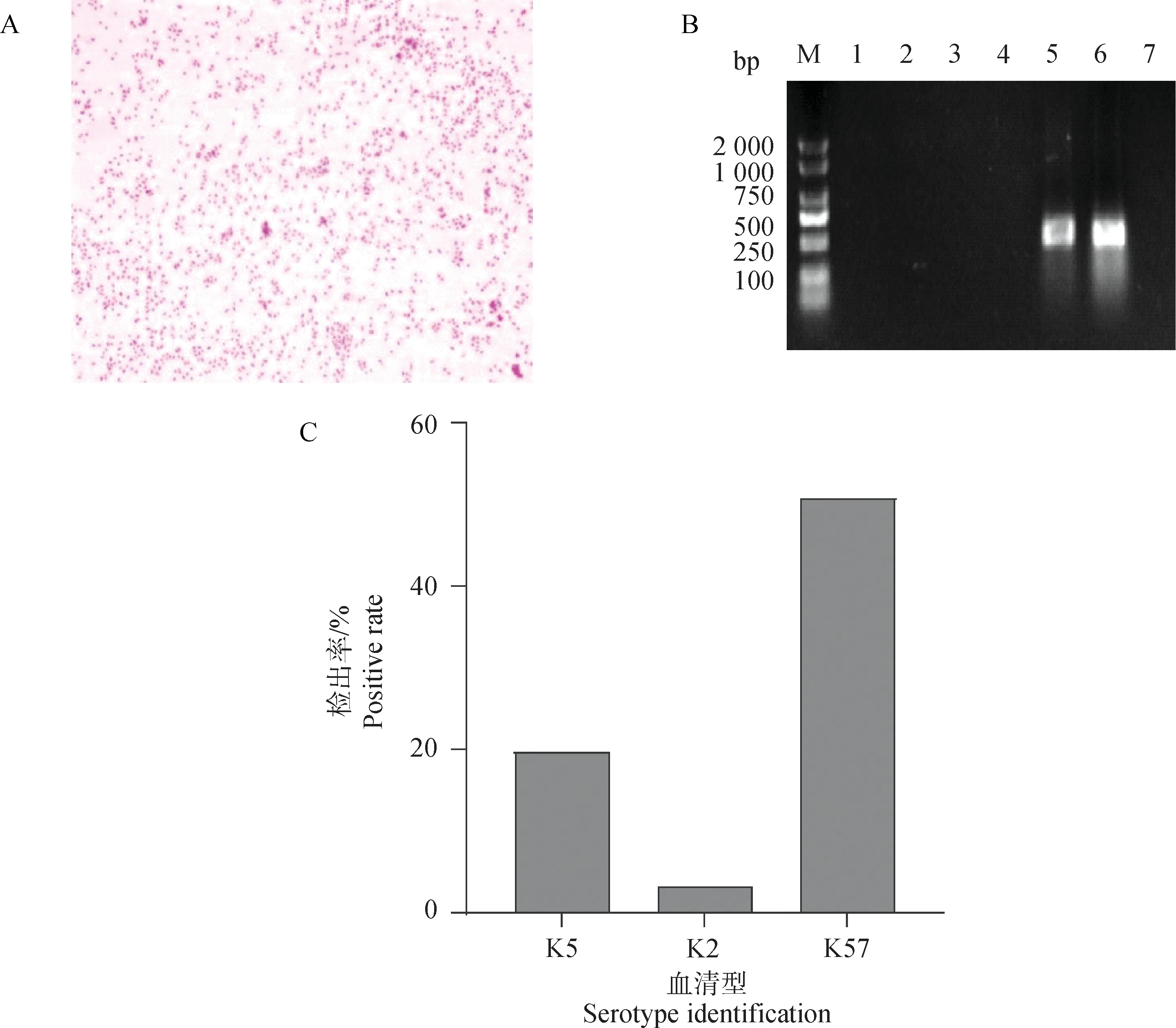
A.革兰染色镜检结果(100×);B.部分分离菌株khe基因鉴定结果(M.DNA相对分子质量标准;1~7.分离菌株);C.常见血清型鉴定结果A. The results of Gram stain microscopy (100×); B. The results of khe gene identification in some isolates(M.DNA marker; 1-7. Isolates);C. The results of common serotype identification图1 细菌分离鉴定结果Fig.1 The results of bacterial isolation and identification
2.2 药敏试验
通过琼脂扩散法,对116株肺炎克雷伯菌进行13种抗菌药物的MIC检测。结果显示,116株肺炎克雷伯菌分离株对四环素、多西环素、氨苄西林及复方新诺明的耐药率较高,分别为96.6%、95.7%、95.7%及94.0%;其次是庆大霉素和环丙沙星,耐药率均为25.0%;对头孢噻肟、替加环素、头孢他啶和阿米卡星的耐药率较低,分别为4.3%、2.6%、1.7%和1.7%;对美罗培南、黏菌素和恩诺沙星均敏感(见图2)。药物敏感性试验结果表明分离株多重耐药现象较为严重,其中耐4种抗生素的菌株最多,占比59.5%,且仅有一株菌表现为对所有检测药物敏感(表4)。
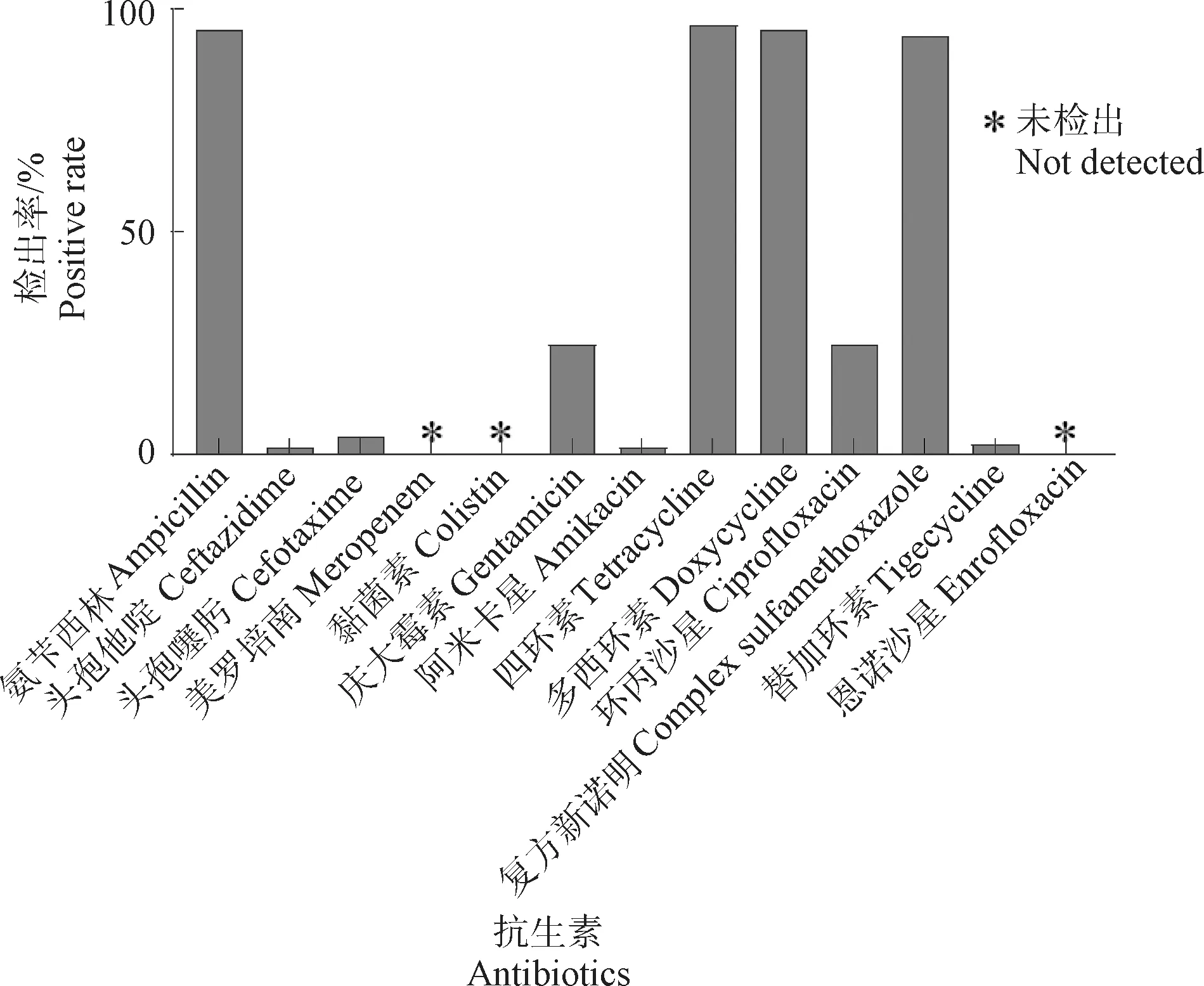
图2 肺炎克雷伯菌药敏试验结果Fig.2 The results of Klebsiella pneumoniae drug sensitivity test
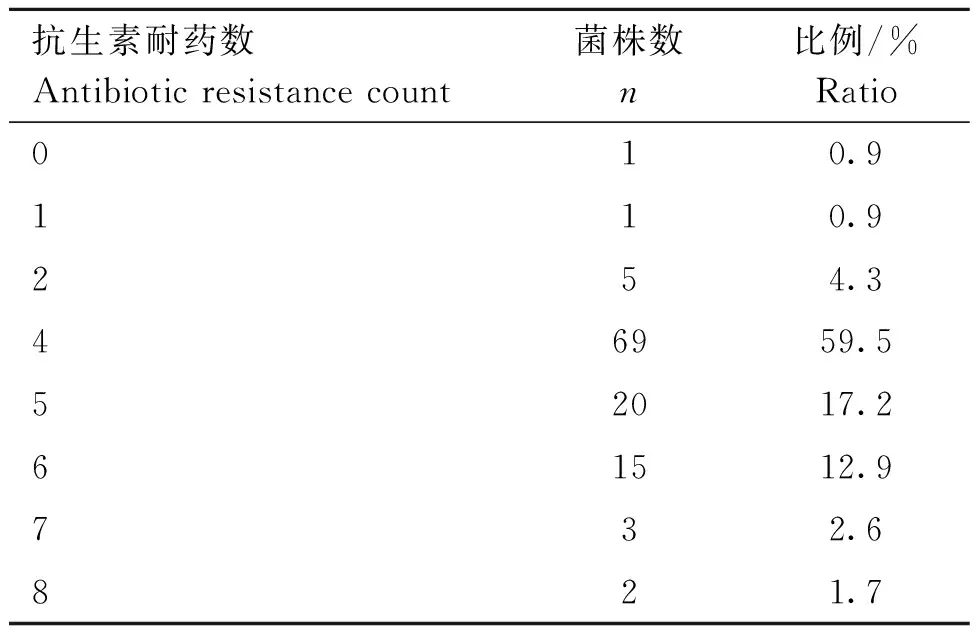
表4 分离株多重耐药携带率分析结果Table 4 The results of multidrug resistance carrying rate analysis of isolates
2.3 耐药基因检测
本研究对116株肺炎克雷伯菌进行了常见的11个耐药基因的检测,结果显示,磺胺类耐药基因sul2的检出率为60.3%(70/116),碳青霉烯酶基因blaNDM-1和blaNDM-5的检出率均为0.9%(1/116),与药敏结果中复方新诺明的高耐药率以及美罗培南高敏感一致;喹诺酮类耐药基因oqxA的检出率为59.5%(69/116)(图3)。

图3 耐药基因检测结果Fig.3 The result of drug resistance genes
2.4 毒力基因检测结果
116株肺炎克雷伯菌中8种毒力基因检出率:荚膜多糖生成调节基因rmpA的检出率为7.8%,铁载体基因entB、iucA、iroN的检出率分别为78.4%、61.2%及1.7%,菌毛定值与黏附基因ycfM、fimH、mrkD的检出率分别为87.1%、35.3%及62.9%,脂多糖形成相关基因wabG的检出率为56.0%(图4)。
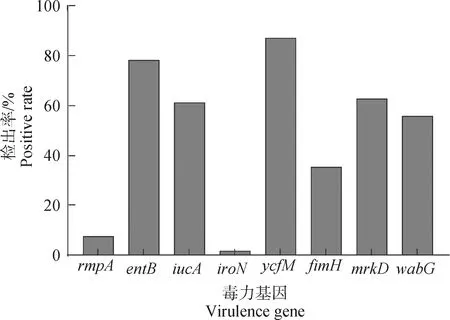
图4 毒力基因检测结果Fig.4 The result of virulence genes
3 讨 论
近年来,随着我国养殖业的迅猛发展,由感染肺炎克雷伯菌而引发临床动物发病的报道也越来越多,给养殖企业带来巨大的经济损失[23]。由于肺炎克雷伯菌的感染与呼吸道疾病相关[24],因此本试验以猪肺为采集对象,共分离到116株肺炎克雷伯菌,分离率(77.3%)较高。血清型检测发现,其中84株(72.4%)为常见血清型,有32株(27.6%)为未分型菌株,表明存在其他血清分型,需进一步鉴定。根据毒力特点肺炎克雷伯菌可分为经典型和高毒力型。因此,本研究通过PEG-344基因[25]鉴定高毒力肺炎克雷伯菌,然而在116株临床分离株中无高毒力型肺炎克雷伯菌(结果未显示)。这表明该屠宰场虽然肺炎克雷伯菌的分离率偏高,但分离株致病性弱。
肺炎克雷伯菌感染机体的过程与其存在的毒力基因相关,如铁载体、菌毛、荚膜、脂多糖等。因此本试验通过PCR对116株分离株进行8个毒力基因检测,毒力基因检测结果显示,菌毛定值与黏附基因ycfM检出率最高(87.1%),其次是铁载体基因entB(78.4%),这与Farzana等[26]报道的1株致新生儿极高病死率的高毒力多重耐药天花克雷伯菌类似,铁摄取系统、菌毛等典型毒力因子检出率都较高。此外,翟祎梦等[27]研究表明,铁摄取对细菌毒力至关重要,ent基因对促进细菌生长和提高其在特定条件的竞争优势具有重要作用。
近年来,由于大量使用抗生素,肺炎克雷伯菌会产生抗生素水解酶,耐药菌株不断出现,导致使用抗生素防治肺炎的难度逐渐加大[28]。通过药敏结果发现,116株肺炎克雷伯菌对四环素、多西环素、氨苄西林、复方新诺明耐药率较高,耐药率均在90%以上,与此4种抗菌药物大量用于猪的疾病防治密切相关;对美罗培南、黏菌素和恩诺沙星均敏感;对其他药物耐药率为1.7%~25.0%。董瑞和孙晓[29]对沧州地区养猪场中分离出的肺炎克雷伯菌耐药性进行研究时,发现对氨苄西林、多西环素和磺胺类药物的耐药率均超过90%;刘海林[30]研究表明,从河南新乡分离的肺炎克雷伯菌对一代头孢类、磺胺类药物和四环素耐药性较强,均与本研究结果一致。从分离菌株的多重耐药结果来看,耐4种抗生素的分离菌株最多,占分离菌的59.5%,与林星宇等[31]报道的结果一致。
鉴于猪场耐药情况严重,为了解肺炎克雷伯菌分离株耐药基因携带情况,本试验共测定ESBLs、碳青霉烯类、四环素类、磺胺类、喹诺酮类5大类耐药基因,其中,磺胺类耐药基因检出率最高,sul2检出率为60.3%,oqxA为59.5%。有趣的是,喹诺酮类耐药基因的高检出率和低耐药率表现不一致,可能是这些耐药基因在菌体内未表达。此现象与尹泽东等[32]报道的大肠杆菌质粒介导的喹诺酮耐药基因检出率与耐药相关性的研究一致。
综上所述,目前肺炎克雷伯菌在猪场中有一定的流行趋势,并且出现不同程度的耐药现象。尤其是对四环素类、β-内酰胺类以及磺胺类抗生素耐药严重,且呈多重耐药现象。因此建议在生产实践中要合理使用抗生素,选用敏感药物如恩诺沙星、黏菌素,避免耐药性的产生。同时应加强饲养管理,创造良好的养殖环境,提高动物机体免疫力,完善饲养程序,提高经济效益。
4 结 论
通过对广东省广州市某屠宰场猪源肺炎克雷伯菌进行调查,发现来自广东省、湖南省、江西省的养殖场中肺炎克雷伯菌感染较为严重。定期对养殖场开展致病性肺炎克雷伯菌的检测和耐药性检测,有助于减少疾病的发生,并为猪源肺炎克雷伯菌感染的防控提供参考依据。

