纳米二氧化钛与磷互作对莱茵衣藻砷累积与生物转化的影响
张鑫,杨帆,于子悦,颜昌宙*
1.中国科学院城市环境研究所城市环境与健康重点实验室
2.中国科学院大学
砷(As)是一种广泛存在于水、大气、土壤、岩石和生物体的有毒类金属,被世界卫生组织(WHO)国际癌症研究机构(IARC)定级为一类致癌物质。As 在天然水体中的浓度范围很大,从小于0.5 µg/L到大于5 000 µg/L 不等,在地表富氧水体中主要以砷酸盐〔As(Ⅴ)〕的形态存在[1]。越来越多的证据表明,即使是在较低的As 暴露水平(10 µg/L)下也会对人体健康产生影响[2]。藻类修复是一种绿色、低成本、可持续的水环境污染原位生物修复方法。浮游藻类细胞壁具有较大的表面积与黏性,可提供多种官能团与As 结合,使其可有效地吸附和富集As 等离子[3]。李妍丽[4]研究了5 种淡水绿藻对As 污染水体的生物修复,发现1.0×107个/mL 藻细胞作用24 h后As(Ⅴ)(1 mg/L)的去除率为68.35%~85.45%,该研究还指出微藻在As(Ⅴ)修复过程主要涉及细胞表面官能团,如羧基、氨基、羟基、磺酸基等。此外,微藻还能通过甲基化等途径对As 进行代谢转化[5],甲基化的As 还可以继续转化成为毒性相对较低的有机砷,如砷糖和砷脂等[6],因而微藻在水体As 污染修复中具有很大的潜力。然而,自然水环境是一个非常复杂的体系,大部分As 与环境中的各种颗粒物(纳米颗粒、腐殖酸等)共存。由于环境物质可能会通过与As 竞争在微藻表面的结合位点[7]、影响细胞膜的渗透性[8]等方式改变As 在藻-液界面的物理化学行为,进而调控As 在藻细胞中的吸附、吸收与形态转化过程。因此,探究环境物质包括纳米颗粒对微藻As 吸收转化的调控作用,对于系统了解微藻对As 的代谢机制及其生态修复功能,具有十分重要的理论价值和现实意义。
纳米二氧化钛(nano-TiO2)因其独特的理化性质在水处理、造纸、纺织等行业中得到广泛应用。预计到2025年,nano-TiO2的年产量约为250 万t[9],这将使其不可避免地暴露于水环境中。根据预测调查,地表水和废水中nano-TiO2浓度为15 ng/L~16 µg/L,高暴露情境下地表水中nano-TiO2浓度可以达到mg/L 级别[10-12]。nano-TiO2因其较大的比表面积与吸附能力,能作为载体促进As 在水生生物(鲤鱼[13]、大型蚤[14]、丰年虾[15])中的摄入,并调控生物对As 的排泄与利用。针对浮游藻类的研究也发现类似的现象,如Luo 等[5]的研究表明,添加nano-TiO2后铜绿微囊藻(Microcystis aeruginosa)和斜生栅藻(Scenedesmus obliquus)对As 的累积和甲基化作用显著增加。Yang 等[16]研究发现,nano-TiO2与As(Ⅴ)共暴露24 h 后,As 在拟微绿球藻(N. maritima)细胞碎屑组分中的分布显著增加,而在细胞器组分中的占比却显著降低,该研究认为细胞壁对纳米颗粒的拦截效应降低了As 对微藻的毒性作用。但是,目前关于nano-TiO2如何影响微藻As 累积与生物利用方面的研究仍相对较少,尤其是As 的代谢转化方面,相关调控机理的揭示仍比较零散,缺乏系统性,有待开展深入研究。
笔者以模式生物——莱茵衣藻(Chlamydomonasreinhardtii)为研究对象,以PO43-为限制性条件,采用电感耦合等离子体质谱(ICP-MS)和高效液相色谱-电感耦合等离子体质谱联用技术(HPLC-ICP-MS)分析藻细胞中As 的累积量以及培养基和藻细胞中As 形态,研究nano-TiO2存在与否条件下,莱茵衣藻对As(Ⅴ) 累积代谢差异,探究nano-TiO2对莱茵衣藻As(Ⅴ)累积和生物转化的调控作用,以期为应用微藻修复As 污染水体提供理论依据。
1 材料与方法
1.1 材料与试剂
研究用nano-TiO2为锐钛矿晶型,其粒径小于25 nm,纯度大于99.7%,购于Sigma-Aldrich 公司。将nano-TiO2粉末分散于超纯水中,配制成1 g/L 的储备液,冰浴超声30 min 后于4 ℃避光保存。试验前,将储备液稀释至2 和20 mg/L,冰浴超声30 min后待用。
采用Na3AsO4·12H2O (国药集团化学试剂有限公司)配制1 mmol/L 的As(Ⅴ)储备液,试验前稀释至10 µmol/L。
1.2 藻种及培养条件
莱茵衣藻购于中国科学院水生生物研究所淡水藻种库,在TAP 培养基(pH=7.0)中悬浮培养,培养温度为25 ℃,光照强度为2 000 lx,光暗比为12 h∶12 h。藻种扩增及培养过程中均采用无菌操作。
1.3 nano-TiO2沉降动力学及对As(Ⅴ)的吸附
采用紫外-可见光分光光度法监测nano-TiO2在不同PO43-浓度TAP 培养基中的动力沉降过程[17]:在nano-TiO2浓度为2 和20 mg/L 纳米混悬液冰浴超声后的0、1、2、4、6、12、24、36、48 h,吸取适量样品在370.5 nm 处测定样品吸光度,以吸光度的变化表征nano-TiO2在不同PO43-浓度TAP 培养基中的动力沉降过程。
将As(Ⅴ)和冰浴超声分散后的nano-TiO2添加到不同PO43-浓度的灭菌TAP 培养基中,使培养基中As(Ⅴ) 终浓度为10 µmol/L,nano-TiO2终浓度为2 和20 mg/L,体系pH 调至7.0 后密闭置于恒温振荡培养箱(25 ℃、175 r/min)中,于0、1、2、4、6、12、24、48 h 取适量样品,12 000 g 离心10 min,稀释、过滤后,使用ICP-MS 测定上清液中As 浓度,通过其变化特征分析计算不同PO43-浓度下nano-TiO2在TAP 培养基中对As(Ⅴ)的吸附。
nano-TiO2在不同PO43-浓度TAP 培养基中对As(Ⅴ)的吸附率和吸附量计算公式如下:
式中:A为吸附率,%;B为吸附量,µg/mg;V为溶液体积,L;C0为As(Ⅴ) 初始浓度,µg/L;Ce为吸附后As(Ⅴ)浓度,µg/L;m为nano-TiO2质量,mg。
1.4 莱茵衣藻试验设置
分别设置了1 个As(Ⅴ) 浓度(10 µmol/L),3 个nano-TiO2浓度(0、2、20 mg/L)和4 个磷酸盐(PO43-)浓度(0.013、0.1、0.5、1.0 mmol/L)进行交叉试验(表1)。PO43-浓度梯度设置,主要参考Zhang 等[18]的研究以及地表Ⅴ类水中PO43-浓度。通过高浓度的PO43-限制藻细胞对游离态As(Ⅴ)的吸收,比较莱茵衣藻对nano-TiO2结合态As(Ⅴ)、游离态As(Ⅴ)吸收与代谢的差异。
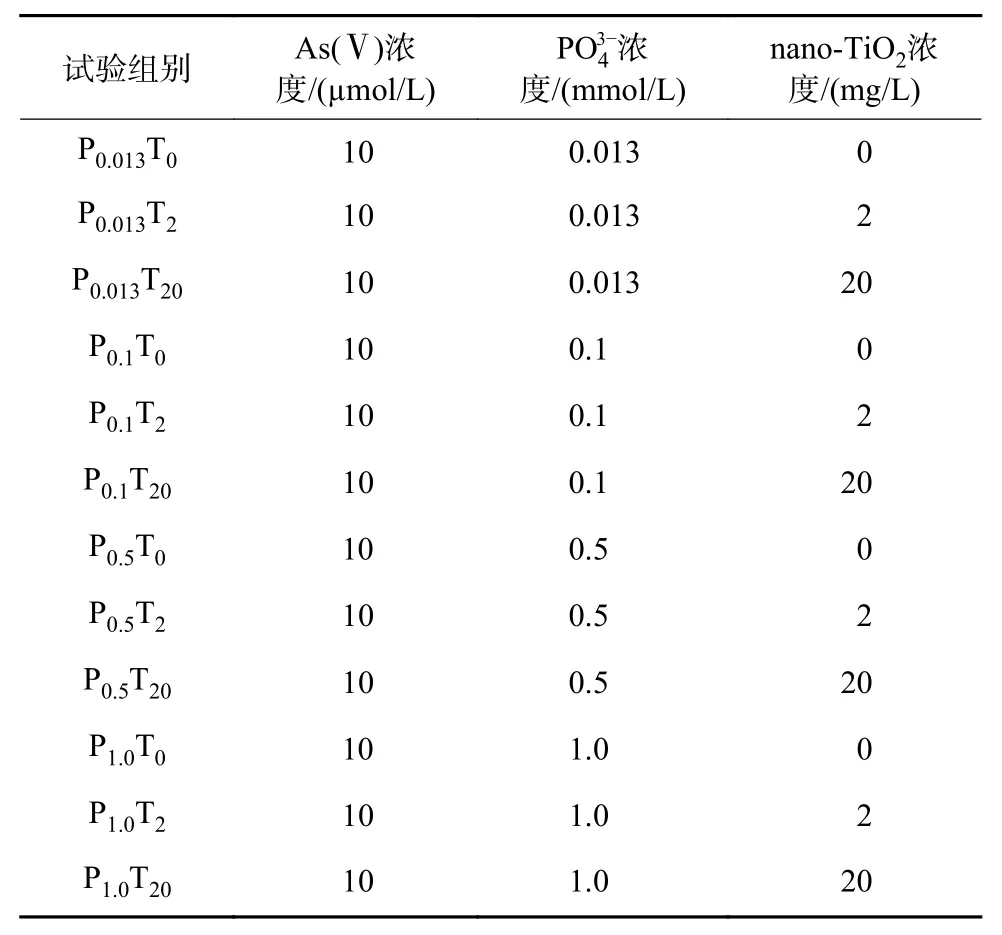
表1 试验分组设计Table 1 Experimental group design
将预培养至对数生长期的莱茵衣藻在4 ℃下于2 500 r/min 离心15 min,弃去上清液,用灭菌的无磷TAP 培养基清洗3 次,去除细胞表面吸附的PO43-。将藻细胞重新分散于无磷TAP 培养基中缺磷驯化3 d,以耗尽藻细胞内储存的PO43-,确保试验不受藻细胞内PO43-的干扰。将达到对数生长期的缺磷莱茵衣藻重悬于200 mL 灭菌TAP 培养基中,接种初始OD680为0.06(藻细胞密度约为1×105个/mL)。各试验组设置3 个重复,培养条件与预培养一致,每天手摇3 次以保证气体交换以及nano-TiO2颗粒与藻细胞充分接触。暴露周期为8 d,每天定时测定藻细胞生长密度,并于第1、4、8 天收集一定量的藻液,测定不同处理条件下生长初期、对数生长期和静止期莱茵衣藻对As 的累积,以及暴露结束时(第8 天)培养基和藻细胞中的As 形态。
1.5 总As 和As 形态分析测定
1.5.1 藻体总As 的测定
取一定量藻液于4 000 r/min、4 ℃下离心15 min 后收集藻细胞,用适量磷酸盐缓冲液〔1 mmol/L K2HPO4、0.5 mmol/L Ca(NO3)2·4H2O 和5 mmol/L MES,pH 为6.0〕和超纯水清洗3 遍以去除莱茵衣藻细胞表面吸附的As。藻细胞冷冻干燥至恒质量后,取5 mg 左右冻干藻样加入纯HNO3-HF 混合液(二者比例为5∶1)共1.2 mL 于微波消解(程序为600 W、2 min;0 W、2 min;450 W、45 min),用2%HNO3定容,经0.22 µm水系过滤器过滤后,采用ICP-MS 测定样品中As 浓度。
1.5.2 培养基与藻细胞中水溶性As 形态的提取与测定
莱茵衣藻暴露8 d 后取一定量的藻液离心,上清液经0.22 µm 水系过滤器过滤后于-80 ℃保存,待测。藻细胞中As 形态的提取参照文献[19-20]的方法:称取一定量冷冻干燥后的藻样,加入2 mL 超纯水为萃取剂,冰浴超声萃取10 min(100 W、40 Hz)后4 000 r/min 离心5 min;重复提取3 次,将离心的上清液合并后定容,提取液经0.22 µm 水系过滤器过滤后于-80 ℃保存,待测。
培养基和莱茵衣藻藻细胞中的As 形态采用HPLC-ICP-MS 测定。将前置保护柱(11.2 mm,12~20 µm)与阴离子交换柱(Hamilton PRP-X100)串联,使用流动相〔10 mmol/L (NH4)2HPO4,10 mmol/L NH4NO3,pH 为6.25〕对各As 形态进行分离,同时配置不同浓度的As(Ⅲ)、一甲基砷(MMA)、二甲基砷(DMA)和As(Ⅴ)混合标准溶液对样品中As 的形态与浓度进行鉴定与分析。检测条件:进样体积50µL,流速1.0 mL/min,运行时间10 min。
1.6 质量控制与数据统计分析
在总As 和As 形态的测定过程中,以45Sc、72Ge和103Rh 为内标元素,以As 的标准曲线进行定量。分析过程中每10 个样品对5.0 和20.0 µg/L As 标准样品进行回测,确保测试信号的稳定性和数据的准确性。总As、As(Ⅲ)、MMA、DMA 和As(Ⅴ) 的检出限分别为0.01、0.07、0.12、0.07 和0.20 µg/L。使用紫菜标准品(GBW08521,中国国家标准材料研究中心)进行质量控制,总As 提取回收率为107.18%±0.43%。
采用Origin 2021b 软件对数据进行处理和作图,运用SPSS 22.0 软件对数据进行统计分析,采用单因素方差分析(one-way ANOVA)检验PO43-和nano-TiO2共同作用下藻细胞密度、As 的累积和As 形态的差异,差异显著性水平设置为P<0.05。所有统计数据均用平均数±标准偏差(mean±SD)表示。
2 结果与讨论
2.1 nano-TiO2在TAP 培养基中的沉降及对As(Ⅴ)的吸附
纳米颗粒在水体中存在团聚、沉降等环境行为,会影响其对水生生物的毒性效应。nano-TiO2在培养基中的保持率为吸光度与初始吸光度的比值。nano-TiO2的浓度对其在TAP 培养基中的沉降性能有着显著的影响。由图1 可知,试验结束时(48 h),20 mg/L 的nano-TiO2在TAP 培养基中的保持率(9.65%±0.87%~13.53%±1.69%)显著低于2 mg/L nano-TiO2(29.60%±0.71%~57.76%±1.14%),这与Brunelli等[21]的研究结果中初始浓度是影响nano-TiO2沉降的主要因素相符。由图1(a) 可知,随着PO43-浓度的增高,2mg/Lnano-TiO2在培养基中的保持率逐渐降低,Li等[22]研究发现nano-TiO2在淡水中的沉降速率与PO43-浓度呈正相关,说明PO43-会降低nano-TiO2在TAP 培养基中的稳定性,从而降低nano-TiO2与莱茵衣藻之间的接触机会。当nano-TiO2浓度为20 mg/L 时〔图1(b)〕,不同PO43-浓度对nano-TiO2在TAP 培养基中的保持率无明显影响,这也说明与溶液中的PO43-浓度相比,nano-TiO2的初始浓度是其沉降的主要影响因素。

图1 nano-TiO2在TAP 培养基中的保持率Fig.1 Retention rate of nano-TiO2in TAP medium
研究表明,nano-TiO2不仅对As 具有很强的吸附能力,还可能通过改变细胞表面特性影响藻类对As 的摄取以及影响微藻对As 后续的生物代谢[23-24]。nano-TiO2在不同PO43-浓度的TAP 培养基中对As(Ⅴ)的吸附如图2 所示。nano-TiO2对As(Ⅴ)的吸附分为快速吸附和吸附平衡2 个阶段。nano-TiO2浓度相同时,由于PO43-与As(Ⅴ) 的相似性,PO43-会与As(Ⅴ) 竞争nano-TiO2上的结合位点,nano-TiO2对As(Ⅴ)的吸附率随PO43-浓度的升高而降低。当达到吸附平衡时,2 mg/L nano-TiO2在不同PO43-浓度TAP 培养基中对As(Ⅴ) 的吸附率为6.92%±0.60%~18.10%±2.27% , 吸附量为(2.60±0.22)~(7.04±0.88) µg/mg ; 20 mg/L nano-TiO2对As(Ⅴ)的吸附率显著高于2 mg/L,吸附率为19.25%±1.28%~35.31%±1.08%,吸附量为(0.69±0.05)~(1.23±0.04) µg/mg。采用准一级和准二级动力学方程来预测吸附过程的机理,公式如下:
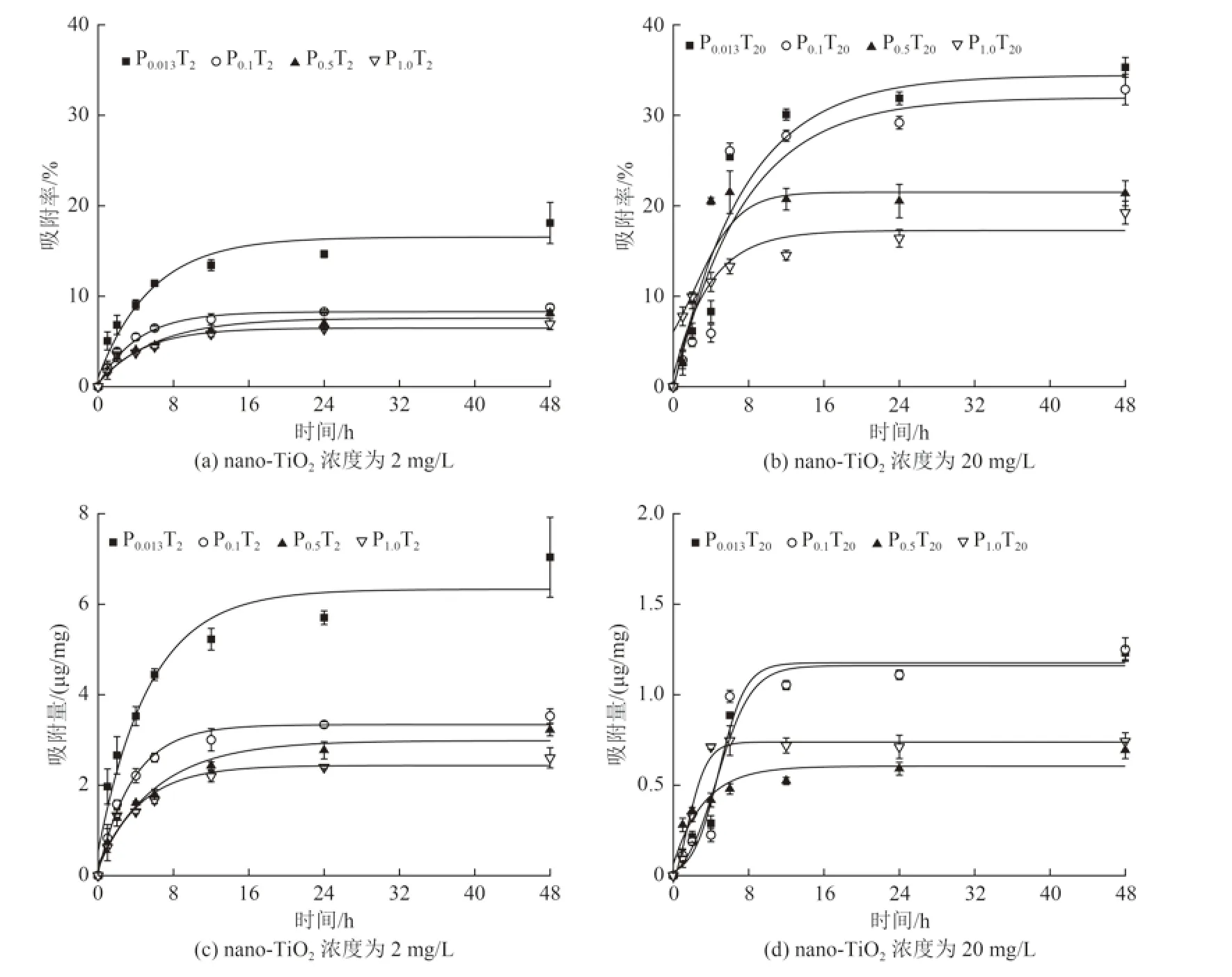
图2 nano-TiO2在TAP 培养基中对As(Ⅴ)的吸附率及吸附量Fig.2 Adsorption rate and adsorption capacity of As(Ⅴ) of nano-TiO2in TAP medium
准一级动力学方程
准二级动力学方程
式中:t为吸附时间,min;qt为t时刻nano-TiO2对As(Ⅴ)的吸附量,mg/g;qe为吸附平衡时,nano-TiO2对As(Ⅴ) 的吸附量,mg/g;k1为准一级动力学方程速率常数,g/(mg·min);k2为准二级动力学方程速率常数,g/(mg·min)。
从表2 可知,准一级动力学与准二级动力学均能较好地拟合nano-TiO2在不同PO43-浓度的TAP培养基中对As(Ⅴ)的吸附过程,但是准二级动力学的R2大于准一级动力学,对该过程的描述相对更为精准,这说明,nano-TiO2对As(Ⅴ)的吸附速率受化学吸附控制,Wagle 等[25-26]的研究也得到类似的结果。

表2 不同条件下的吸附动力学参数Table 2 Adsorption kinetic parameters under different conditions
2.2 nano-TiO2和PO43-互作对莱茵衣藻生长的影响
不同浓度PO43-对莱茵衣藻藻密度影响随时间变化如图3 所示。从图3 可知,在8 d 的培养期内,P0.5T0和P1.0T0处理组藻密度没有明显差异,但是随着PO43-浓度的降低(P0.1T0和P0.013T0处理组)莱茵衣藻生长受到显著抑制。试验后期(5 ~8 d),P0.1T0和P0.013T0处理组藻密度仅有P1.0T0处理组的77.01%~84.00% 和17.00%~20.86%。这可能是因为PO43-为微藻生长必需的营养盐,充足的PO43-有利于藻细胞的生长。在PO43-浓度为0.1、0.5 mmol/L时,与无nano-TiO2添加组相比,2 mg/L nano-TiO2暴露对莱茵衣藻生长没有显著影响,2 个处理组藻密度没有显著性差异(P>0.05);但随着nano-TiO2浓度增至20 mg/L,P0.1T20和P0.5T20处理组生长受到显著抑制〔图3(b)、图3(c)〕,其藻密度仅是无nano-TiO2添加组的81.96% 和74.27%。研究表明[23,27],nano-TiO2团聚物会附着在藻细胞表面,这可能会减少被包裹的藻细胞所能获得的光和养分,从而抑制其生长。Chen 等[23]还发现nano-TiO2在莱茵衣藻藻细胞表面的团聚作用呈现剂量效应,浓度越高团聚体数量越多。这也在一定程度上解释了本研究中nano-TiO2浓度与藻生长所受抑制之间的关系。而对P0.013T20组而言,高浓度nano-TiO2(20 mg/L)与相对低PO43-浓度(0.013 mmol/L)共同作用,使得莱茵衣藻在试验初期就停止了生长,因此图表中无P0.013T20试验组数据。但P1.0T20处理组藻细胞的生长并未受到nano-TiO2浓度升高的影响〔图3(d)〕,这可能是因为充足的PO43-促进了藻细胞的生长,减轻nano-TiO2对藻细胞抑制作用。
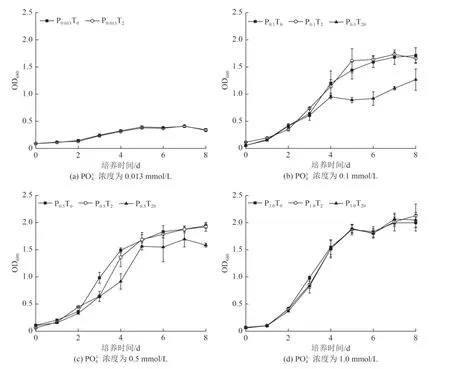
图3 不同PO43-及nano-TiO2浓度下莱茵衣藻的藻密度变化Fig.3 Density changes of Chlamydomonas reinhardtii under different concentrations of PO43- and nano-TiO2
2.3 nano-TiO2与PO43 -互作对莱茵衣藻As 累积效果的影响
不同处理下莱茵衣藻细胞不同生长阶段对As 的累积如图4 所示。由图4 可知,暴露初期(第1 天),P0.013T0、P0.1T0处理组莱茵衣藻As 累积量为分别为(40.34±6.68)和(50.21±2.94)µg/g,显著高于P0.5T0和P1.0T0处理组〔(12.89±0.98)和(21.61±5.56)µg/g〕(P<0.05)。经饥饿处理的微藻恢复到适宜生长的条件后,由于超补偿效应会显著增加对营养盐的吸收[28],且砷酸盐与磷酸盐有着相同的内化机制,能通过多种磷酸盐转运蛋白进入藻体[29],因此在0.013 和0.1 mmol/L PO43-处理条件下,As(Ⅴ) 在与PO43-的竞争转运系统中占优势,同时藻细胞倾向于合成更多的磷酸盐转运蛋白以减轻磷限制[30-31],进而促进了As 的累积。Wang 等[32]研究了不同PO43-浓度下杜氏盐藻对砷酸盐的累积动力学,亦发生类似的现象。而在第4、8 天,P0.013T0、P0.1T0处理组As的累积水平和变化规律与P0.5T0和P1.0T0处理组规律基本一致,这可能和微藻的超补偿作用随培养时间的延长而降低有一定的关系[33]。
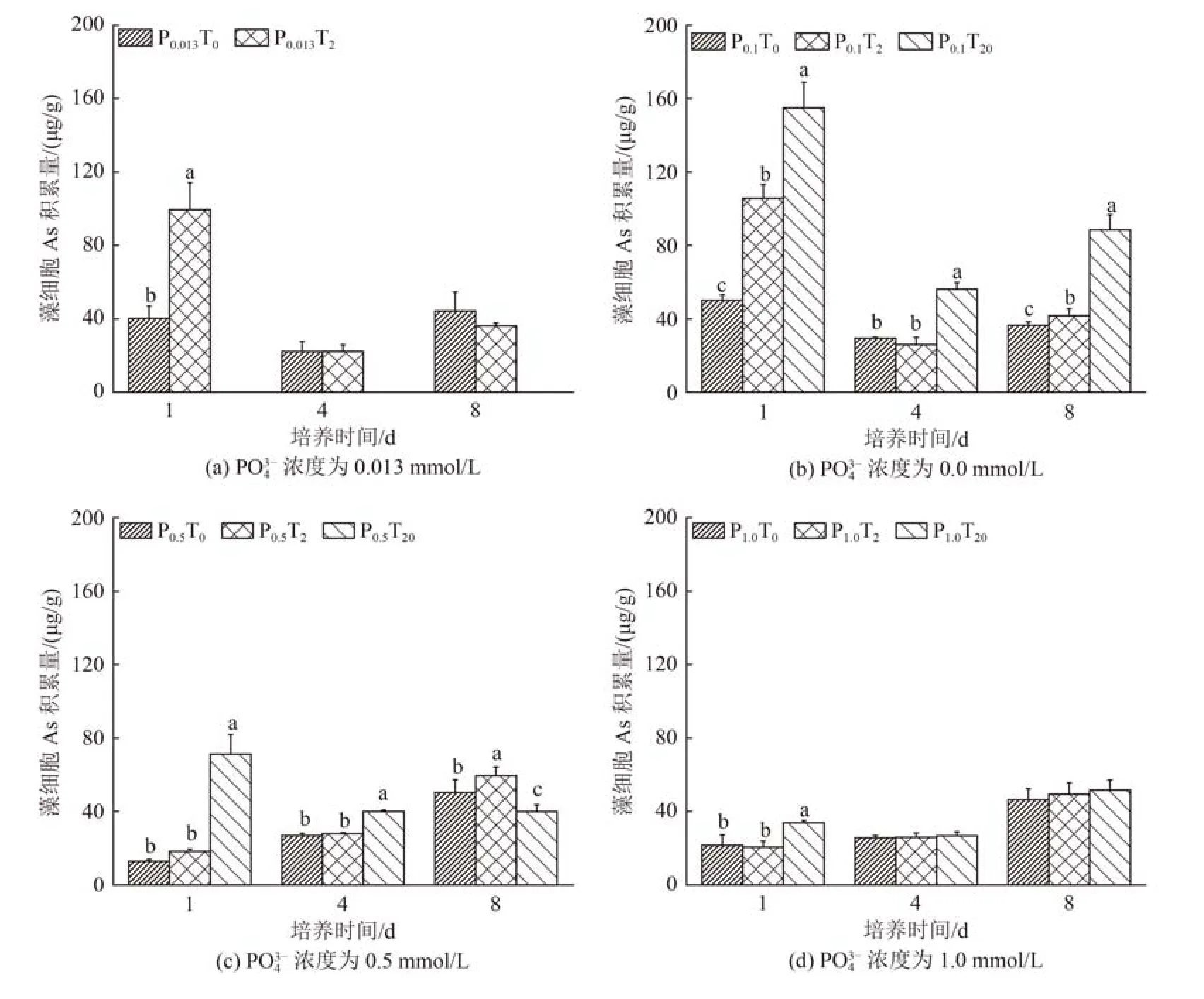
图4 不同处理下莱茵衣藻细胞不同生长阶段对As 的累积Fig.4 As accumulation in Chlamydomonas reinhardtii cells at different growth stages in different treatments
Nano-TiO2的加入显著促进了第1 天0.013、0.1 和0.5 mmol/L PO43-处理条件下藻细胞对As 的累积,且随着nano-TiO2浓度的升高,藻细胞对As 的累积量也随之增加。尤其是0.013、0.1 mmol/L PO43-浓度下,P0.013T2处理组〔(99.62±14.57)µg/g〕的藻细胞As 累积量是P0.013T0处理组〔(40.34±6.68)µg/g〕的246.95%,P0.1T2〔(105.70±7.58)µg/g〕和P0.1T20〔(155.01±13.93)µg/g〕处理组的藻细胞As 累积量分别是P0.1T0处理组〔(50.21±2.94)µg/g〕的210.52%和308.72%。nano-TiO2对As 很强的吸附能力[26],可作为载体促进藻细胞对As 的累积。Luo 等[34]在研究nano-TiO2对铜绿微囊藻和斜生栅藻As 生物利用和转化的影响中也发现了类似的结果。与PO43-浓度为0.013、0.1 和0.5 mmol/L 的处理组不同,1.0 mmol/L PO43-处理条件下nano-TiO2的载体效应暴露初期较低,这可能是因为高浓度 PO43-(1.0 mmol/L)条件下nano-TiO2对As 的吸附率较低(图2)、载体效应不明显所致。同时,研究表明,As(Ⅴ)、PO43-与nano-TiO2在藻细胞表面有着相同的结合位点(—COOH和—NH2)[35-38]。高浓度的PO43-(1.0 mmol/L)在一定程度上抑制了As(Ⅴ)、nano-TiO2在莱茵衣藻上的吸附,进而降低了纳米的载体效应,从而导致藻细胞对As 的累积量不高。
对数生长期(暴露第4 天),培养基中PO43-浓度为0.013 和0.1 mmol/L 时,P0.013T2处理组藻细胞中As 累积量〔(22.21±3.72)µg/g〕仅有第1 天累积量的22.29%,P0.1T2处理组藻细胞中As 累积量〔(26.02±3.95)µg/g〕仅有第1 天累积量的24.62%。这可能是因为随着培养时间的延长,nano-TiO2的载体效应呈降低趋势。李金丽等[39]的研究表明,nano-TiO2在SM7 培养基中迅速团聚成大颗粒并发生沉降。本试验结果也表明,48 h 后2、20 mg/L nano-TiO2在培养基中的保持率分别仅有29.60%~57.76%和9.65%~13.53%,这将不利于nano-TiO2颗粒携带As 进入藻细胞。微藻因其较大的比表面积及较多的官能团,可以吸附、吸收水环境中的金属离子和纳米颗粒而被广泛应用于水处理中。从本试验的结果来看,在0.013、0.1 mmol/L PO43-浓度下,nano-TiO2持续暴露1 d 均能有效促进藻细胞对As 的吸收与吸附。其中,0.1 mmol/L PO43-条件下微藻能耐受更高浓度的nano-TiO2(20 mg/L),且获得更高的累积量。但是,0.1 mmol/L PO43-显著高于自然环境下PO43-浓度,在去除As 污染的同时可能会增加水体磷负荷。因此,在应用微藻和纳米材料处理As 污染水体时,应合理设置PO43-浓度以及藻细胞、纳米材料和As 作用时间,以获得最佳的As 去除率。
2.4 nano-TiO2与PO43-互作对莱茵衣藻As 生物转化的调控作用
不同处理下莱茵衣藻细胞中各As 形态占比如图5 所示。由图5 可知,培养8 d 后,P0.1T0、P0.5T0和P1.0T0处理组藻细胞内检测到的水溶性As 有As(Ⅲ)、As(Ⅴ)和DMA,但是P0.013T0处理组仅检测到As(Ⅴ),这可能是因为缺磷条件下藻细胞膜的完整性水平降低[40],As(Ⅴ)还原生成的As(Ⅲ)更易排出藻细胞所致。Wang 等[41]研究了不同PO43-浓度下铜绿微囊藻对As 的吸收和净化,也发现低磷条件下藻细胞中As 的外排速率显著高于富磷条件。

图5 不同处理下莱茵衣藻细胞中各As 形态占比(第8 天)Fig.5 Percentage of As speciation in Chlamydomonas reinhardtii cells in different treatments (Day 8)
值得注意的是,添加nano-TiO2后,PO43-浓度为0.1、0.5 和1.0 mmol/L 的处理组中藻细胞内除As(Ⅲ)、As(Ⅴ)和DMA 外还检测到一种未知As 形态(图5)。根据张金羽等[19,42]的研究,该未知的As 形态是含氧砷糖的一种——磷酸砷糖(phosphate arsenosugar)(图6)。这表明nano-TiO2的存在,使得As(Ⅴ)在莱茵衣藻细胞中的生物转化途径发生了转变。Miyashita 等[43]研究发现脂溶态砷化物——磷脂酰砷糖的基本结构中包括甘油砷糖和磷酸砷糖,并指出砷糖可能是合成砷脂的前体化合物。Ender 等[44]认为砷糖能实现某些基本的细胞功能,比如结合到细胞膜结构中。纳米颗粒能够通过大量积累活性氧(ROS)、物理化学作用或酶活性调节破坏细胞磷脂双分子层结构[45],导致磷脂降解,降低细胞膜的完整性、流动性和选择性。nano-TiO2与细胞膜相互作用可能会促进某些酶的表达(arsM 等[46]),进而促进莱茵衣藻砷糖的生物合成。而且在nano-TiO2浓度相同时,随着PO43-浓度的降低,藻细胞内砷糖所占的比例逐渐增加(图5)。Glabonjat 等[47]的研究也得到类似的结果,富磷条件导致PicocystisML 菌株砷糖下调,反之上调。这在一定程度上印证了nano-TiO2和磷限制处理可以促进藻细胞合成含氧砷糖等化合物来代替实现PO43-的功能这一推测。与PO43-浓度为0.1、0.5 和1.0 mmol/L 的处理组不同,P0.013T2组藻细胞内仅检测到As(Ⅴ) 和As(Ⅲ),这可能是因为nano-TiO2和缺磷共处理使莱茵衣藻生长受到抑制,无法进行无机As 的甲基化。
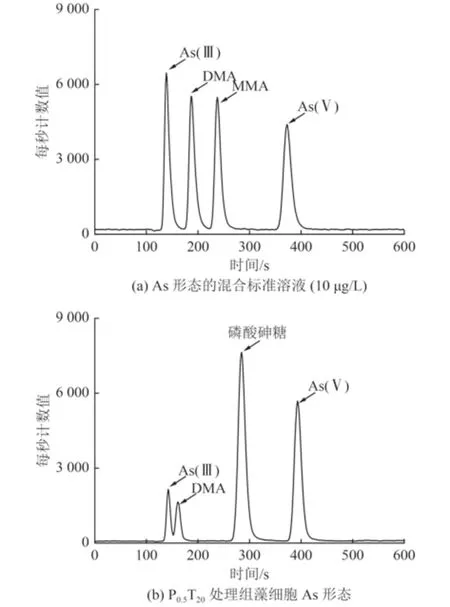
图6 不同形态As 的HPLC-ICP-MS 谱图Fig.6 HPLC-ICP-MS spectra of As species
2.5 nano-TiO2与PO43 -互作对莱茵衣藻As 外排的调控作用
莱茵衣藻可以对As(Ⅴ)进行吸收、转化以及外排。经过8 d 的暴露,培养基中主要检测到的As 形态为As(Ⅴ)和As(Ⅲ),0.1和0.5 mmol/LPO43-处理组中还有少量DMA(图7)。Guo 等[48]的研究也发现铜绿微囊藻在磷有限和富磷条件下培养基中仅观察到DMA 和无机砷。笔者认为这可能是因为MMA只是作为As(Ⅴ) 生物转化的中间体被迅速转化为DMA[49],也说明DMA 这种甲基砷形态在As 的生物转化中的优势。
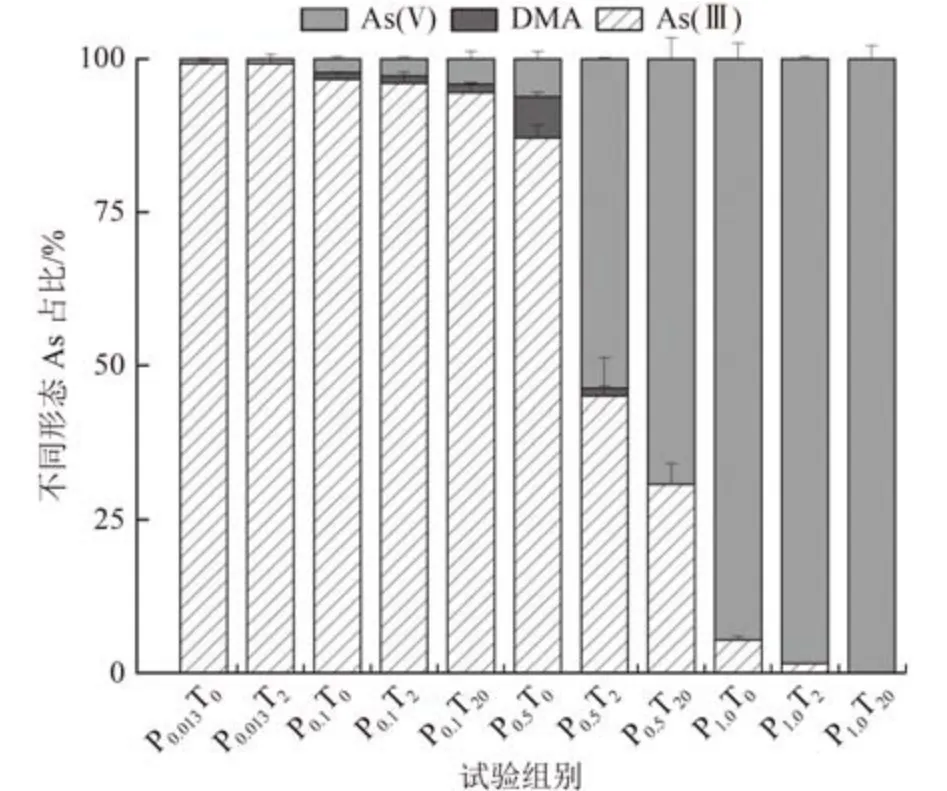
图7 不同处理下培养基中各As 形态占比(第8 天)Fig.7 Percentage of As species in culture medium of different treatments (Day 8)
PO43-浓度对培养基中As 的形态有很大影响。随着PO43-浓度从0.013 mmol/L 增至1.0 mmol/L,培养8 d 后单独的PO43-处理组培养基中As(Ⅲ)的浓度分别为(744.24±3.42)、(710.38±8.60)、(577.04±13.95)、(33.56±3.30)µg/L,分别占培养基中总As 浓度的99.19%、96.66%、87.10%和5.38%,呈显著下降趋势(图7)。Zhang 等[18]在研究不同PO43-浓度下蓝藻对As 的氧化还原时也发现了同样的现象。由于PO43-与As(Ⅴ)的结构类似,在微藻对As(Ⅴ)的吸收与吸附过程中存在竞争效应。随着PO43-浓度降低,藻细胞对As(Ⅴ)的吸收增加[18],进而促进了As(Ⅲ)的还原与外排。研究表明[30],莱茵衣藻对As(Ⅲ)的耐受性(EC50为132.2 mg/L)[50]高于As(Ⅴ)(33.5 mg/L)。因此,在0.013 和0.1 mmol/L PO43-浓度下,虽然培养基中As(Ⅲ)的浓度和占比显著提高,但是对莱茵衣藻生长没有显著影响。
与单独的PO43-处理组相比,nano-TiO2和PO43-共处理组培养基中As(Ⅲ) 占比和浓度随着nano-TiO2浓度的增加而降低,尤其是0.5 mmol/L PO43-浓度下,2 和20 mg/L nano-TiO2添加组培养基中As(Ⅲ)占比分别为44.99% 和30.76%,显著低于PO43-单独处理组(87.10%)。微藻能够将As(Ⅴ)在细胞内还原为As(Ⅲ)并进行甲基化,Xue 等[42]研究利用Synechocystissp. PCC6803 证明了DMA 参与砷糖的生物合成。细胞内的As 形态结果表明,nano-TiO2添加组砷糖为主要形态的As,这可能是由于其暴露细胞内还原的As(Ⅲ)作为底物参与砷糖的生物合成,而不是简单的外排。此外,Chen 等[51]将斜生栅藻暴露在2 mg/L的nC60 中,发现在各亚细胞组分中纳米颗粒在藻细胞壁(细胞碎屑中的一部分)中占比最高;Geitner 等[52]做了类似的研究,也观察到金纳米粒子主要分布于小球藻细胞壁组分中。这些研究结果均表明细胞壁是藻细胞阻挡纳米颗粒的主要屏障,进而抑制藻细胞对纳米结合态As(Ⅴ) 的吸收、还原与外排。而且,细胞壁对纳米材料的拦截作用在一定程度上也可以解释以下现象,即相同PO43-浓度下培养基中As(Ⅲ)占比随着nano-TiO2浓度的增加而降低,因为nano-TiO2对As(Ⅴ) 的吸附随纳米颗粒浓度的增加而增加。
3 结论
(1)莱茵衣藻生长受PO43-和nano-TiO2共同影响,0.013 mmol/L 的PO43-和20 mg/L 的nano-TiO2均能显著抑制藻细胞的生长。
(2)暴露初期(1 d),nano-TiO2的添加显著促进了PO43-浓度为0.013、0.1 和0.5 mmol/L 时藻细胞对As 的累积,且随着nano-TiO2浓度的升高,藻细胞对As 的累积量也随之增加。但是随着培养时间的延长,nano-TiO2的载体效应逐渐降低。因此,在应用微藻和纳米材料处理含As 废水时,应合理设置微藻、nano-TiO2和As 作用时间以获得最佳的去除率。
(3)当nano-TiO2存在时,进入藻细胞的As(Ⅴ)除了还原成As(Ⅲ)并甲基化生成DMA 外,还能转化为结构更复杂、毒性更低的砷糖;且随着PO43-浓度的降低,藻细胞内砷糖所占的比例逐渐增加,这可能会抑制As(Ⅲ)的外排。此外,nano-TiO2对As(Ⅴ)的吸附作用以及藻细胞壁对nano-TiO2的拦截作用也可能会抑制微藻对As(Ⅴ)的吸收,进而降低培养基中As(Ⅲ)的浓度。
(4)研究表明,纳米颗粒改变了As(Ⅴ)在莱茵衣藻藻细胞中的生物转化途径,但nano-TiO2介导下微藻As 吸收转化的分子机制还需要进一步研究。

