凯氏定氮法测定花生中蛋白质方法的优化
杜蒙 孙允超 李雯雯 王晓军 贾瑞杰 程倩倩


摘 要:对凯式定氮法测定花生蛋白质含量的方法进行研究,以花生为试验材料,研究不同消解温度、消解时间、浓硫酸用量对花生蛋白质含量的影响,从而确定优化后的试验条件。结果显示,当浓硫酸的用量为10 mL,消解温度为420 ℃,消解时间为1.5 h时,回收试验和重复性试验等结果较好。优化后的方法降低了浓硫酸的用量,对于蛋白质含量较高的花生样品可消解完全,为高效、准确测定花生蛋白质的含量提供了参考。
关键词:凯式定氮法;花生蛋白质;单因素试验
Optimization of Kjeldahl Method for Determination of Protein Methods in Peanuts
DU Meng, SUN Yunchao, LI Wenwen, WANG Xiaojun, JIA Ruijie, CHENG Qianqian*
(Liaocheng Academy of Agricultural Sciences, Liaocheng 252000, China)
Abstract: A study was conducted on the method of determining peanut protein content using the Kjeldahl nitrogen method. Peanuts were used as experimental materials to investigate the effects of different digestion temperatures, digestion times, and amounts of concentrated sulfuric acid on peanut protein content. The optimized experimental conditions were determined. The results showed that when the amount of concentrated sulfuric acid was 10 mL, the digestion temperature was 420 ℃, and the digestion time was 1.5 hours, the recovery test and repeatability test results were good. The optimized method reduces the amount of concentrated sulfuric acid and achieves complete digestion of peanut samples with high protein content, providing a reference for efficient and accurate determination of peanut protein content.
Keywords: Kjeldahl nitrogen method; peanut protein; single-factor experiment
花生中蛋白质含量较为丰富,每百克含量大约为22 g。花生是我国可食用的优质植物蛋白,极易被人体吸收。目前,测定花生中蛋白质含量的方法有很多,凯氏定氮法由Kieldahl于1883年首先提出,具有操作简单、测定结果准确、成本低廉[1-2]等优势,目前依然被广泛使用。
凯氏定氮法的测定原理是花生中的蛋白质在催化加热消化条件下分解,产生的氨与硫酸生成硫酸铵。加入氢氧化钠碱化蒸馏后使氨游离,用硼酸混合指示剂吸收后,以硫酸或盐酸标准滴定溶液进行滴定,根据滴定量计算氮的含量,再乘以相关食品的换算系数,即为蛋白质的含量。本文主要对《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5—2016)第一法—凯氏定氮法测定花生蛋白质含量时的操作步骤进行单因素试验,探讨各因素对花生蛋白质含量测定值的影响,优化花生蛋白质测定的最佳条件。
1 材料与方法
1.1 材料与试剂
花生样品(茌平基地采摘);五水硫酸铜、硫酸钾、氢氧化钠、碳酸钠、硼酸、硫酸铵甲基红、溴甲酚绿、95%乙醇,国药集团;浓硫酸(98%)、浓盐酸,天津市科密欧化学试剂有限公司。除硫酸铵试剂为优级纯外,其他试剂均为分析纯。
1.2 仪器与设备
全自动凯氏定氮仪(济南海能);石墨消解仪(济南海能);电热鼓风干燥箱(天津泰斯特);分析天平(中国梅特勒托利多)。
1.3 试验方法
1.3.1 溶液配制
硼酸溶液(20 g·L-1):称取硼酸试剂20 g溶解于蒸馏水中后稀释至1 000 mL。
氢氧化钠溶液(400 g·L-1):称取氢氧化钠试剂400 g溶于蒸馏水中,冷却至室温,稀释至1 L。
0.1 mol·L-1的盐酸标准滴定溶液:準确量取
8.3 mL浓盐酸于容量瓶中,用蒸馏水定容至1 L,用无水碳酸钠标定。用万分之一天平称取经105 ℃烘
3 h冷却后的无水碳酸钠0.2 g(精确至0.000 1 g),溶于100 mL水中,并加入20 mL硼酸混合指示剂,用盐酸滴定,同时做空白,滴定后煮沸,变色后继续滴定(约2~4滴),此滴定量为最终滴定结果,计算公式为
(1)
式中:C为盐酸标准溶液的浓度,mol·L-1;m为称量无水碳酸钠基准试剂的质量,g;V为滴定时消耗盐酸标准溶液的体积,mL;105.99为无水碳酸钠的摩尔质量。
甲基红乙醇溶液(1 g·L-1):称取甲基红试剂
0.1 g,用95%乙醇稀释至100 mL。
溴甲酚绿乙醇溶液(1 g·L-1):称取溴甲酚绿试剂0.1 g,用95%乙醇稀释至100 mL。
混合指示剂:1份甲基红乙醇溶液与5份溴甲酚绿乙醇溶液临用时混合。取4 mL甲基红乙醇溶液和20 mL溴甲酚绿乙醇溶液混合,取混合液20 mL加在2 L硼酸溶液中。
1.3.2 样品处理
称取打碎混匀的花生样品0.3 g(精确至0.000 1 g)至250 mL消解管中,每个消解管中加入0.4 g硫酸铜、6 g硫酸钾及10 mL硫酸于石墨消解仪进行消解,消解完毕后,消解管中的液体呈绿色透明状,取出冷却,每批次需做空白试样,于全自动凯氏定氮仪上测定。
碱管路试剂桶中装氢氧化钠溶液(400 g·L-1),酸管路试剂桶中装硼酸混合指示剂溶液(20 g·L-1),水管路试剂桶中装蒸馏水,滴定酸试剂瓶中装盐酸标准滴定溶液0.1 mol·L-1,仪器设定加碱量为40 mL,加水量20 mL,硼酸混合指示液20 mL,蒸馏时间
5 min。蒸馏结束后,仪器使用盐酸标准滴定溶液
0.1 mol·L-1进行自动滴定,记录滴定盐酸用量。
1.3.3 单因素试验
(1)消解温度。称取样品并加入催化剂和10 mL浓硫酸后,当消解温度分别达到360 ℃、380 ℃、400 ℃、420 ℃、440 ℃、460 ℃后,再继续消解1.5 h,消解完毕后,于全自动凯氏定氮仪上测定。
(2)浓硫酸用量。称取样品并加入催化剂后,分别加入5 mL、8 mL、10 mL、12 mL、15 mL浓硫酸,在消解温度为420 ℃、消解时间为1.5 h的条件下,消解完毕后,于全自动凯氏定氮仪上测定。
(3)消解时间。称取样品并加入催化剂和10 mL浓硫酸后,当消解温度达到420 ℃后,继续消解
0.5 h、1.0 h、1.5 h、2.0 h、2.5 h,消解完毕后,于全自动凯氏定氮仪上测定。
1.3.4 空白试验
空白试验,除不称取花生样品,称取0.5 g蔗糖外,其余测定步骤同样品测定步骤。
1.3.5 回收试验
准确称取优级纯硫酸铵基准试剂0.2 g(精确至0.000 1 g)于消解管中,无需消解,于全自动凯氏定氮仪上测定。
1.3.6 重复性试验
准确称取7份0.3 g(精确至0.000 1 g)的花生样品,用本文优化后的条件方法分别进行试验。
1.3.7 花生中蛋白质含量的计算
计算公式为
(2)
式中:X为试样中蛋白质的含量,g/100 g;V1为试液中消耗盐酸标准滴定液的体积,mL;V2为空白样品中消耗盐酸标准滴定液的体积,mL;C为盐酸标准滴定溶液浓度,mol·L-1;0.014为1.0 mL盐酸标准滴定溶液相当的氮的质量,g;m为试样的质量,g;F为氮换算为蛋白质的系数,花生为5.46;100为换算系数。
2 结果与分析
2.1 不同消解温度对花生蛋白质含量的影响
由图1可知,在消解时间为1.5 h、浓硫酸用量为10 mL的条件下,随着消解温度的升高,花生蛋白质的含量呈先升高后降低的趋势,消解温度为
420 ℃时,花生蛋白质的含量明显高于其余消解温度时的含量,可能是由于消解温度低时,样品消解不完全;当消解温度过高时,含氮物质以气体形式损失,造成测定结果偏低[3]。因此,选择420 ℃为最适温度。
图1 不同消解温度对花生蛋白质含量的影响
2.2 不同硫酸用量对花生蛋白质的影响
由图2可知,在消解温度为420 ℃、消解时间为1.5 h的条件下,随着浓硫酸用量的增加,花生蛋白质含量呈现增加的趋势,当浓硫酸加入量在10 mL以上时,花生蛋白质的含量基本稳定。如果浓硫酸用量少,会导致花生样品无法完全分解,测定结果可能偏低[4-5];如果用量过多,会造成试剂浪费并产生环境污染。因此,选择10 mL为硫酸的最适用量。
图2 不同硫酸用量对花生蛋白质的影响
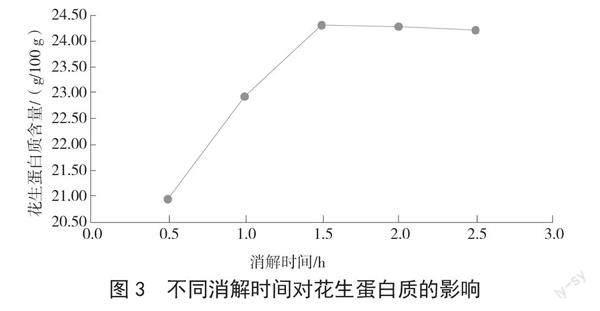
2.3 不同消解时间对花生蛋白质的影响
由图3可知,在消解温度为420 ℃、浓硫酸用量为10 mL的条件下,消解时间为1.5 h时,花生蛋白质的含量明显高于消解时间为0.5 h时的含量,略高于消解2.0 h的花生蛋白质含量。当消解时间为
2.5 h时,花生蛋白质的含量下降。消解时间对花生蛋白质含量的影响很大,如果消解时间太短,消解液体并不呈绿色透明状,而是呈黑色;消解时间过长,会造成氮的流失,因此最适宜消解时间为1.5 h。
图3 不同消解时间对花生蛋白质的影响
2.4 空白试验、回收试验和重复性试验的测定结果
由表1可知,7次测定空白试样的标准盐酸滴定用量均值为0.097 mL。由表2可知,用全自动凯氏定氮仪进行准确性试验,7次回收试验测得硫酸铵基准试剂的含氮量均值为21.15 g/100 g,硫酸铵回收率为99.8%;由表3可知,利用本文优化后的试验条件,进行精密度试验,7次平行测定花生平均值为
22.14 g/100 g,RSD为0.16%,以上试验结果表明本文优化后的测定方法具有较高的准确性和精密度。
3 结论
本文利用凯氏定氮法测定花生蛋白质含量,分析不同条件对花生蛋白质含量的影响。结果显示,优化后的试验条件为称样量0.3 g(精确至0.000 1 g),硫酸用量为10 mL,消解温度设定为420 ℃,消解时间为1.5 h。通过回收试验和重复性试验等结果可以看出,该方法适合花生蛋白质的含量测定,为高效、准确测定花生蛋白质的含量提供参考。
参考文献
[1]LYNCH J M,BARBANO D M.Kjeldahl nitrogen analysis as a reference method for protein determination in dairy products[J].Journal of Aoac International,1999(6):1389-1398.
[2]國家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中蛋白质的测定:
GB /T 5009.5—2016[S].北京:中国标准出版社,2016.
[3]刘瑞芳,王艺伟.优化凯氏定氮法测定饲料中粗蛋白质条件的研究[J].饲料研究,2022,45(20):104-107.
[4]陆卫明,尹华.用蛋白质测定仪测定食品中的蛋白质[J].江苏预防医学,2007,18(1):61-62.
[5]赵艳萍,陈平,张蕾,等.全自动凯氏定氮仪测定食品中蛋白质分析[J].科技创新导报,2014,11(8):45.

