P53、PDL1在弥漫大B细胞淋巴瘤中的表达相关性及其对预后的影响*
张 茜 陈焕伟 吕学文 李 晟 戴伟平 梁业由
广东省农垦中心医院肿瘤内科六区 (广东 湛江 524002)
弥漫大B细胞淋巴瘤作为临床较多见的高度侵袭性淋巴瘤,也是非霍奇金淋巴瘤上常见类型之一,其发生率约占全部侵袭性淋巴瘤的80%左右,成为危害患者身心健康的常见病。研究显示[1],与正常淋巴细胞核相比,该类患者细胞的细胞核更大,同时呈现弥漫性生长。此外,弥漫大B细胞淋巴瘤的临床分型较复杂多样,且在遗传学、组织形态学、临床症状、疗效上存在较高的异质性。故此,治疗前需对患者的风险因素进行评估,通过对应的风险分层选择针对性治疗方案,在保障患者预后上具有重要作用。随着医学水平的完善发展,临床发现R-CHOP化疗方案的效果显著,部分患者经治疗后可达到预期效果,但仍有部分患者可能因为复发或者耐药情况导致效果不佳[2-3]。目前,临床评价预后的方式以国际预后指数为主,虽然能够指导临床治疗,但其仅作为是临床预后参数的组合,无法展现出该病发生发展过程中分子生物学的异质性,因此,积极寻找影响疾病预后的分子生物学指标成为关键[4]。据相关报道显示[5],P53、PDL1蛋白与该病存在密切关系,前者属于应激反应性抑癌基因,在控制细胞周期、DNA修复及凋亡上存在重要意义,一旦该基因失活后可导致细胞增值与肿瘤化疗抵抗。后者则属于B7受体家族的重要成员,也是活化的T细胞,能够和同源受体发生结合反应,并抑制信号,防止外周组织内活化的T细胞增值。但目前临床关于P53、PDL1和弥漫大B细胞淋巴瘤相关的报道较少,本文就此展开分析,结果如下。
1 资料与方法
1.1 一般资料选择2020年5月至2022年12月广东省农垦中心医院肿瘤科经病理确诊为DLBCL患者40例。此实验经医院伦理委员会批准。
入组标准:符合《中国弥漫大B细胞淋巴瘤诊断与治疗指南》[6]中疾病相关诊断;均病理检验确诊;患者及亲属均知情同意;病历资料完整,并无缺项。排除标准:生存周期小于六个月;合并传染性单核细胞增多症、坏死性淋巴炎、转移性肿瘤疾病、髓外白血病;存在免疫抑制治疗史;试验前接受放化疗者。
1.2 方法收集所有患者的标本,选择4%中性甲醛进行妥善固定,常规石蜡包埋,以4μm厚度进行持续切片,铺片后按照二步法免疫组化检测系统测定DLBCL组织中的P53、PDL1蛋白的表达。首先将切片放在65℃恒温箱内烘烤,时间控制1h,采取二甲苯脱蜡,并常规进行梯度酒精水化,利用柠檬酸缓冲液煮沸修复抗原,再通过磷酸盐(PBS)缓冲液进行冲洗,采取3%过氧化氢遏制内源性过氧化物酶活性,将一抗加入切片上,于4℃恒温箱内孵育过夜,再次PBS缓冲液冲洗,加入通用型免疫球蛋白G抗体-辣根过氧化物酶多聚体,于37℃恒温箱内孵育,时间15min,PBS缓冲液冲洗,选择二氨基联苯胺试剂染色,采取苏木素轻度复染细胞核,再次使用PBS缓冲液冲洗,以梯度酒精脱水干燥,利用中性树胶封片,另外将PBS代替一抗作为阴性对照。选择两名经验丰富的病理专家观察染色结果,其中P53蛋白处于细胞核内,利用显微镜发现细胞核存在棕黄色颗粒即P53阳性染色,若阳性细胞占比超出10%可判定成阳性,反之小于等于10%则是阴性。PDL1则处于细胞膜上,呈现棕黄色或者黄色,若着色强度的肿瘤细胞大于等于25%可判定成阳性,反之即阴性[7]。
另外,所有患者予以CHOP或者R-CHOP方案化疗6-8周期,其中CHOP方案为:静滴750mg/m2环磷酰胺+75mg/m2表阿霉素+1.4mg/m2长春新碱+100mg波尼松;R-CHOP方案:静滴375g/m2利妥昔单抗+750mg/m2环磷酰胺+75mg/m2表阿霉素+1.4mg/m2长春新碱+100mg波尼松,21d为一疗程。针对低中危患者4周期进行评估,而高危患者3周期评估疗效,追踪疾病无进展生存时间(PFS)及生存时间(OS)。
1.3 观察指标统计所有患者P53、PDL1蛋白的阳性表达率,再对比P53、PDL1阳性与阴性患者的临床资料(性别、年龄、Hans分型、分化程度、临床分期、疗效、风险程度、3年PFS率及OS率),并利用Pearson相关性分析P53、PDL1蛋白与疾病的相关性。
疗效:完全缓解(CR):病灶消失并维持3周以上;部分缓解(PR):病灶缩小并维持3周以上;稳定(SD):病灶缩小但不明显,维持3周以上;疾病进展(PD):病灶扩大或者转移,病情恶化[8]。
风险程度:血清乳酸脱氢酶超出正常水平1倍即为低中危;行为状况评分2-4分即高危。
1.4 统计学处理全文数据选择SPSS 20.0系统计算,(χ-±s)为计量数据,选择t检验;百分比为计数数据,选择χ2检验,P<0.05为数据存在统计学差异,另外利用Pearson相关性分析计算相关性,P<0.05表示有相关性。
2 结 果
2.1 所有患者P53、PDL1蛋白的表达情况经检测,发现P53阳性表达率42.50%,而PDL1阳性表达率37.50%。见表1。

表1 所有患者P53、PDL1蛋白的表达情况[n=40,n(%)]
2.2 P53、PDL1蛋白表达与临床资料的关系P53、PDL1蛋白表达在性别、年龄、Hans分型、分化程度、临床分期上无显著差异(P>0.05),但在疗效、风险程度、3年PFS率及OS率上差异显著(P<0.05)。见表2。

表2 P53、PDL1蛋白表达与临床资料的关系
2.3 P53、PDL1与疾病的相关性通过Pearson相关性分析,发现P53、PDL1均与疾病呈现正相关性(P<0.05)。见表3。
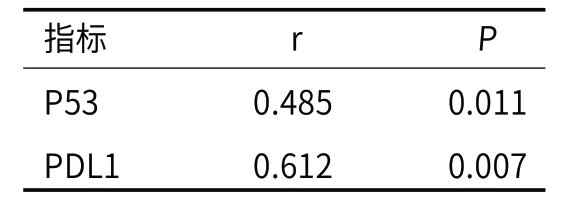
表3 P53、PDL1与疾病的相关性
3 讨 论
弥漫大B细胞淋巴瘤属于血液系统较多见的恶性肿瘤,存在较高的异质性与侵袭性,大部分患者预后较差,直接降低生活质量[9-10]。因此,早期诊断、及时采取有效治疗在改善患者预后上意义重大。目前,临床对于该病的治疗方案以化疗为主,如CHOP或者R-CHOP等方案,虽然取得过一定的治疗效果,但仍有少数患者出现病情复发的情况[11]。故此,如何改善该类患者疗效及预后成为临床研究重点。
研究发现,弥漫大B细胞淋巴瘤的发生及发展与多种机制、蛋白基因的异常表达存在关联,且临床已有报道证实多种基因蛋白参与了该病发生发展的过程。故此,早期通过相关因子的检测可尽快明确患者病情恶化或者不良预后的风险,为后续调整治疗方案及靶向治疗提供指导作用[12-13]。P53基因处于17号染色体短臂,包含突变型与野生型两大类,前者可导致该基因失活,并利用多种途径引起细胞周期进程失衡或者肿瘤细胞凋亡,最终造成细胞增殖失控。此外P53基因通常突变成4-7外显子突变,处于DNA结合区域的编码区,包含同义突变、无义突变、错义突变等,加上P53基因属于肿瘤细胞上较多见的突变基因,于各类肿瘤上的发生率存在一定差别,而弥漫大B细胞淋巴瘤上P53基因的突变率占30%左右[14]。后者则可控制多条通路的下游靶基因,在肿瘤生长期间的防御机制上具有重要作用,可控制细胞DNA修复进程,对细胞周期阻滞及凋亡的影响较大[15]。另外,TP53基因作为临床常见的抑癌基因,于肿瘤细胞上呈现较高表达,且该基因转录翻译的蛋白P53在细胞生长及增值修复上极为重要。TP53基因一旦突变即可造成P53蛋白丧失功能,并造成肿瘤细胞生长抑制能力降低[16-17]。加上P53基因调控细胞周期组织、衰退与凋亡等过程,因此P53蛋白阳性表达成为弥漫大B细胞淋巴瘤的预后因素,同时与疾病呈现正相关性,故此,P53成为判断预后的重要指标。而PDL1作为阻碍肿瘤免疫逃逸的主要靶点,其在多种实体肿瘤上意义重大,故此,靶向PDL1成为血液恶性肿瘤的潜在用途。此外,PDL1在多种类型的淋巴瘤组织及淋巴瘤细胞系上表达,而正常淋巴组织上未发现PDL1的表达,从而证实其与淋巴瘤的恶性程度存在密切关系,可对患者预后进行评价[18-20]。从本次研究结果中看到:P53阳性表达率42.50%,而PDL1阳性表达率37.50%;P53、PDL1蛋白表达在性别、年龄、Hans分型、分化程度、临床分期上无显著差异(P>0.05),但在疗效、风险程度、3年PFS率及OS率上差异显著(P<0.05);通过Pearson相关性分析,发现P53、PDL1均与疾病呈现正相关性(P<0.05),说明P53、PDL1可在弥漫大B细胞淋巴瘤组织上表达,且与疗效及预后存在一定关系。
综上所述,P53、PDL1可在弥漫大B细胞淋巴瘤组织上表达,且与患者预后有关,可成为评价预后的重要指标。

