甲磺酸阿帕替尼治疗晚期原发性肝癌患者的效果及对血清血管内皮生长因子和缺氧诱导因子-1α水平的影响研究
芦明月
佳木斯市肿瘤结核医院肿瘤一科,黑龙江 佳木斯 154007
2018 年我国原发性肝癌(PHC)发病率为9.20%、死亡率为12.90%,分别居世界癌症发病和死亡的第4位、第3位[1]。当前,手术治疗是PHC患者的首选方案,但多数患者确诊时已为中晚期,错失手术时机,手术切除率仅为20%~30%[2]。经导管动脉化疗栓塞术(TACE)为中晚期PHC 的一线治疗方案,而载药微球经动脉化疗栓塞术(DEB-TACE)中使用的载药微球为新型血管栓塞类材料,能够使肿瘤血管的栓塞更彻底,且可缓慢持续地释放抗肿瘤药物,提高肿瘤局部浓度,促使肿瘤完全坏死[3]。甲磺酸阿帕替尼为肿瘤靶向治疗药物,可抑制新生血管生成,从而抑制肿瘤生长[4]。本研究选取佳木斯市肿瘤结核医院2017年2月—2019年2月收治的84例晚期PHC患者作为研究对象,旨在探讨甲磺酸阿帕替尼治疗晚期PHC患者的效果及对血清血管内皮生长因子(VEGF)和缺氧诱导因子-1α(HIF-1α)水平的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取佳木斯市肿瘤结核医院2017年2月—2019年2月收治的84 例晚期PHC 患者作为研究对象,采用随机数表法分为观察组和对照组,每组各42 例。观察组:男28例,女14 例;年龄43~74 岁,平均年龄(63.27±5.75)岁;BCLC 分期为B 期24 例,C 期18 例;Child-Pugh 分级为A级22例,B级20例;病灶直径3~7 cm,平均病灶直径(4.26±0.39)cm。对照组:男27 例,女15 例;年龄43~72岁,平均年龄(63.34±5.76)岁;BCLC分期为B期23 例,C 期19 例;Child-Pugh 分级为A 级23 例,B 级19例;病灶直径3~7 cm,平均病灶直径(4.24±0.37)cm。两组患者一般资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准通过。纳入标准:(1)经CT、MRI及病理学检查确诊,且符合《原发性肝癌诊疗规范(2019年版)》[5]诊断标准。(2)巴塞罗那肝癌临床分期系统(BCLC)为B 或C 期。(3)肝功能Child-Pugh A 级或B级。(4)预计生存期≥3 个月。排除标准:(1)严重肝功能障碍、凝血功能障碍、心肺功能不全。(2)合并活动性肝炎、严重感染。(3)远处广泛转移。(4)合并其他恶性肿瘤。(5)精神或神经系统疾病。
1.2 方法
对照组给予DEB-TACE治疗。局麻,采用Seldinger法行股动脉穿刺,行腹腔干、肠系膜上动脉造影,确定肿瘤病灶部位、大小、数量、血供等情况,采用微导管超选择插管至肿瘤供血动脉内,透视下将1 瓶100~300 μm 聚乙烯醇载药微球与40~50 mg表柔比星(北京协和药厂,国药准字H20143165,规格10 mg)充分混合后进行栓塞治疗,复查造影肿瘤未见染色,则栓塞成功,术毕。观察组在对照组的基础上于术后第3 d 给予甲磺酸阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140103,规格0.25 g)治疗,500 mg/d,口服。如治疗期间监测到严重不良反应发生,应立即停药,并经对症治疗好转后,从半数剂量开始逐步至足量。
1.3 观察指标
(1)两组患者近期疗效。治疗4周后,参照实体瘤疗效评价标准(RECIST)1.1[6]进行评价。完全缓解(CR):肿瘤消失,维持≥4 周;部分缓解(PR):肿瘤体积缩小≥50%,维持≥4 周;疾病稳定(SD):介于SD 与PD 之间;疾病进展(PD):肿瘤增大≥25%或出现新病灶。(2)两组患者不良反应发生情况。评价治疗后3个月内的不良反应,包括发热、腹痛、恶心呕吐、骨髓抑制、乏力、高血压、蛋白尿、手足综合征、皮疹等[7]。(3)两组患者血清VEGF和HIF-1α水平检测。治疗前及治疗3个月后,抽取患者空腹静脉血3 mL,离心,取血清,采用酶联免疫吸附法进行检测。(4)出院后随访:每2周电话随访1次,每3个月门诊复查CT 1次,随访截至2021年2月。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。生存情况采用Kaplan-Meier 生存曲线描述。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者短期疗效情况
观察组客观缓解率(ORR)为45.24%、疾病控制率(DCR)为76.19%,分别高于对照组的23.81%、52.38%,差异有统计学意义(P<0.05),见表1。
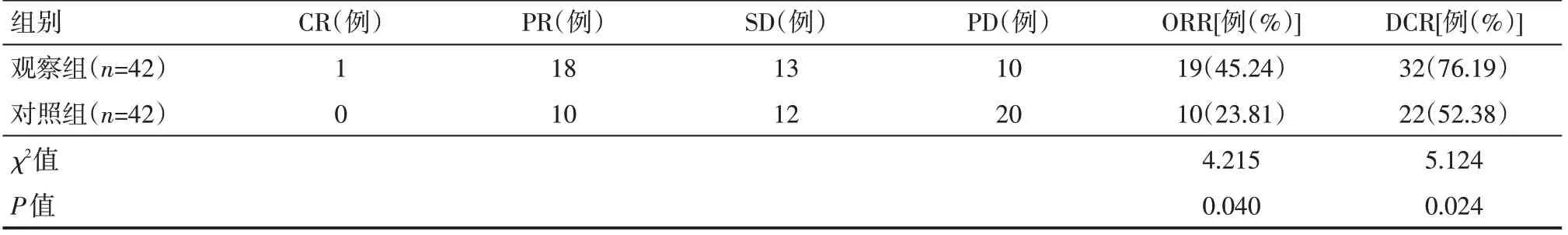
表1 两组患者短期疗效情况
2.2 两组患者不良反应发生情况
两组患者发热、腹痛、恶心呕吐、骨髓抑制发生率比较,差异无统计学意义(P>0.05);观察组乏力、高血压、蛋白尿、手足综合征、皮疹发生率均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者不良反应发生情况例(%)
2.3 两组患者治疗前后血清VEGF、HIF-1α水平情况
治疗前,两组患者血清VEGF、HIF-1α水平比较,差异无统计学意义(P>0.05);治疗后,两组患者血清VEGF、HIF-1α水平均低于治疗前,且观察组血清VEGF水平、HIF-1α水平均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后血清VEGF、HIF-1α水平情况(±s)pg/mL

表3 两组患者治疗前后血清VEGF、HIF-1α水平情况(±s)pg/mL
组别观察组(n=42)对照组(n=42)t值P值VEGF HIF-1α治疗前198.64±18.63 197.42±18.57 0.301 0.765治疗后108.73±9.84 139.52±12.94 12.275<0.001治疗前418.31±39.45 416.89±39.38 0.165 0.869治疗后298.63±28.67 331.42±33.05 4.857<0.001
2.4 两组患者生存时间情况
观察组中位生存期为(11.84±1.05)个月,对照组为(7.69±0.74)个月,观察组长于对照组,差异有统计学意义(t=20.937,P<0.05)。
3 讨论
PHC为常见的消化系统恶性肿瘤,恶性程度较高,预后较差,5 年生存率仅约15%,其发生原因主要与过度饮酒、乙型肝炎病毒感染、肝硬化等有关[8-9]。TACE为当前治疗晚期PHC 的主要手段,常规TACE 栓塞剂为碘化油+化疗药物混合栓塞,不仅会随血流进入全身循环系统,增加毒副作用,而且瘤周侧枝循环冲刷碘化油,造成栓塞不彻底[10]。聚乙烯醇载药微球为新型栓塞剂,能够弥补上述不足,以可控的方式向肿瘤局部释放化疗药物,使其长期维持有效的药物浓度,且栓塞更为彻底,能够更明显地促进肿瘤组织缺氧、缺血坏死[11]。但单纯给予DEB-TACE的抗肿瘤效应有限,根本原因在于DEB-TACE术后肿瘤微环境处于缺血、缺氧状态,在HIF-1α、VEGF介导下促使肿瘤新生血管生长,诱发肿瘤复发、进展。
甲磺酸阿帕替尼是选择性最高的新型生长因子受体-2(VEGFR-2)抑制剂,可抑制VEGFR-2磷酸化,并可通过与VEGFR-2 高度选择性结合,竞争性抑制VEGFR-2 与VEGF 结合,抑制新生血管生成,以此发挥抗肿瘤效应[12-14]。本研究结果显示,观察组ORR、DCR 高于对照组,与曾云建等[15]的研究相似。分析其原因在于,DEB-TACE的化疗效果持久性更佳,且术后早期联合使用甲磺酸阿帕替尼能够更快地控制体内VEGF水平,并可逆转化疗耐药,增强化疗药物的抗肿瘤效应,故而短期效果更佳。肿瘤及其转移瘤的生长离不开血管的形成,VEGF、HIF-1α为血管生成因子,具有较强的诱导血管生成能力,参与肿瘤的复发、转移过程[16]。杨锦锋等[17]的研究证实,PHC患者血清中VEGF、HIF-1α水平均呈高表达,其表达情况与临床分期、肿瘤转移存在相关性,且二者表达越高,生存期越短,预后越差。本研究结果显示,治疗后,观察组血清VEGF、HIF-1α水平均低于对照组,观察组中位生存期长于对照组。分析其原因在于,DEB-TACE术后给予甲磺酸阿帕替尼治疗协同抗肿瘤效应更强,能够抑制肿瘤血管生成、进展,减少复发转移风险,延长患者生存期。本研究结果显示,观察组乏力、高血压、蛋白尿、手足综合征、皮疹等不良反应发生率均高于对照组,提示上述不良反应经对症处理、药物减量后均得以缓解,表明患者用药耐受性较好。
综上所述,甲磺酸阿帕替尼治疗晚期PHC患者能够提升患者的治疗效果,降低其血清VEGF、HIF-1α水平,延长其生存期,但相关不良反应有所增加,需加强监测。

