两性霉素B 对假丝酵母菌与乳杆菌生物膜作用的研究
尚 翔 白会会 刘朝晖▲
1.首都医科大学附属北京妇产医院 北京妇幼保健院妇科,北京 100026;
2.首都医科大学附属北京妇产医院 北京妇幼保健院检验科,北京 100026
外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)是女性常见的外阴阴道炎症之一,主要由假丝酵母菌引起,75%女性一生中至少有1 次VVC 发作,且其发病率逐年升高[1-3]。对于VVC 的治疗,目前主要以口服或阴道用唑类等抗假丝酵母菌药物为主,但随着抗假丝酵母菌药物的大量应用,耐药问题随之出现[4]。而假丝酵母菌形成的生物膜可通过物理屏障作用,使药物渗入缓慢,并保护内层假丝酵母菌,使其对环境的耐受性增强,降低抗假丝酵母菌药物的疗效[5]。
两性霉素B(amphotericin B,AmB)作为一种多烯类抗假丝酵母菌药物,与唑类药物抗假丝酵母菌机制的不同使得其对VVC 临床分离株有较高敏感性[6],在其他抗假丝酵母菌药物耐药的情况下仍有良好的抗菌能力[7]。目前认为,在VVC 的治疗中除杀灭假丝酵母菌外,恢复阴道微生态正常菌群更为重要,对于VVC治疗并修复阴道微生态处理中,AmB 能否抑制假丝酵母菌生物膜形成及与乳杆菌制剂同时使用还是序贯使用,临床上经验不足且缺乏实验证据。本研究在体外建立假丝酵母菌及乳杆菌生物膜,并通过探究AmB 对假丝酵母菌生物膜及乳杆菌生物膜的作用,观察是否对假丝酵母菌生物膜有影响的同时对乳杆菌生物膜无相应影响,以期为AmB 在VVC 的治疗及阴道微生态修复中提供更多实验证据。
1 材料与方法
1.1 药物和试剂
沙氏琼脂培养基(Solarbio,S9710);液体沙氏培养基(Solarbio,L8300);MRS 琼脂培养基(Solarbio,M8330);MRS 肉汤(Solarbio,M8540);结晶紫(Solarbio,C8470);PBS 缓冲液(Solarbio,P1020);AmB(中国食品药品检定研究院,130334)。
1.2 实验菌株
首都医科大学附属北京妇产医院(以下简称“我院”)微生态实验室分别选取2022 年7 月至8 月就诊于我院的VVC 患者及健康人群,其中4 例VVC 患者为通过阴道微生态诊断评价系统镜下见假菌丝和/或芽生孢子,证实为VVC 患者;4 名健康人群样本选自同期检测中证实无阴道炎人群,所有研究对象均无混合性阴道炎。采取各自阴道分泌物培养纯化后通过16SrRNA 基因序列进行比对及鉴定菌株。阴道来源假丝酵母菌:1 号、2号、3 号、4 号,均鉴定为白假丝酵母菌,同源性强;阴道来源乳杆菌:5 号、6 号、7号、8 号,均鉴定为卷曲乳杆菌,同源性强。白假丝酵母菌标准株由北京大学第一医院皮肤科实验室提供。本研究经医院伦理委员会审核(2022-KY-064-01)。
1.3 仪器
比浊仪(BIOMérieux,DensiCHEK plus);酶标分析仪(南京德铁实验设备有限公司,HBS-1096A);电子显微镜(Hitachi,S-3400N)。
1.4 研究方法
1.4.1 生物膜形成监测 采用96 孔板培养假丝酵母菌及乳杆菌。分别于培养24、48、72 h 弃菌液,PBS 漂洗,室温干燥后加0.2%结晶紫染色30 min,再次PBS 漂洗及室温干燥后加95%酒精脱色5 min,将液体移到新的96 孔板内,使用酶标仪580 nm 波长检测洗脱液的OD 值。以空白组的均值加3 倍标准差为临界值(ODc),待检测微孔内OD 值分别以<1 ODc、1~2 ODc、>2~4 ODc、>4 ODc 代表生物膜形成能力为无、弱、中和强[8-9]。
1.4.2 最小抑菌浓度(minimum inhibitory concentration,MIC)测定 参照美国临床实验室标准化协会制定CLSI M27-A4 方案,采用微量肉汤稀释法测定AmB 的MIC[10]。将假丝酵母菌及乳杆菌分别与不同浓度AmB 培养48 h,以各自培养基作为阴性对照孔,仅加入假丝酵母菌或乳杆菌而未加入AmB 孔为空白对照孔,其中AmB 终浓度分别为0.031 25、0.062 50、0.125 00、0.2500 0、0.5000 0、1.000 00、2.000 00、4.000 00、8.000 00、16.000 00 μg/mL,分别以肉眼见无浑浊培养孔或较空白对照孔抑菌率为80%的最低药物浓度作为其MIC 值,其中抑菌率(%)=(空白对照孔OD 值-实验孔平均OD 值)/(空白对照孔平均OD 值-阴性对照孔平均OD 值)×100%。以白假丝酵母菌ATCC 64548 和ATCC 64550 为质控株进行质量控制。所有实验均重复至少3 次。
1.4.3 最小抑制生物膜浓度(minimum biofilm inhibitory concentration,MBIC)测定 建立24 h单菌种生物膜,PBS 冲洗后加入系列浓度药物的液体培养基,使AmB 终浓度分别为0.031 25、0.06 250、0.125 00、0.2500 0、0.5000 0、1.000 00、2.000 00、4.000 00、8.000 00、16.000 00 μg/ml 作为实验组,再次培养24 h 后以肉眼未见浑浊的最低药物浓度即为MBIC。因肉眼未见无浑浊培养孔,故采用测定生物膜OD 值方法与阳性对照孔进行对比,即以仅培养出生物膜而AmB 浓度为0μg/ml 孔为阳性对照组,观察MBIC。
1.4.4 扫描电镜下观察AmB 对生物膜作用 分别将单菌种与终浓度分别为0、0.031 25、0.062 50、0.125 00、0.250 00、0.500 00、1.000 00、2.000 00、4.000 00、8.000 00、16.000 00 μg/ml 的AmB 共培养48 h 以细胞爬片建立24 h 单菌种生物膜后再加入不同浓度AmB,PBS 漂洗后戊二醛固定,真空干燥后镀金,在扫描电子显微镜下观察生物膜变化。
1.5 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 生物膜形成能力测定
除2 号假丝酵母菌在24h 生物膜形成能力为中外,其余各假丝酵母菌在24 h 生物膜形成能力均为强。以48 h 为时间点,5 号及6 号乳杆菌生物膜形成能力为弱,而7 号及8 号乳杆菌生物膜形成能力为强。除1 号假丝酵母菌外,其余白假丝酵母菌及卷曲乳杆菌生物膜形成能力在48 h 高于24 h,差异有统计学意义(P<0.05)。而除7 号乳杆菌生物膜形成能力48 h高于72 h,差异有统计学意义(P<0.05)外,其余各菌生物膜形成能力在48 h 与72 h 差异无统计学意义(P>0.05)。见图1。

图1 4 株假丝酵母菌及4 株乳杆菌生物膜形成能力
2.2 MIC 值测定
4 株白假丝酵母菌肉眼未见浑浊培养孔对应药物浓度均为0.125 00 μg/ml,考虑AmB 对白假丝酵母菌的MIC 值为0.125 00 μg/ml。而AmB 对卷曲乳杆菌未见明显无浑浊培养孔,后续分别计算抑制率,均未达到80%,故考虑AmB 对卷曲乳杆菌无抑制作用。见表1。

表1 不同浓度AmB 对乳杆菌抑制率(%)
2.3 MBIC 值测定
AmB 对不同白假丝酵母菌的MBIC 值略有不同,2 号假丝酵母菌在AmB 浓度为2 μg/ml 时生物膜形成能力与阳性对照组比较,差异无统计学意义(P>0.05)外,其余白假丝酵母菌在AmB 浓度为2 μg/ml时低于阳性对照组,差异有统计学意义(P<0.05),降低至2 μg/ml 后续维持平台状态,均与后续各浓度比较,差异无统计学意义(P>0.05)。见图2。考虑Amb 对白假丝酵母菌的MBIC 值为2 μg/ml。

图2 4 株假丝酵母菌MBIC 测定
2.4 乳杆菌加入不同浓度AmB 生物膜形成能力计算值比较
7 号乳杆菌在AmB 浓度为1、8、16 μg/ml 时生物膜形成能力高于阳性对照组,差异有统计学意义(P<0.05)外,其余各卷曲乳杆菌在各浓度生物膜形成能力与阳性对照组比较差异均无统计学意义(P>0.05)。见图3。故考虑AmB 对卷曲乳杆菌已形成的生物膜无破坏作用。

图3 4 株乳杆菌加入不同浓度AmB 生物膜形成能力计算值比较
2.5 AmB 对白假丝酵母菌生物膜的作用
2.5.1 AmB 对白假丝酵母菌生物膜形成的抑制作用2号白假丝酵母菌单独培养48 h 后生长及生物膜形成情况见图4A,同一株菌与0.1 μg/ml AmB 共同培养48 h后的电镜表现见图4B,可以见到白假丝酵母菌的数量较单独培养时减少且形成的生物膜也减少。4 号假丝酵母菌数量减少且形成的生物膜亦有减少,见图4C~D。

图4 假丝酵母菌与AmB 共同培养48 h 电镜表现
2.5.2 AmB 对已形成的白假丝酵母菌生物膜的破坏作用2 号假丝酵母菌单独培养48 h 后生物膜形成情况见图5A,同一株菌培养24 h 得到成熟生物膜再与1 μg/ml AmB 共同培养24 h 后生物膜变化情况的电镜表现见图5B,可以见到白假丝酵母菌已形成的生物膜较前减少。已形成的生物膜较前减少见图5C~D。

图5 AmB 对假丝酵母菌已形成的生物膜作用电镜表现
2.6 AmB 对卷曲乳杆菌生物膜的作用
2.6.1 AmB 对卷曲乳杆菌生物膜形成的抑制作用5号乳杆菌单独培养48 h 后生长及生物膜形成情况见图6A,同一株菌与0.125 00μg/ml AmB 共同培养48 h 后生长及生物膜形成情况的电镜表现见图6B,可以见到卷曲乳杆菌的数量较前无明显改变且形成的生物膜也无明显改变。
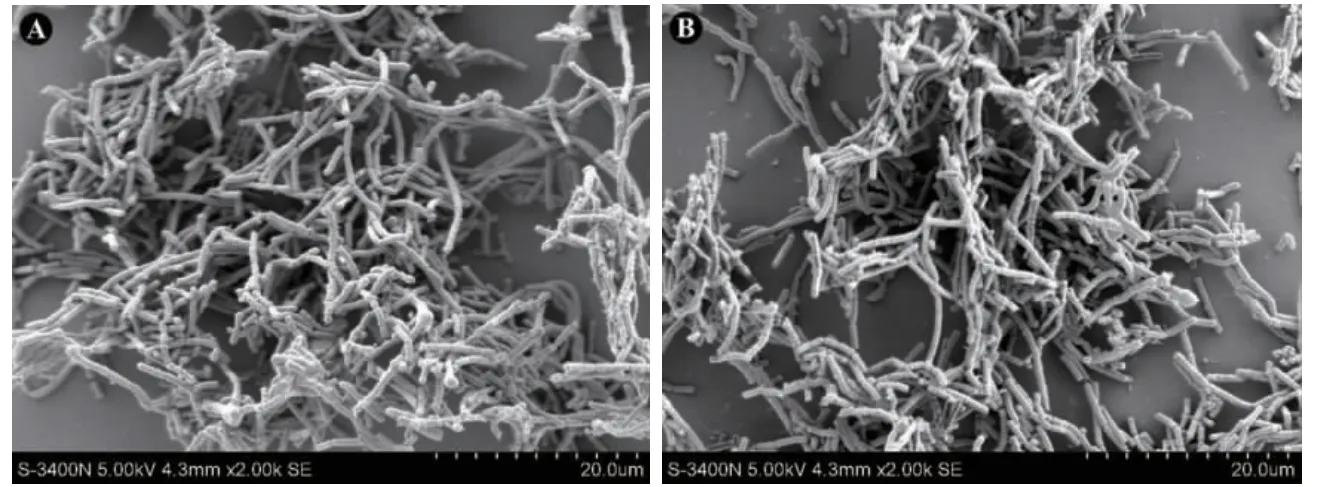
图6 乳杆菌与AmB 共同培养48 h 电镜表现
2.6.2 AmB 对已形成的卷曲乳杆菌生物膜的破坏作用5 号乳杆菌单独培养48 h 后生物膜形成情况见图7A,为同一株菌培养24 h 得到成熟生物膜再与2 μg/ml AmB 共同培养24 h 后生物膜变化情况的电镜表现见图7B,可以见到卷曲乳杆菌已形成的生物膜无明显减少。5 号乳杆菌放大3000 倍时的电镜下表现见图C~D,可以更明显地看出其所形成的生物膜未被破坏。

图7 AmB 对乳杆菌已形成生物膜作用电镜表现
3 讨论
VVC 是临床常见的一种妇科炎症疾病,而白假丝酵母菌是其中最常见也是致病性最强的致病菌[11]。白假丝酵母菌是一种双相菌,可在菌丝相与酵母相间相互转换。在外界环境不利于其繁殖时转换为抗性更强的酵母相,而在宿主抵抗力下降等情况下转换为毒力更强的菌丝相,该相的特性使其易于复发[12-13];同时其形成的生物膜包裹并保护内部的假丝酵母菌,减少抗真菌药物的穿透,可增强其耐药性[14]。目前对VVC的治疗主要以抗真菌药物,尤其是唑类药物为主[2],但由于反复及不合理应用,其耐药问题逐渐突显[15]。
AmB 主要通过与假丝酵母菌细胞膜的麦角甾醇结合,形成贯穿细胞膜的管状小孔,使核苷酸等细胞内物质外泄,并使细胞毒性物质内渗,从而破坏细胞正常代谢而引起真菌死亡[16-17];同时可诱导细胞氧化损伤,并刺激细胞产生免疫因子,对女性免疫系统起调节作用等与唑类药物不同的作用机制[18-19],在唑类药物耐药时仍能起到较好疗效。
本研究对白假丝酵母菌生物膜形成能力进行了测定,在48 h 时生物膜形成能力均为强,同时在该时间点测定AmB 对其的MIC 及MBIC 值,这与Borman等[20]研究选择的时间点是一致的,尽管美国临床和实验室标准协会方法学提到将结果判读时间点由48 h改为24 h,但对于生长较慢的假丝酵母菌除外,故本研究中仍选择48 h 作为结果判读时间点[10]。无论生物膜形成能力强或中等的假丝酵母菌,其测得MIC 值均为0.125 00 μg/ml,与既往研究中测得的MIC 值类似[21],故认为AmB 对白假丝酵母菌有较好的疗效,在临床应用中,唑类药物耐药时,可选择AmB 作为VVC 的治疗用药。同时测得其MBIC 值为2 μg/ml,提示在假丝酵母菌已形成生物膜后,即已感染假丝酵母菌一段时间后,需提升足够的药物浓度以起到治疗作用。
阴道内存在非常复杂的微生态系统,其中包含数以亿计的微生物及病原体[22],目前对于VVC 的治疗,除应用上述抗真菌药物杀灭病原菌外,恢复阴道有益菌群并增强其功能亦十分重要[23]。目前有研究显示乳杆菌可通过干扰生物膜及菌丝的形成起到抗假丝酵母菌的作用[24]。Oliveira 等[25]的体外实验鼠李糖乳杆菌可影响白假丝酵母菌毒力因子的表达,降低蛋白酶和溶血酶活性,降低生物膜形成能力。但在临床工作中,针对VVC 患者的阴道菌群修复,是采取AmB 与乳杆菌制剂联合应用还是序贯应用更合适呢?这在以往的应用中经验不多。乳杆菌制剂可以增加乳杆菌数量,在恢复阴道微生态系统平衡上起重要作用,如采用与抗真菌药物联合应用的方法,相较于序贯或单独应用抗真菌药物,势必对缩短治疗时间,提高患者依从性与疗效及降低复发率有所帮助。本研究发现,AmB 在对假丝酵母菌有抑制作用的同时,不仅无抑制卷曲乳杆菌生长的作用,同时对生物膜形成能力最弱的卷曲乳杆菌已形成的生物膜亦无破坏作用。提示AmB 并不会破坏阴道内正常存在的卷曲乳杆菌,且在应用AmB 的同时可加入乳杆菌制剂以改善阴道微生态环境的平衡。2017 年一项纳入了125例VVC 患者的研究比较了氟康唑与乳杆菌制剂联合应用、序贯应用及单独应用的疗效,发现联合应用与序贯应用效果类似,均可提高疗效并降低复发率[26]。本研究通过体外实验的方式,提示AmB 对白假丝酵母菌有抑制及破坏生物膜作用的同时,对乳杆菌及其形成的生物膜无抑制及破坏作用,提示AmB 与乳杆菌制剂联合应用治疗VVC 有理论上的可行性。
综上所述,AmB 对白假丝酵母菌有较强抑菌能力,但对已形成生物膜的白假丝酵母菌需更大剂量才可起到破坏生物膜的作用;对卷曲乳杆菌无抑制及生物膜破坏作用,在临床应用中可考虑将AmB 与乳杆菌制剂联合应用,以进一步提高疗效。但本研究仅局限于单一菌株的实验,将假丝酵母菌及乳杆菌共培养是否能进一步减少AmB 的用量,后续还需进一步研究。同时本研究仅局限于体外实验,如何将AmB 应用于临床,增加其疗效并减少副作用,后续还需进一步研究。

