P16/Ki-67双染在宫颈癌筛查中的应用价值分析
高亚丽 吴坤英
郑州市妇幼保健院妇科,郑州 450000
宫颈癌发病机制复杂,可能涉及性生活开始过早、多个性伴侣、抽样、免疫功能缺陷性疾病、多孕多产等,其中人乳头瘤病毒(HPV)感染是其发生的主要因素,若不及时治疗,随着肿瘤不断增大可侵犯或压迫邻近器官组织而出现相应症状,甚至威胁患者生命安全[1]。宫颈癌癌前病变持续时间较长,若能早期筛查并发现早期浸润癌和癌前病变,可起到减少或预防宫颈癌发生的目的。液基细胞学(TCT)检查、高危人乳头瘤病毒(HR-HPV)检测是宫颈癌筛查的常用手段,但前者检查无法在体外培养,且重现性欠佳、检测步骤过于繁琐、难以将一过性感染的影响排除,存在较高的假阴性,后者检查会受到细胞学诊断医师业务水平限制,漏诊率较高,同时价格昂贵、易出现假阳性、不适合大规模宫颈癌筛查等,故无法作为最终的临床诊断方式[2-3]。抑制基因蛋白16(P16)属于细胞周期蛋白依赖性激酶抑制剂,P16-Cyclin D1CDK-Rb 组成的调控途径与宫颈癌发生密切相关,而原癌基因细胞增殖核抗原(Ki-67)属于核蛋白,在G0 期缺失,在G1、G2、S、M 期均有表达,正常情况下两者表达为互斥的,若检测细胞中两者同时表达提示细胞周期失调且存在宫颈高级病变可能[4-5]。本研究分析P16/Ki-67 双染在宫颈癌筛查中的应用价值,以为临床诊断提供新的思路,现报道如下。
资料与方法
1.研究对象
回顾性分析2020 年10 月至2022 年5 月就诊于郑州市妇幼保健院的100 例宫颈病变患者的临床资料,年龄(55.65±2.14)岁(25~72 岁);首次性生活年龄(23.65±2.14)岁(18~28岁);性伴侣数(1.22±10)个(1~3个);婚姻状况:已婚93 例,未婚7 例。纳入标准:宫颈完整,既往未接受物理或宫颈手术治疗者;年龄>21 岁;检查前3 d 无性生活、无阴道用药、无外阴清洗;患者或家属签署知情同意书。排除标准:既往接受盆底放射治疗者;既往有宫颈手术史或子宫切除术治疗者;妊娠期或哺乳期孕妇者。
本研究经郑州市妇幼保健院医学伦理委员会批准,批准文号:ZZFY-LL-2021017。
2.方法
2.1.P16/Ki-67 双染检测 检查时取膀胱截石位,用一次性窥阴器将宫颈充分暴露,用宫颈细胞取样刷在宫颈管内及宫颈表面顺时针旋转5~10 圈,刷取宫颈脱落细胞,使用ThinPrep2000 系统处理标本,制作细胞涂片。晾干后,用无水乙醇固定10 min,室温下晾干,使用疏水笔于载玻片上画出疏水圈。应用抗原清除及修复内源酶:按照19∶1 的比例配比蒸馏水及抗原修复液,配置完成后将其置于染色缸内后放入玻片,明确抗原修复液超过书写区之上。随后将染色缸置入高压锅内,于气压阀开始均匀喷气时开始计时,控制修复时间为5 min,待完成自然冷却至室温后使用清洗液漂洗3 min,重复清洗3 次,依据具体情况补全疏水圈,载玻片上会均匀滴入3%H2O2溶液,确保书写区被充分覆盖,室温下孵育10 min,清洗液漂洗3 min,重复3次。完成后实施染色,即将1 滴DS-A 染液滴于书写区,并于37 ℃环境中孵育30 min,漂洗30 min,重复3 次,随后滴加1 滴DS-V 染液,恒温箱(37 ℃)内孵育30 min,清洗液漂洗3 min,重复3 次。将DS-C 和DS-D 以1∶33 制作成50 μl DAB 显色液,并将其覆盖于载玻片书写区,于室温下显色10 min,随后采用流水冲洗3 min,清洗液漂洗3 min,向其内滴入50 μl Fast Red 显色液,按照DS-C 和DS-D 以1∶75 的比例配制,于室温下显色15 min,后流水冲洗3 min,进行苏木精-伊红染色,复染10 s。流水冲洗5 min,于清洗液中行10 min 反蓝,流水漂洗1 min。将2 滴随心封片剂滴于载玻片中央,晾干后用树脂滴胶封片。随后置于光学显微镜下观察,P16定位于细胞核或细胞质上,呈浅棕色、棕黄色和棕色即为阳性;Ki-67定位于细胞核上,显浅红色、玫红色即为阳性。
2.2.TCT 检查 用棉拭子擦除宫颈口分泌物,用特制的宫颈刷在宫颈管内顺时针转动5 圈,动作轻柔,采集宫颈口和颈管脱落的上皮细胞,用毛刷将收集的标本置于Thin Prep 保存液的小瓶内漂洗,收集细胞,用新柏氏2000 全自动制片机制片。将细胞混匀,制作成直径2 cm 左右的薄层细胞涂片,用95%乙醇固定,巴氏染色,封固制片,透明,树胶封片放入烘箱烘干,由专业人员阅片。参照TBS 分级系统(2006)对细胞学检测分类。不典型腺上皮细胞(AGC)和腺癌、高度鳞状上皮内病变(HSIL)、宫颈鳞状细胞癌(SCC)、低度鳞状上皮内病变(LSIL)、不能排除高级别鳞状上皮内病变的宫颈不典型鳞状细胞(ASC-H)、未见上皮内病变细胞或恶性细胞(NILM)、细胞学异常诊断包括意义不明确的宫颈不典型鳞状细胞(ASC-US)。TCT 检查结果判断标准:NILM判定为阴性结果,其余均判定为阳性结果。
2.3.HR-HPV 检测 以窥阴器暴露宫颈,用棉拭子擦去宫颈过多的分泌物,将蘸取少许无菌生理盐水的标准宫颈刷插入宫颈口,顺时针旋转约5 圈,慢慢取出宫颈刷,放置在装有专用保存液的小瓶内,多余的刷柄在管口处折断,将刷头留在样本管内,管盖旋紧,做好样品标识并保持洗脱管直立放置,4 ℃保存待检。用高危型人乳头瘤病毒核酸检测试剂盒检测23 种HPV 基因型,包含HPV6、HPV11、HPV42 等在内的9 种HPV 低危型和HPV18 型、HPV16 型,HPV31、HPV33、HPV35 等在内的12 种高危型HPV。检测出HR-HPV亚型则检查结果评定为阳性。
2.4.阴道镜检查 由阴道镜医师实施阴道镜检查及活检术。使用阴道窥器充分暴露宫颈,使用棉球擦拭宫颈表面,摄片、保存。使用碘棉球及3%醋酸棉球均匀涂抹于阴道穹隆、宫颈及阴道壁处,仔细观察各部位变化情况,保存图像。在阴道镜辅助下选择异常处3~4 块病理送检。所有操作均由本院两名经验丰富的病理科主任医生进行诊断,病理诊断<LSIL(即CINI 及以下诊断)为阴性;≥HSIL(即CINⅡ+)为阳性。
3.观察指标
(1)记录阴道镜检查结果;(2)以阴道镜下活检结果为金标准,分析HR-HPV、TCT、P16/Ki-67 双染诊断宫颈病变灵敏度、准确度和特异度。准确度=(真阳性例数+真阴性例数)/总例数×100%;灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%。
4.统计学方法
应用SPSS 21.0 软件分析数据,用(±s)表示符合正态分布的计量资料,组间比较采用独立样本t检验;以例(%)表示计数资料,采用χ2检验,通过绘制受试者工作特征曲线(ROC),计算曲线下面积(AUC),其中AUC 越接近于1,说明诊断准确性越高,P<0.05为差异有统计学意义。
结果
1.阴道镜下活检结果
100 例宫颈病变患者,经阴道镜检查发现14 例(14.00%)为炎症病变,宫颈上皮内瘤变(CIN)Ⅰ26 例(26.00%),CIN Ⅱ 26 例(26.00%),CIN Ⅲ28 例(28.00%),SCC 6例(6.00%)。
2.HR-HPV、TCT、P16/Ki-67双染诊断宫颈病变的价值
HR-HPV、TCT、P16/Ki-67双染对宫颈病变诊断的灵敏度、特异度和准确度相比,差异均无统计学意义(均P>0.05)。见表1~4。
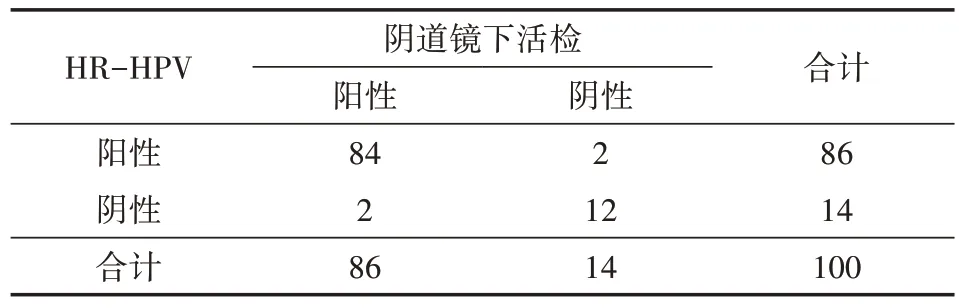
表1 100例宫颈病变患者的HR-HPV诊断结果(例)
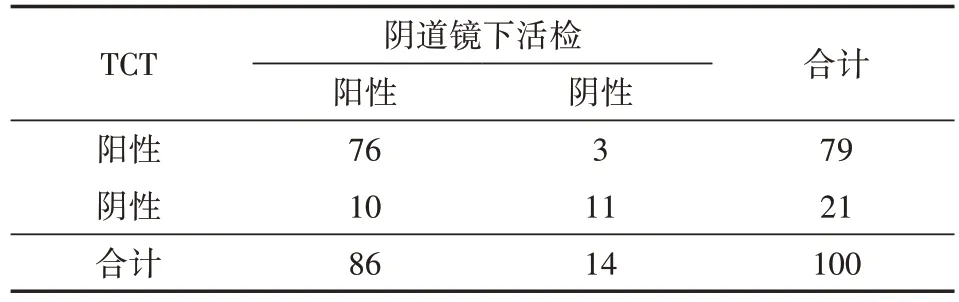
表2 100例宫颈病变患者的TCT诊断结果(例)

表3 100例宫颈病变患者的P16/Ki-67双染诊断结果(例)
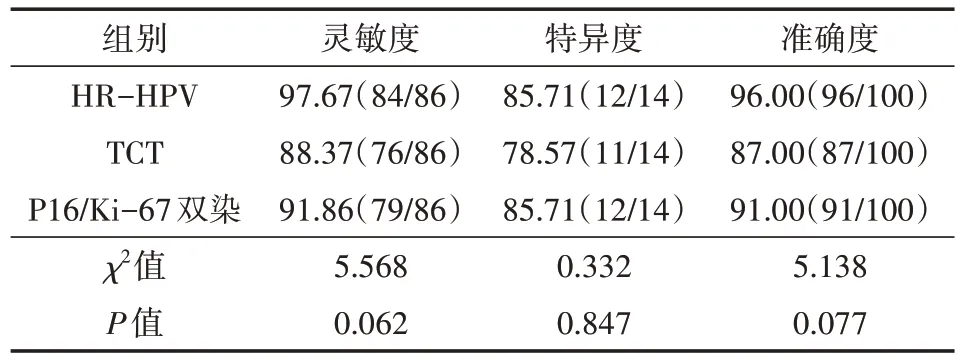
表4 100例宫颈病变患者的HR-HPV、TCT、P16/Ki-67双染诊断宫颈病变(%)
3.多种筛查方法效果评价
绘制ROC,HR-HPV、TCT、P16/Ki-67 双染诊断宫颈病变的AUC 分别为0.917、0.835、0.888,P16/Ki-67 双染检测分别与TCT、HR-HPV 检查相比,差异均无统计学意义(Z=1.720,P=0.086;Z=1.171,P=0.243)。见图1。
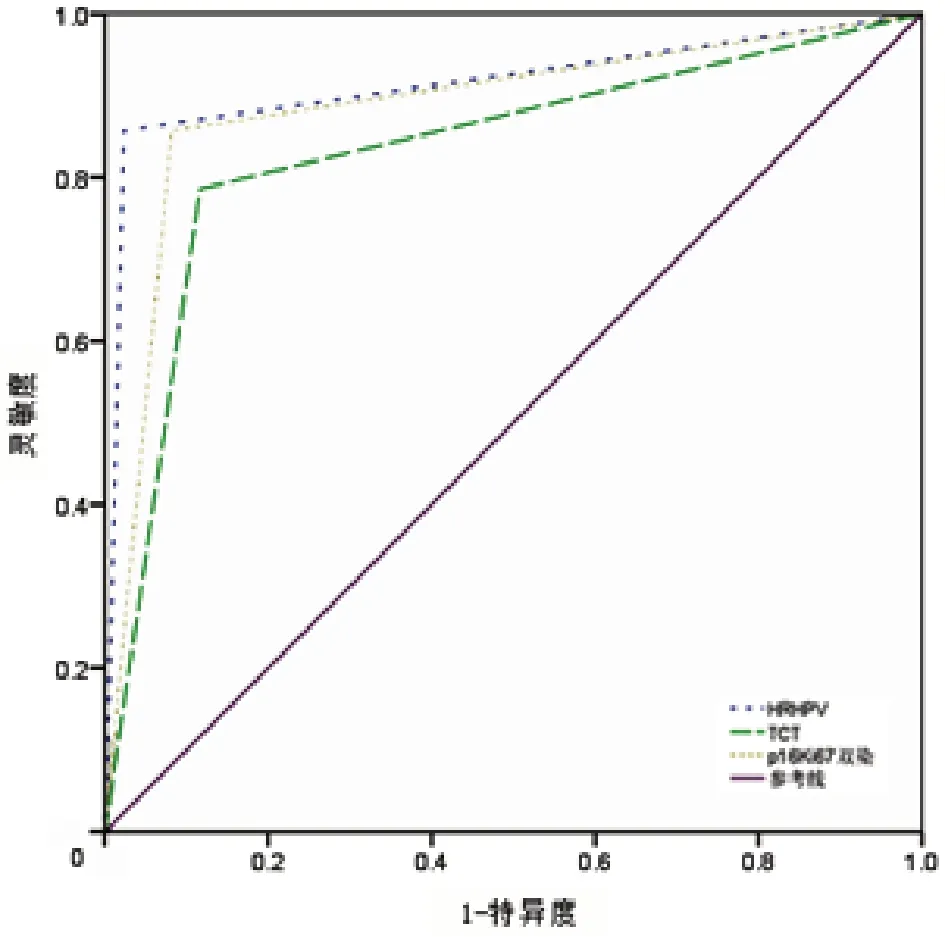
图1 100例宫颈病变患者的HR-HPV、TCT、P16/Ki-67双染诊断的ROC
讨论
宫颈癌早期无典型性临床表现,多数患者被确诊时已进展为中晚期,错失手术治疗最佳时机,预后较差[6]。因宫颈癌发病缓慢,癌前病变不会出现跨阶式变化,而是呈阶梯式进展,加上子宫颈独特的可暴露性质,其可经早期筛查被发现并实施干预,有助于改善患者预后。HR-HPV 病毒持续感染与宫颈癌发生、进展密切相关,其是HPV可侵入至宫颈上皮细胞内表面致癌蛋白,能够产生多种HPV蛋白,而高危型HPV感染能够经干扰INF产生或抑制癌基因P53、灭活CDK 抑制物、影响细胞周期素CyclinA/E、激活端粒酶等,扰乱细胞的正常增殖与凋亡机制,最终诱发子宫颈癌变[7-9]。HR-HPV 检测可通过标准化试剂盒实施检测,判断患者是否存在高危型HPV感染,能避免人为主观因素的不利影响,且检查具有高阴性预测值、高灵敏度等特点,可浓缩高风险人群,常被应用于宫颈癌筛查[10-11]。但HR-HPV 难以排除一过性感染的影响且检测步骤过于繁琐,不利于临床推广。TCT 为细胞学检测新技术,结合物理技术与现代计算机技术,能使制成的薄层图片背景更干净、细胞成分更为齐全、结构更加清晰,利于早期发现、诊断宫颈疾病[12-13]。TCT 具有操作简单、涂片采集率高等优点,但因病理细胞学医生缺乏、质量控制不足且观察者间重复性差等影响,使得TCT 检查也难以推广。
P16 属于肿瘤抑制基因,在宿主细胞内能够与Cyclin D竞争相结合为CDK4/CDK6,有助于抑制CDK4、CDK6 的活性,促使Rb 蛋白失活,在细胞增殖时无法经细胞周期检查点R点,进一步阻碍细胞周期从G1至S期的整个过程,有助于抑制宿主细胞的增殖[14-15]。HR-HPV 持续感染时宫颈上皮细胞基因组与病毒基因组会发生整合,其产生的E7 蛋白,可较好地与Rb 蛋白进一步结合后转化为pRb,导致Rb-E2F 复合体发生解离,产生大量的核转录因子E2F,促使基因P16 表现出异常高表达。Ki-67 是一种贯穿表达于增殖期细胞中的核蛋白,该指标从G1 后期开始表达,其水平越来越高,至M 期达到顶峰,在有丝分裂后水平快速下降[16-18]。Ki-67被异常激活表示细胞丧失正常成熟功能,可造成分化异常、增殖亢进,而Ki-67 过表达表示细胞增殖活跃[19]。一般情况下,同一个细胞周期内P16、Ki-67 不可能同时表达,两者作用相互拮抗,但两者同时表达时即表示细胞周期失调,表示患者存在高级病变风险[20-21]。本研究中,HR-HPV、TCT、P16/Ki-67 双染对宫颈病变诊断的灵敏度、特异度和准确度相比差异无统计学意义;HR-HPV、TCT、P16/Ki-67 双染诊断宫颈病变的曲线下面积(AUC)分别为0.917、0.835、0.888,P16/Ki-67 双染检测AUC 分别与TCT、HR-HPV 检查相比也差异无统计学意义,提示P16/Ki-67双染诊断准确性与TCT、HR-HPV 检查相似。P16/Ki-67 双染以免疫组化为原理,检测子宫颈脱落细胞涂片,其结果判读依赖于光学显微镜下同一细胞内的染色结果,具有良好的重现性,不依赖于细胞学形态检测,能够检出真正的病变细胞,且无须太过专业的读片技术,细胞学医师经短期培训即可掌握。
综上所述,P16/Ki-67 双染筛查宫颈癌及癌前病变效果与TCT、HR-HPV 相似,其具有高效、客观、简便、易重复等优点,可作为宫颈癌及癌前病变初筛的新选择[22]。
利益冲突所有作者均声明不存在利益冲突

