lncRNA HAND2-AS1 通过调节miR-21 表达对子宫内膜异位症患者子宫内膜基质细胞迁移和侵袭的抑制作用
苗 卉, 苗聪秀, 李 娜, 韩 晶
(长治医学院附属和平医院生殖遗传科 长治医学院生殖与遗传研究所 长治医学院生殖与遗传重点实验室 山西省卫健委生殖工程重点实验室,山西 长治046000)
子宫内膜异位症(endometriosis,EMT)是指子宫腔外存在子宫内膜组织(包括腺体和间质)的活跃生长[1]。EMT 在育龄女性中的患病率约为10%,但在慢病盆腔痛患者中,其患病率高达70%。异位子宫内膜(ectopic endometrium,EC)的周期性出血导致受累区域内的炎性渗透,并与周围组织或器官产生粘连,并引发产生进行性加重的继发性痛经、慢病盆腔痛和不孕症等一系列临床症状[2]。与恶性肿瘤相似,EMT 可广泛侵袭性生长[1]。目前,腹腔镜是诊断EMT 的金标准[3]。但由于腹腔镜的侵入性,且EMT 缺乏敏感性和特异性的生物学标志物,使EMT 患者从症状出现到明确诊断的平均时间长达6~7 年[4]。延迟诊断不仅促进EMT 的进展,而且影响患者的治疗,且EMT具有高复发率和低治愈率等临床特点[5]。因此,需要进一步深入研究EMT 的发病机制和病理机制,以探索有效的临床治疗方法。
近年来,长链非编码RNAs(long non-coding RNAs,lncRNAs)已被证实在EMT 等的多种疾病中发挥重要作用[6],多种lncRNAs 参与了EMT 的发生发展[7]。在EMT 患者EC 组织中表达减少的lncRNA LINC01541 可通过调控miR-506-5p 下调Wnt/β-catenin 通路的活化水平,抑制EC 组织中基质细胞(endometrial stromal cells,ESCs)的增殖、迁移和侵袭[8]。EMT 患者异常升高lncRNA MALAT1 可通过抑制miR-206 的表达上调EC 组织中ESCs 的增殖能力,减少细胞的凋亡,从而发挥促进疾病进展的作用[9]。但lncRNA HAND2-AS1在EMT 中的作用尚不清楚。研究[10-11]显示:在EMT 患者EC 组织中过度表达的miR-21 是参与EMT 发病细胞信号转导途径的重要调节因子,且子宫内膜癌中miR-21 的过表达也与肿瘤细胞的增殖和侵袭能力有关联。本课题组前期通过生物信息学分析发现lncRNA HAND2-AS1 与miR-21 间存在潜在结合位点,提示HAND2-AS1 可能通过调节miR-21 参与EMT 的发生发展。本研究探讨HAND2-AS1 和miR-21 基因在EMT 中的异常表达及其作用,旨在进一步阐明EMT 发生发展的分子机制。
1 材料与方法
1.1 一般资料选取2020 年5 月—2021 年7 月在本院妇科接受手术治疗的EMT 患者30 例作为EMT 组,另选取同时期在本院生殖科就诊的输卵管阻塞育龄女性30 例作为对照组。EMT 的诊断经临床症状、腹腔镜和组织病理学证实。纳入标准:①处于月经周期增生期晚期的EMT 患者(即月经周期的第11~13 天);②术前3 个月内未接受激素治疗者。排除标准:①并发严重肝、心、肺、肾、内分泌或免疫等系统疾病者;②孕妇或哺乳期女性;③并发自身免疫性疾病或任何系统的恶性肿瘤者;④并发其他除EMT 以外的妇科疾病者。本研究经本院伦理委员会审批,并取得所有研究对象的书面知情同意书。收集2 组研究对象的年龄、体质量指数(body mass index,BMI)和卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、催乳素(prolactin,PRL)及雌二醇(estradiol,E2)水平。术中收集对照组研究对象的新鲜子宫内膜组织和EMT 患者的EC 组织,迅速置于液氮中,并于30 min 内运回实验室进行后续研究。
1.2 细胞、主要试剂和仪器293T 细胞购自美国ATCC 细胞库。DMEM/F12 培养基和1%青-链霉素混合液(美国Hyclone 公司),胎牛血清(fetal bovine serum,FBS)和Ⅳ型胶原酶(美国Gibco 公司),pcDNA 空质粒和HAND2-AS1 过表达、miR-21 mimic 和阴性对照(mimic negative control,mimic-NC)质粒及含有HAND2-AS1 的3′非翻译区的靶位序列的野生型(HAND2-AS1-WT)和定点突变(HAND2-AS1-MUT)质粒(北京义翘神州科技股份有限公司),双荧光素酶报告载体(上海欧陆生物科技有限公司),TRIzol 试剂和Lipofetamin®2000 转染试剂(美国Invitrogen 公司),反转录试剂盒ReverTra Ace®qPCR RT Master Mix(日本Toyobo 公司),实时荧光定量PCR (realtime fluorescence quantitative PCR,RT-qPCR)试剂盒RealStar Green(北京康润诚业生物科技有限公司),双荧光素酶报告基因分析系统(美国Promega 公司),CCK-8 试剂(美国Sigma 公司),Transwell 小室(美国Corning Costar 公司),Matrigel 基质胶(美国BD 公司),RT-qPCR 引物[生工生物工程(上海)股份有限公司)]。NanoDrop 2000 分光光度计(美国Thermo 公司),CFX96 TouchTMRT-qPCR 仪(美国BioRad 公司),NYW-96M 微板仪(德国BMG LABTECH 公司)。
1.3 细胞分离、培养、转染和分组按照参考文献[12]方法从2 组研究对象(n=10)子宫内膜组织中分离ESCs。首先,采用PBS 缓冲液充分洗涤组织以去除血污,无菌眼科剪将组织剪成约1 mm×1 mm×1 mm 小块,采用含0.1% Ⅳ型胶原酶和0.25% 胰酶的无血清DMEM/F12 培养基于37 ℃水浴锅中震荡消化2 h,300 g 离心5 min,取上清液,依次经100 μm 和38.5 μm 的滤网过滤,取过滤液,再次300 g 离心5 min,取底层细胞沉淀,采用含10%FBS 和1%青-链霉素的DMEM/F12 培养基在37 ℃、5%CO2的细胞培养箱中培养。每2 d 更换1 次培养基,光镜下观察到ESCs 呈长梭形纤维状细胞形态,取传至3 代以后的ESCs 进行后续相关实验。将对照组ESCs 按每孔1×105个细胞的密度接种于6 孔细胞培养板中,待细胞生长融合至80%时,按转染试剂Lipofetamin®2000 使用说明书方法进行转染,并将细胞分为pcDNA 组(转染pcDNA 空质粒)、HAND2-AS1 组(转染HAND2-AS1 过表达质粒)、mimic NC 组(转染mimic NC)、miR-21 mimic 组 (转染miR-21 mimic)、pcDNA+mimic NC 组(联合转染pcDNA空质粒和mimic NC)、HAND2-AS1+mimic NC 组(联合转染HAND2-AS1 过表达质粒和mimic NC)、pcDNA+miR-21 mimic 组(联合转染pcDNA 空质粒和 miR-21 mimic)和 HAND2-AS1+miR-21 mimic 组(联合转染HAND2-AS1 过表达质粒和miR-21 mimic),另设未转染的细胞作为空白对照组。收集转染48 h 后的细胞进行后续实验。
1.4 RT-qPCR 法检测2 组研究对象子宫内膜组织和ESCs 中HAND2-AS1 mRNA 和miR-21 表达水平采用TRIzol 法提取子宫内膜组织或ESCs 中总RNA。采用分光光度计测定提取的RNA 水平,按照反转录试剂盒ReverTra Ace®qPCR RT Master Mix 说明书操作逆转录合成cDNA。以获得的基因为模板,采用2×RealStar Green 混合试剂盒进行RT-qPCR 实验。RT-qPCR 引物序列:HAND2-AS1 上游,5′-GGAGTCACAGGCAGTCGTAGA-3′,HAND2-AS1 下游,5′-GAAGGCACAGATCATTCATGG-3′;miR-21 上游,5′-CTCAACTGGTGTCGTGGAGTCGG-3′,miR-21下游,5′-CAATTCAGTTGAGGATTATGA-3′;U6 上游,5′-TCTGCCACCCGAGTGTAACCA-3′,U6 下游,5′-AACGCTTCACGAATTTGCGT-3′。以U6 为内参,采用2-ΔΔCt法计算HAND2-AS1 mRNA和miR-21 表达水平。
1.5 荧光素酶基因报告实验检测HAND2-AS1 和miR-21 的靶向关系采用生物信息学软件(Starbase:http://starbase.sysu.)预测miR-21 与HAND2-AS1 之间的潜在结合位点。将合成的HAND2-AS1-WT 和HAND2-AS1-MUT 克隆至荧光素酶报告载体中。取生长状态良好的293T 细胞,以每孔1×104个细胞的密度接种至96 孔细胞培养板中,并将HAND2-AS1-WT、HAND2-AS1-MUT和miR-21 mimic 或mimic-NC 在Lipofetamin®2000作用下进行共转染。转染48 h 后,收集裂解后的细胞,在双荧光素酶报告基因分析系统中采用荧光素酶分析试剂盒检测样品的荧光素酶活性。荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.6 CCK-8 法检测各组ESCs 增殖活性取各组ESCs,以每孔6×103个细胞的密度接种于96 孔细胞培养板中,每组设6 个复孔。于37 ℃、5%CO2培养箱中培养24、48 和72 h 后,向每孔加入10 μL CCK-8 溶液,继续孵育2 h 后,采用微板仪测定每孔于波长450 nm 处的吸光度(A)值,以A 值代表细胞增殖活性。
1.7 Transwell 小室实验检测各组ESCs 的迁移和侵袭能力取各组ESCs,常规消化后,1 000 g 离心15 min,重悬于无血清的DMEM/F12 培养基中,稀释至2×105mL-1。分别取约200 μL 细胞悬浮液接种至Transwell 上室,侵袭实验需在上室预先包被Matrigel 基质胶。将700 μL 含10%FBS 的DMEM/F12 培养基加入下室。置于37 ℃、5%CO2的培养箱中培养24 h,取出上室,弃细胞悬浮液,无菌PBS 缓冲液洗涤细胞,使用棉签轻轻地清除未穿出细胞。室温下采用4%多聚甲醛溶液固定30 min,0.1%结晶紫染色20 min,在光学显微镜下随机选取5 个视野计数穿膜细胞数,并以迁移实验和侵袭实验中穿膜细胞数(即迁移和侵袭细胞数)代表各组ESCs 的迁移和侵袭能力。
1.8 统计学分析采用SPSS 21.0 统计软件进行统计学分析。2 组研究对象年龄,BMI、血清中FSH、LH、PRL 和E2 水平及2 组研究对象子宫内膜组织和各组ESCs 中HAND2-AS1 mRNA 及miR-21 表达水平,迁移和侵袭细胞数及荧光素酶活性均符合正态分布,以xˉ±s表示,2 组间样本均数比较采用独立样本t检验,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验,相关性分析采用Pearson’s 相关系数分析。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组研究对象一般资料2 组研究对象年龄、BMI 和血清中FSH、LH 及PRL 水平差异均无统计学意义(P>0.05)。与对照组比较,EMT 组患者血清中E2 水平升高(P<0.05)。见表1。
表1 2 组研究对象一般资料Tab.1 General informations of subjects in two groups(n=30,±s)

表1 2 组研究对象一般资料Tab.1 General informations of subjects in two groups(n=30,±s)
Group Control EMT P Age(year)31.09±0.80 31.39±1.04 0.82 BMI(kg·m-2)23.70±0.70 22.67±0.86 0.39 FSH[λB/(IU·L-1)]5.98±0.31 7.74±0.85 0.13 LH[λB/(IU·L-1)]5.45±0.77 5.29±0.69 0.89 PRL[ρB/(μg·L-1)]16.55±3.61 21.66±3.39 0.33 E2[ρB/(ng·L-1)]35.21±3.53 51.59±5.08 0.03
2.2 2 组研究对象子宫内膜组织和ESCs 中HAND2-AS1 mRNA 及miR-21 表达水平及其相关性RT-qPCR 检测结果显示:与对照组(1.00±0.00 和1.00±0.00)比较,EMT 组患者EC 组织中HAND2-AS1 mRNA 表达水平(0.42±0.11)降低(P<0.05),miR-21 表达水平(4.58±0.35)升高(P<0.05)。与对照组(1.00±0.00 和1.00±0.00)比较,EMT 组ESCs 中HAND2-AS1 mRNA 表达水平(0.36±0.09)降低(P<0.05),miR-21 表达水平(6.69±0.81)明显升高(P<0.01)。Pearson 相关系数分析结果显示:在对照组中,HAND2-AS1 与miR-21 表达水平无明显相关性(r=0.34,P>0.05),在EMT 组中,HAND2-AS1 与miR-21 表达水平呈负相关关系(r=-0.57,P<0.05)。
2.3 各组ESCs 中HAND2-AS1 mRNA 和miR-21表达水平与空白对照组比较,pcDNA 组ESCs 中HAND2-AS1 mRNA 表达水平差异无统计学意义(P>0.05),HAND2-AS1 组ESCs 中HAND2-AS1 mRNA 表达水平明显升高(P<0.01);与空白对照组比较,mimic NC 组ESCs 中miR-21 表达水平差异无统计学意义(P>0.05),miR-21 mimic 组ESCs 中miR-21 表达水平明显升高(P<0.01);与空白对照组比较,HAND2-AS1+mimic NC 组ESCs 中 miR-21 表达水平降低 (P<0.05),pcDNA+miR-21 mimic 组ESCs 中miR-21 表达水平明显升高(P<0.01),pcDNA+mimic NC 组和HAND2-AS1+miR-21 mimic 组ESCs 中miR-21 表达水平差异均无统计学意义(P>0.05)。与pcDNA+ miR-21 mimic 组比较,HAND2-AS1+miR-21 mimic 组ESCs 中miR-21 表达水平降低(P<0.05)。见图1。
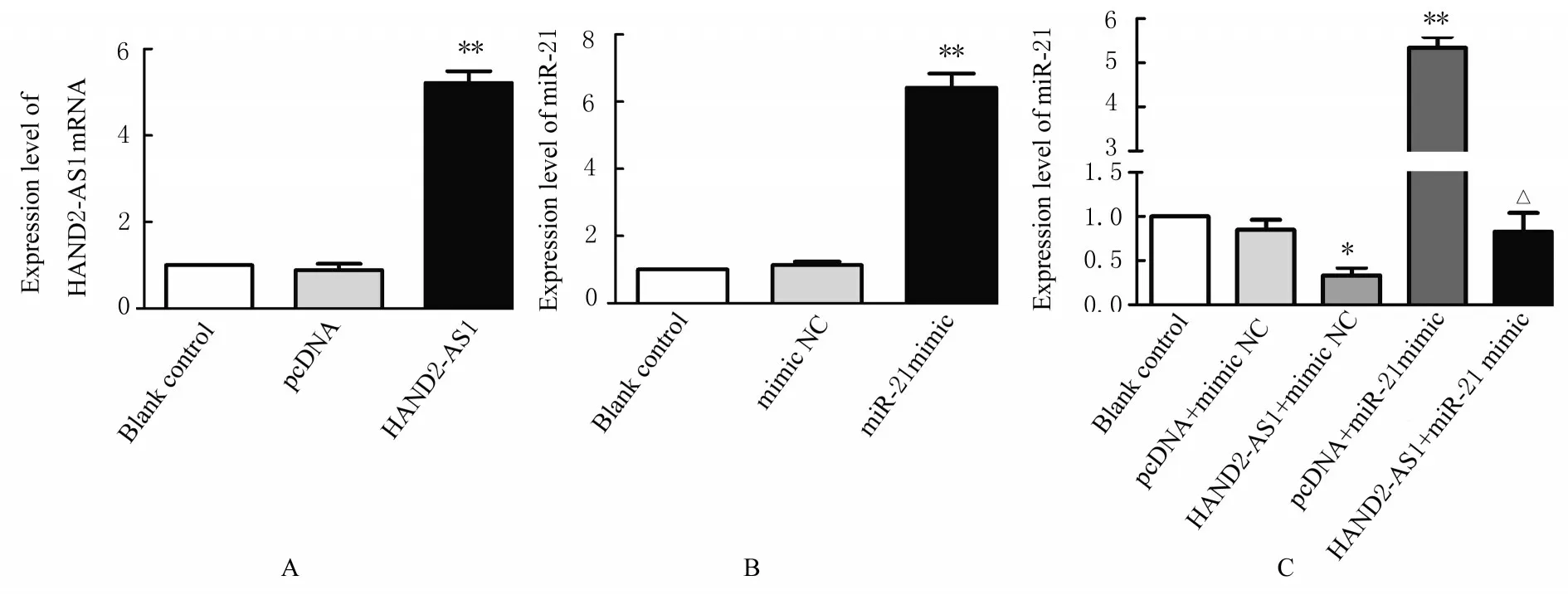
图1 RT-qPCR 法检测各组ESCs 中HAND2-AS1 mRNA 和miR-21 表达水平Fig.1 Expression levels of HAND2-AS1 mRNA and miR-21 in ESCs in various groups detected by RT-qPCR method
2.4 各组细胞中HAND2-AS1 与miR-21 的靶向关系采用生物信息学软件(Starbase:http://starbase.sysu.edu.cn/)预测 HAND2-AS1 和miR-21 之间的潜在关系,HAND2-AS1 与miR-21间存在靶向结合位点。双荧光素酶基因报告实验结果表明:与mimic NC 组比较,miR-21 mimic 组HAND2-AS1-WT 的相对荧光素酶活性明显降低(P<0.01),HAND2-AS1-MUT 的荧光素酶活性差异无统计学意义(P>0.05)。见图2。
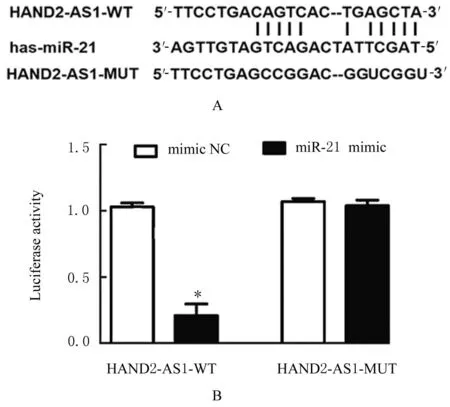
图2 HAND2-AS1 miR-21 的靶向关系Fig.2 Targeting relationship between HAND2-AS1 and miR-21
2.5 各组ESCs 增殖活性与空白对照组比较,HAND2-AS1+mimic NC 组ESCs 增殖活性降低(P<0.05),pcDNA+miR-21 mimic 组ESCs 增殖活性升高(P<0.05),pcDNA+mimic NC 组和HAND2-AS1+miR-21 mimic 组ESCs 增殖活性差异均无统计学意义(P>0.05)。与pcDNA+miR-21 mimic 组比较,HAND2-AS1+miR-21 mimic 组ESCs 增殖活性降低(P<0.05)。见图3。
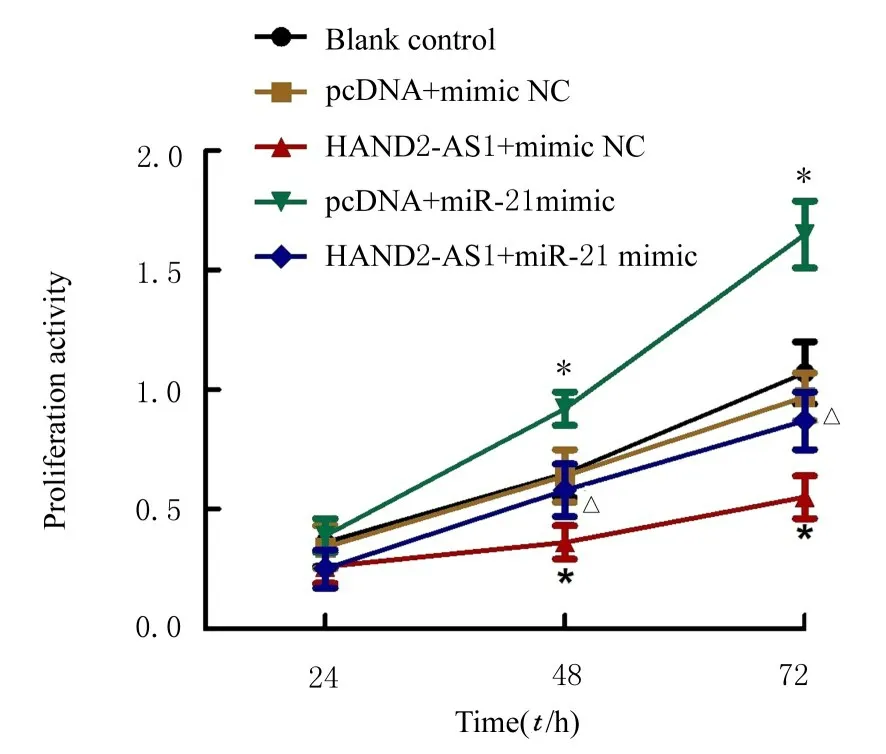
图3 CCK-8 法检测各组ESCs 增殖活性Fig.3 Proliferation activities of ESCs in various groups detected by CCK-8 method
2.6 各组ESCs 的迁移和侵袭数与空白对照组比较,HAND2-AS1+mimic NC 组ESCs 的迁移和侵袭数均明显降低(P<0.01),pcDNA+miR-21 mimic 组ESCs 的迁移和侵袭数均升高(P<0.05),pcDNA+mimic NC 组和 HAND2-AS1+miR-21 mimic 组ESCs 的迁移和侵袭数差异均无统计学意义(P>0.05)。与pcDNA+ miR-21 mimic 组比较,HAND2-AS1+miR-21 mimic 组ESCs 的迁移和侵袭数均降低(P<0.05)。见图4~7。
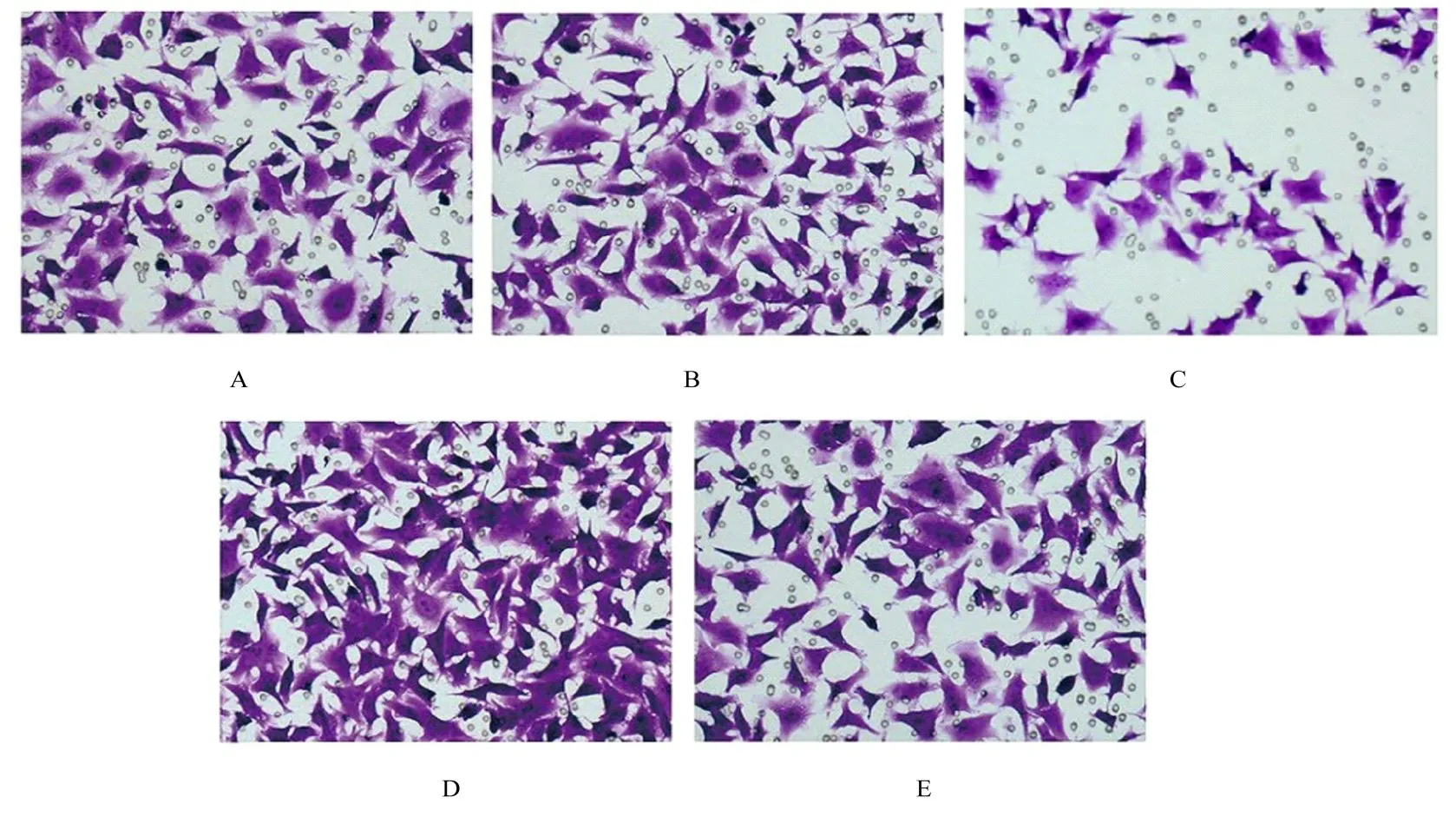
图4 Transwell 小室实验检测各组ESCs 的迁移情况(结晶紫,×200)Fig.4 Migration of ESCs in various groups detected by Transwell chamber assay(Crystal violet, ×200)
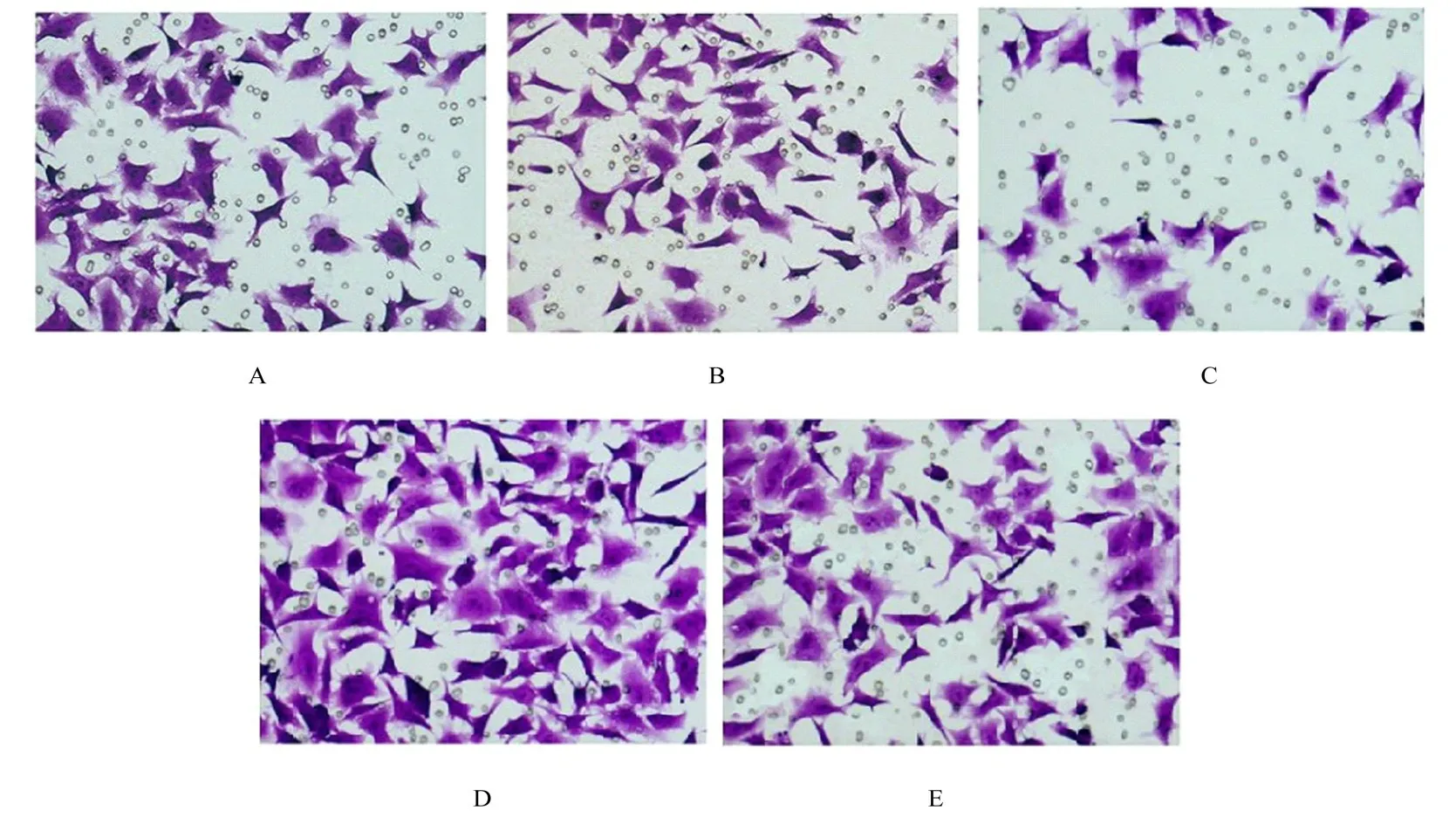
图5 Transwell 小室实验检测各组ESCs 的侵袭情况(结晶紫,×200)Fig.5 Invasion of ESCs in various groups detected by Transwell chamber assay(Crystal violet, ×200)
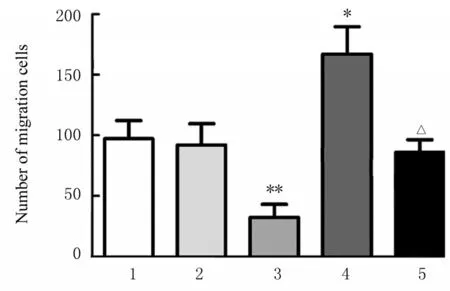
图6 各组ESCs 的迁移数Fig.6 Number of migration ESCs in various groups
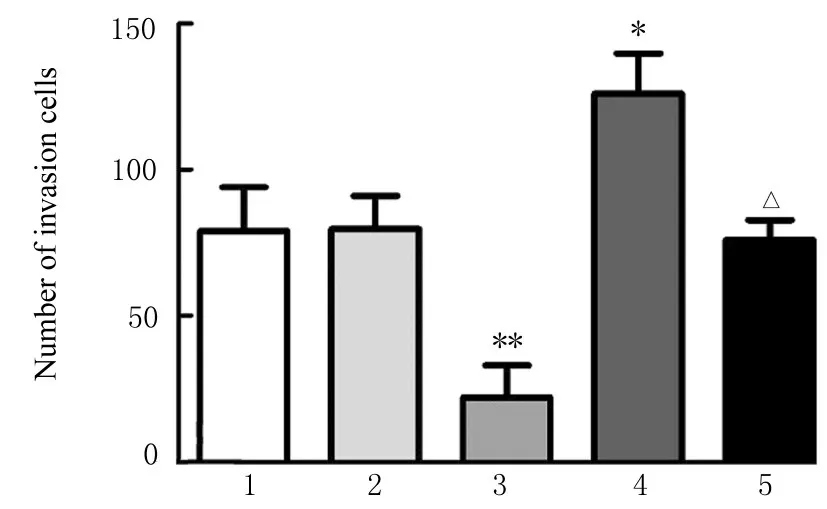
图7 各组ESCs 的侵袭数Fig.7 Number of invasion ESCs in various groups
3 讨 论
尽管EMT 被归类为良性疾病,但其也表现出恶性肿瘤的常见特征,如无限生长、周围组织侵袭和破坏,以及局部或远处转移和易复发性等[13-14]。此外,EC 组织中ESCs 的迁移和侵袭特征与恶性肿瘤细胞几乎相同[15]。然而,ESCs 增殖、迁移和侵袭特性的分子机制尚未完全阐明。目前临床尚无针对EMT 的早期诊断工具或根治性治疗方法。而造成这一现象的原因是EMT 发病机制的复杂性和症状的多样性[16]。因此,确定EMT 的新治疗靶点和生物学标志物具有重要意义。
lncRNAs 和miRNAs 参与多种生物学过程,如细胞增殖、分化、染色体重塑、表观遗传调节、转录修饰和转录后修饰等[17]。此外,miR-21 已被确定为多种肿瘤的关键调节因子[18]。既往研究[10]证实miR-21 在EMT 中呈异常高表达现象。本研究结果显示:miR-21 在EMT 组织和细胞中表达上调,HAND2-AS1 和miR-21 具有靶向性关系。
研究[16]显示:lncRNAs 可能在转录后水平上抑制miRNA 的表达,从而参与细胞增殖、迁移和侵袭等多种生物学行为。本研究结果显示:HAND2-AS1 为miR-21 的上游靶点,在EMT 患者EC 组织和ESCs 中HAND2-AS1 表达明显下调,且在EMT 患者EC 组织中HAND2-AS1 与miR-21的表达呈负相关关系。体外实验进一步证实:HAND2-AS1 通过调节miR-21 抑制ESCs 的增殖、迁移和侵袭。HAND2-AS1 作为一种肿瘤抑制因子,已被证实在子宫内膜样癌、宫颈癌和骨肉瘤等多种肿瘤组织中表达下调,且能抑制肿瘤细胞增殖、侵袭和转移等恶性生物学行为[19-21]。如在子宫内膜癌组织中表达下调的HAND2-AS1 与患者的肿瘤分级、淋巴结转移和复发呈负相关关系,且过表达HAND2-AS1 可明显抑制肿瘤细胞的迁移和侵袭[19]。在宫颈癌中,HAND2-AS1 表达下调同样与患者的不良预后有关,HAND2-AS1 可通过与miR-21 竞争性结合以上调组织金属蛋白酶抑制因子3 表达,抑制肿瘤细胞的增殖、迁移和侵袭,并促进细胞凋亡[20]。本研究结果表明:HAND2-AS1能通过调控miR-21 的表达抑制ESCs 的增殖、迁移和侵袭能力。
综上所述,在EMT 患者EC 组织和ESCs 中表达下调的HAND2-AS1 可通过调控miR-21 抑制ESCs 的增殖、迁移和侵袭,从而参与EMT 的发生发展。提示HAND2-AS1/miR-21 轴可能是EMT诊断和治疗的一个潜在有效的生物标志物。

