lncRNA MALAT1 对肝星状细胞活化的调节作用及其机制
徐菱遥, 魏书堂, 董 勇, 孙正路, 赵俊波, 韩大正
(河南大学第一附属医院消化病科,河南 开封 475100)
肝纤维化是一种病理生理过程,由病毒性肝炎、代谢紊乱、酗酒、胆汁淤积和自身免疫性疾病等慢性肝损伤中持续伤口愈合反应所导致,是肝硬化的早期征兆,可导致肝功能衰竭或肝癌[1-2]。肝星状细胞(hepatic stellate cell,HSC)被认为是肌成纤维细胞的主要前体,活化的HSC 产生大量的细胞外基质(extracellular matrix,ECM),ECM是肝纤维化的主要驱动力[3]。然而,肝纤维化中HSC 细胞活化的分子机制尚未完全阐明。
长链非编码RNA (long non-coding RNA,lncRNA)可通过脂肪肝和胆汁淤积等多种过程在肝脏疾病中发挥作用[4-5]。肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)调控相关机制诱导HSC失活,还可通过增加α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和Ⅰ型胶原蛋白 α1(collagen type Ⅰ alpha 1,COL1A1)等肝纤维化标志物表达促进HSC 活化[7-9]。主动脉内皮细胞中MALAT1 可竞争性结合微小RNA (microRNA,miR)-150-5p,MALAT1 是否靶向miR-150-5p 调控HSC 活化尚不清楚[8,10]。本研究通过生物学预测CXC 趋化因子配体14 (CXC chemokine ligand 14,CXCL14)可能是miR-150-5p 的靶标基因,且CXCL14 可明显改善小鼠体内肝纤维化及抑制由HSC 增殖和释放的COL1A1[11]。
转化生长因子β1(transforming growth factor-β1,TGF-β1)可激活HSC 并产生大量ECM 参与肝纤维化[12]。因此,本研究采用TGF-β1 诱导HSC 模拟肝纤维化状态,探讨MALAT1 对HSC 活化的调节作用及其机制,旨在为肝纤维化的临床治疗提供新的策略。
1 材料和方法
1.1 研究对象收集2020 年1 月—2021 年7 月于河南大学第一附属医院就诊的25 例肝纤维化患者(轻度和重度肝纤维化组)和同期招募的25 例健康志愿者(健康组)和的临床资料。根据基于4因子纤维化指数(fibrosis index based on four factors,FIB-4)评估肝纤维化诊断和分期[13]。将肝纤维化患者分为轻度肝纤维化组(FIB-4<2,12 例)和重度肝纤维化组(2≤FIB-4<4,13 例)。健康组研究对象丙氨酸氨基转移酶和天冬氨酸氨基转移酶活性正常,无肝病或酗酒史,无乙型肝炎、丙型肝炎或人类免疫缺陷病毒感染。研究方案符合《赫尔辛基宣言》制定标准,并获得河南大学第一附属医院伦理委员会批准。所有参与者均签署知情同意书,各组患者一般资料见表1。在轻度和重度肝纤维化组和健康组研究对象首次入院期间采集外周血样本8 mL。由外周血中分离的血清储存于-80 ℃环境中。
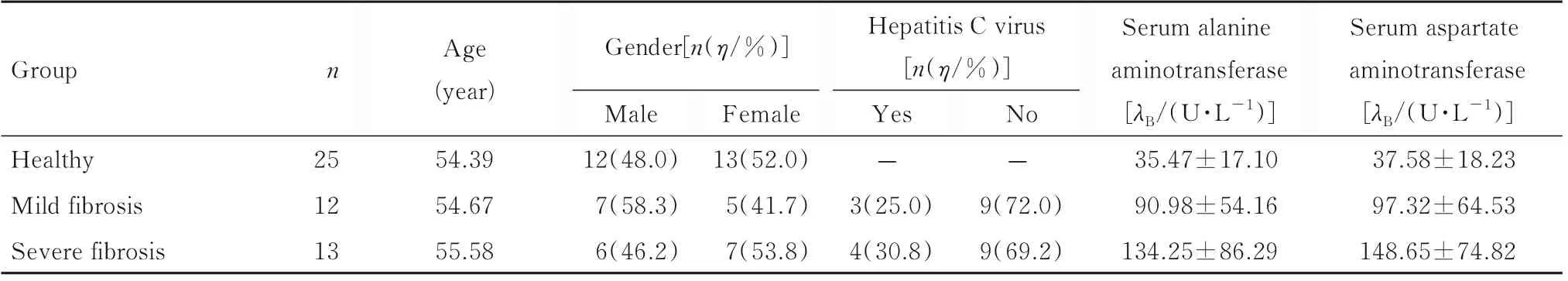
表1 各组研究对象一般资料Tab.1 General informations of subjects in various groups
1.2 细胞、主要试剂和仪器小鼠HSC 购自上海雅吉生物科技有限公司。RPMI-1640 培养基购自上海雅吉生物科技有限公司,1%青-链霉素和10%胎牛血清购自北京伊塔生物科技有限公司,人重组TGF-β1 细胞因子(7754-BH-005/CF)购自美国R&D Systems 公司,TRIzol 试剂和二抗Alexa Fluor 488 偶联山羊抗小鼠IgG 购自美国Invitrogen公司,iScript™ cDNA Synthesis 试剂盒购自美国伯乐生命医学产品有限公司,SYBR Green Real-Time PCR Assay 试剂盒购自日本TAKARA 生物技术有限公司,一抗α-SMA、COL1A1、CXCL14和GAPDH 均购自英国Abcam 贸易有限公司,DAPI 和二抗HRP 标记的山羊抗小鼠IgG 或山羊抗兔IgG 均购自美国Sigma-Aldrich 贸易有限公司,双荧光素酶检测试剂盒购自美国GeneCopoeia 公司,CCK-8 Cell Counting Kit 购自南京VAZYME生物科技有限公司。7500 实时荧光定量PCR(real-time fluorescence quantitative PCR,RTqPCR)仪购自美国应用生物系统公司,E-Gel Imager 凝胶成像系统购自美国赛默飞世尔科技公司,SpectraMax iD5 多功能微孔板读板机购自美谷(上海)分子仪器有限公司,DMi8 倒置荧光显微镜购自徕卡显微系统(上海)贸易有限公司。
1.3 细胞培养HSC 置于含1%青-链霉素和10%胎牛血清的RPMI-1640 培养基,37 ℃、5% CO2培养箱中培养。TGF-β1 诱导HSC,37 ℃环境中培养8~12 h,并与10 μg·L-1TGF-β1 共同孵育24 h[13]。
1.4 细胞转染和分组将TGF-β1 诱导的HSC 以每孔5×105个细胞的密度接种于6 孔细胞培养板中,培养24 h。细胞分为TGF-β1+si-NC 组(转染si-NC)、TGF- β1+si-MALAT1 组 (转染 si-MALAT1)、TGF-β1+si-MALAT1+anti-miR-150-5p 组(转染si-MALAT1 和anti-miR-150-5p)和TGF- β 1+si-MALAT1+CXCL14 组 (转染si-MALAT1 和 CXCL14),转染相应siRNA 1 μg si-NC 和si-MALAT1、miR-150-5p 抑制物20 nm anti-miR-150-5p 及重组载体2 μg CXCL14。同时,选择未经TGF-β1 诱导的HSC 作为对照组,仅经TGF-β1 诱导的HSC 作为TGF-β1 组,培养48 h 后收获细胞。
1.5 RT-qPCR 法检测各组研究对象血清和HSC中 MALAT1 mRNA、miR-150-5p 和 CXCL14 mRNA 表达水平采用TRIzol 试剂提取HSC 和外周血样品中总RNA,采用cDNA 合成试剂盒将总RNA 逆转录为cDNA,采用SYBR Green Real-Time PCR 试剂盒进行扩增。引物序列:MALAT1 F 5′-TGTGACGCGACTGGAGTATG-3′,MALAT1 R 5′-CAAAGGGACTCGGCTCCAAT-3′;miR-150-5p F 5′-CATGGCCCTGTCTCCCAAC-3′,miR-150-5p R 5′-GGCCTGTACCAGGGTCTGA-3′;α-SMA F 5′-CACCATCGGGAATGAACGCTTC-3′,α-SMA R 5′-CTGTCAGCAATGCCTGGGTA-3′;COL1A1 F 5′-GGTCATTCTCTTCGCAGACAG-3′,COL1A1 R 5′-CCACCGGATACTTGGTCTCCA-3′;CXCL14 F 5′-CGCTACAGCGACGTGAAGAA-3′,CXCL14 R 5′-GTTCCAGGCGTTGTACCAC-3′;U6 F 5′-CTCGCTTCGGCAGCACA-3′,U6 R 5′-AACGCTTCACGAATTTGCGT-3′;GAPDH F 5′-AAGGTGAAGGTCGGAGTCA-3′,GAPDH R 5′-GGAAGATGGTGATGGGATTT-3′。反 应 条 件 :95 ℃、3 min;95 ℃、15 s,57 ℃、15 s,72 ℃、45 s,循环30 次;72 ℃、5 min。采用2-ΔΔCt法计算各组研究对象血清和细胞中MALAT1 mRNA、miR-150-5p 和CXCL14 mRNA 表达水平。
1.6 Western blotting 法检测各组研究对象血清和HSC 中CXCL14 蛋白表达水平采用RIPA 裂解缓冲液于冰上进行HSC 和研究对象血清裂解以获取总蛋白,通过SDS-PAGE 分离蛋白并转移至PVDF 膜上。5%脱脂牛奶封闭膜1 h,4 ℃条件下与α-SMA、COL1A1、CXCL14 和GAPDH 一抗孵育过夜。采用含0.1% Tween-20 PBS 缓冲液洗涤膜3 次,将PVDF 膜和HRP 标记的山羊抗小鼠IgG或山羊抗兔IgG 在室温下孵育2 h。采用ECL 化学发光试剂显色。采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 CCK-8 法检测各组HSC 增殖活性将HSC以每孔5×103个细胞的密度接种于96 孔细胞培养板中,37 ℃培养48 h 后,每孔加入10 μL CCK-8 试剂,4 h 后采用酶标仪于波长450 nm 处检测各组HSC 吸光度(A)值。以A 值代表细胞增殖活性。
1.8 免疫荧光法检测各组HSC 中α-SMA 和COL1A1 蛋白表达量将HSC 以每孔5×105个细胞的密度接种至底部带有聚D-赖氨酸包被玻璃盖玻片的12 孔细胞培养板中。4%多聚甲醛固定细胞10 min,PBS 缓冲液洗涤细胞3 次。细胞贴壁后,采用5% BSA 封闭液在室温下放置1 h。随后将细胞与靶向α-SMA 或COL1A1 的一抗于37 ℃下孵育30 min,然后将细胞与Alexa Fluor 488 偶联山羊抗小鼠IgG 二抗于37 ℃下保持30 min。在室温下进行DAPI 染色15 min,采用0.1% Tween-20 PBS 缓冲液冲洗细胞3 次,每次10 min。在荧光显微镜下捕获图像。绿色荧光占蓝色荧光的比例即表示各组HSC 中α-SMA 或COL1A1 蛋白表达量。
1.9 miR-150-5p 与MALAT1 和CXCL14 3′-UTR基因的靶向关系检测及HSC 中荧光素酶活性检测采用http://starbase.sysu.edu.cn/index.php 网站预测 miR-150-5p 与 MALAT1 和CXCL14 3′-UTR 的潜在结合位点。双荧光素酶报告基因测定:含有野生型(WT)或突变体(MUT)miR-150-5p 预 测 的 结 合 位 点 中MALAT1 和CXCL14 3′-UTR 片段通过PCR 从基因组DNA 中扩增并克隆至psi-CHECK2 报告载体中,将 MALAT1/CXCL14 WT 或 MALAT1/CXCL14 MUT 报告载体与miR-150-5p 模拟物(miR-150-5p)或阴性对照(miR-NC)共转染至HSC 中,48 h 后采用双荧光素酶报告基因分析系统检测各组HSC 中荧光素酶活性。
1.10 统计学分析采用SPSS 23.0 统计软件进行统计学分析。各组研究对象血清和各组HSC 中MALAT1 mRNA、miR-150-5p 和CXCL14 mRNA表达水平,各组研究对象血清中CXCL14 蛋白表达水平,各组HSC 中α-SMA 和COL1A1 蛋白表达水平和细胞增殖活性及荧光素酶活性均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组研究对象血清和各组HSC 中MALAT1 mRNA、miR-150-5p 和CXCL14 mRNA 表达水平与健康组比较,轻度和重度肝纤维化组患者血清中MALAT1 mRNA 和CXCL14 mRNA 表达水平升高(P<0.05),miR-150-5p 表达水平降低(P<0.05)。与轻度肝纤维化组比较,重度肝纤维化组患者血清中MALAT1 mRNA 和CXCL14 mRNA表达水平升高(P<0.05),miR-150-5p 表达水平降低(P<0.05)。见表2。
表2 各组研究对象血清中MALAT1 mRNA、miR-150-5p 和CXCL14 mRNA 表达水平Tab.2 Expression levels of serum MALAT1 mRNA, miR-150-5p, and CXCL14 mRNA of subjects in various groups (±s)

表2 各组研究对象血清中MALAT1 mRNA、miR-150-5p 和CXCL14 mRNA 表达水平Tab.2 Expression levels of serum MALAT1 mRNA, miR-150-5p, and CXCL14 mRNA of subjects in various groups (±s)
*P<0.05 compared with healthy group;△P<0.05 compared with mild liver fibrosis group.
Group Healthy Mild liver fibrosis Severe liver fibrosis CXCL14 mRNA 1.04±0.04 1.57±0.09*2.03±0.14*△n 25 12 13 MALAT1 mRNA 1.02±0.04 2.59±0.14*4.18±0.22*△miR-150-5p 1.05±0.04 0.46±0.05*0.32±0.02*△
与对照组比较,TGF-β1 组HSC 中MALAT1 mRNA 和CXCL14 mRNA 表达水平均升高(P<0.05),miR-150-5p 表达水平降低(P<0.05);与TGF-β1+si-NC 组比较,TGF-β1+si-MALAT1 组HSC 中MALAT1 mRNA 和CXCL14 mRNA 表达水平均降低(P<0.05),miR-150-5p 表达水平升高(P<0.05)。与TGF-β1+si-MALAT1 组比较,TGF- β1+si-MALAT1+anti-miR-150-5p 组HSC 中MALAT1 mRNA 表达水平差异无统计学意义(P>0.05),miR-150-5p 表达水平降低(P<0.05),CXCL14 mRNA 表达水平升高(P<0.05);TGF-β1+si-MALAT1+CXCL14 组HSC中MALAT1 mRNA 和miR-150-5p 表达水平差异无统计学意义(P>0.05),CXCL14 mRNA 表达水平升高(P<0.05)。见表3。
表3 各组HSC 中MALAT1、miR-150-5p 和CXCL14 mRNA 表达水平Tab.3 Expression levels of MALAT1, miR-150-5p and CXCL14 mRNA in HSC in various groups (±s)

表3 各组HSC 中MALAT1、miR-150-5p 和CXCL14 mRNA 表达水平Tab.3 Expression levels of MALAT1, miR-150-5p and CXCL14 mRNA in HSC in various groups (±s)
*P<0.05 compared with control group;△P<0.05 compared with TGF-β1+si-NC group;#P<0.05 compared with TGF-β1+si-MALAT1 group.
CXCL14 mRNA 1.01±0.05 2.89±0.20*2.61±0.16 1.42±0.11△1.89±0.12#2.05±0.15#Group Control TGF-β1 TGF-β1+si-NC TGF-β1+si-MALAT1 TGF-β1+si-MALAT1+anti-miR-150-5p TGF-β1+si-MALAT1+CXCL14 MALAT1 1.05±0.03 3.77±0.21*3.59±0.17 1.64±0.12△1.56±0.13 1.78±0.15 miR-150-5p 1.02±0.04 0.28±0.03*0.31±0.05 0.75±0.06△0.46±0.04#0.68±0.04
2.2 各组研究对象血清中CXCL14 蛋白表达水平和各组HSC 中CXCL14、α-SMA 及COL1A1 蛋白表达水平与健康组(0.29±0.03)比较,轻度和重度肝纤维化组患者血清中CXCL14 蛋白表达水平(0.56±0.05 和0.67±0.04)升高(P<0.05)。与轻度肝纤维化组比较,重度肝纤维化组患者血清中CXCL14 蛋白表达水平升高(P<0.05)。见图1。
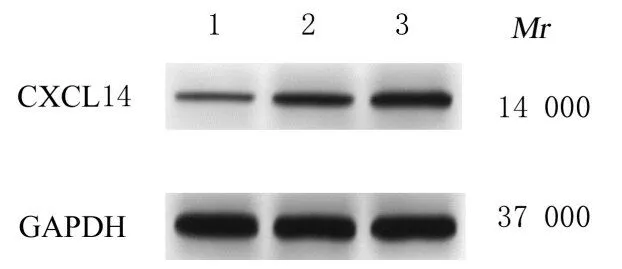
图1 Western blotting 法检测各组研究对象血清中CXCL14 蛋白表达电泳图Fig.1 Electrophoregram of expressions of serum CXCL14 protein in subjects in various groups detected by Western blotting method
与对照组比较,TGF-β1 组细胞中CXCL14、α-SMA 和COL1A1 蛋白表达水平升高(P<0.05);与TGF-β1+si-NC组比较,TGF-β1+si-MALAT1组细胞中CXCL14、α-SMA 和COL1A1 蛋白表达水平降低(P<0.05);与TGF-β1+si-MALAT1 组比较,TGF- β1+si-MALAT1+anti-miR-150-5p 组和TGF- β1+si-MALAT1+CXCL14 组细胞中CXCL14、α-SMA 和COL1A1 蛋白表达水平升高(P<0.05)。见图2 和表4。
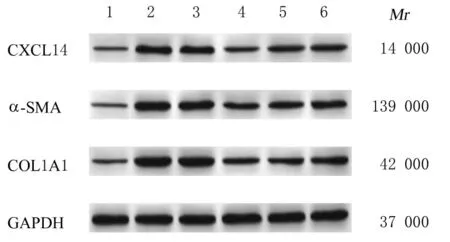
图2 Western blotting 法检测各组HSC 中CXCL14、α-SMA 和COL1A1 蛋白表达电泳图Fig.2 Electrophoregram of expressions of CXCL14 α-SMA, and COL1A1 proteins in HSC in various groups detected by Western blotting method
表4 各组HSC 中CXCL14、α-SMA 和COL1A1 蛋白表达水平Tab.4 Expression levels of CXCL14, α-SMA, and COL1A1 proteins in HSC in various groups (±s)
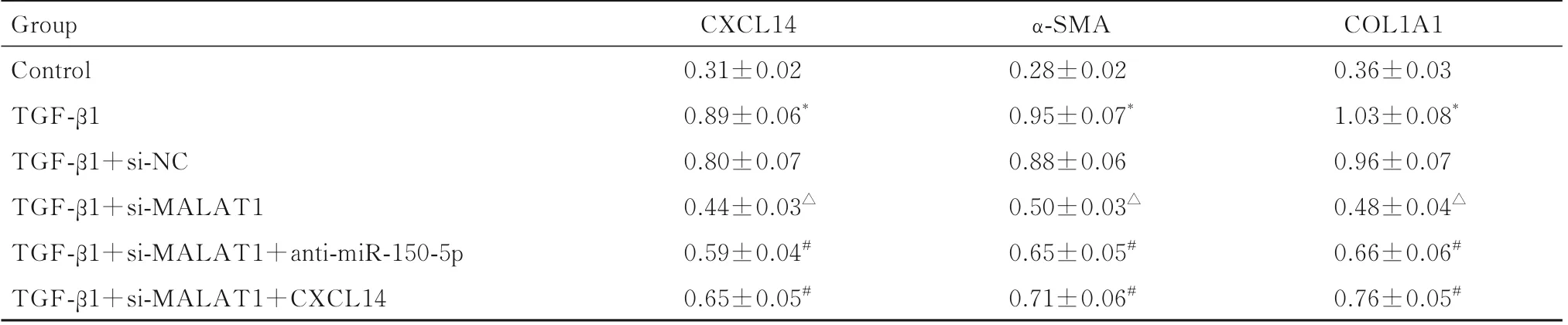
表4 各组HSC 中CXCL14、α-SMA 和COL1A1 蛋白表达水平Tab.4 Expression levels of CXCL14, α-SMA, and COL1A1 proteins in HSC in various groups (±s)
*P<0.05 compared with control group;△P<0.05 compared with TGF-β1+si-NC group;#P<0.05 compared with TGF-β1+si-MALAT1 group.
COL1A1 0.36±0.03 1.03±0.08*0.96±0.07 0.48±0.04△0.66±0.06#0.76±0.05#Group Control TGF-β1 TGF-β1+si-NC TGF-β1+si-MALAT1 TGF-β1+si-MALAT1+anti-miR-150-5p TGF-β1+si-MALAT1+CXCL14 CXCL14 0.31±0.02 0.89±0.06*0.80±0.07 0.44±0.03△0.59±0.04#0.65±0.05#α-SMA 0.28±0.02 0.95±0.07*0.88±0.06 0.50±0.03△0.65±0.05#0.71±0.06#
2.3 各组HSC 增殖活性与对照组(0.38±0.04)比较,TGF-β1 组HSC 增殖活性(0.87±0.06)升高(P<0.05)。与TGF-β1+si-NC 组(0.82±0.05)比较,TGF- β1+si-MALAT1 组HSC 增殖活性(0.48±0.03)降低(P<0.05)。与TGF- β 1+si-MALAT1 组比较,TGF- β 1+si-MALAT1+anti-miR-150-5p 组 和 TGF- β1+si-MALAT1+CXCL14 组HSC 增殖活性(0.61±0.05 和0.65±0.06)均升高(P<0.05)。
2.4 各组HSC 中α-SMA 和COL1A1 蛋白表达量免疫荧光检测结果显示:各组HSC 中α-SMA和COL1A1 蛋白表达与Western blotting 法检测结果一致。与对照组比较,TGF- β 1 组HSC 中α-SMA 和COL1A1 蛋白表达量增加。与TGF-β1+si-NC 组比较,TGF-β 1+si-MALAT1 组HSC 中α-SMA 和COL1A1 蛋白表达量减少。与TGF-β1+si-MALAT1 组比较,TGF- β 1+si-MALAT1+anti-miR-150-5p 组 和 TGF- β 1+si-MALAT1+CXCL14 组HSC 中α-SMA 和COL1A1 蛋白表达量增加。见图3。

图3 各组HSC 中α-SMA 和COL1A1 蛋白表达(免疫荧光,×200)Fig.3 Expressions of α-SMA and COL1A1 proteins in HSC in various groups(Immunofluorescence,×200)
2.5 miR-150-5p 与MALAT1 或CXCL14 靶向关系生物信息学预测MALAT1 或CXCL14 3′-UTR与miR-150-5p 存在靶向关系,且经双荧光素酶报告基因测定,与miR-NC 组比较,与MALAT1 WT 或CXCL14 WT 共转染的miR-150-5p 组细胞中荧光素酶活性降低(P<0.05),与MALAT1 MUT 或CXCL14 MUT 共转染的miR-150-5p 组细胞中荧光素酶活性差异无统计学意义(P>0.05)。见图4 和表5。

图4 miR-150-5p 与MALAT1 或CXCL14 结合位点图Fig.4 Binding site diagram between miR-150-5p and MALAT1 or CXCL14
表5 双荧光素酶报告基因检测miR-150-5p 与MALAT1 或CXCL14 靶向关系Tab.5 Target relationship between miR-150-5p and MALAT1 or CXCL14 detected by dual luciferase reporter gene(±s)

表5 双荧光素酶报告基因检测miR-150-5p 与MALAT1 或CXCL14 靶向关系Tab.5 Target relationship between miR-150-5p and MALAT1 or CXCL14 detected by dual luciferase reporter gene(±s)
Group miR-NC miR-150-5p CXCL14 MUT 1.01±0.05 0.97±0.04 MALAT1 WT 1.05±0.02 0.32±0.04*MALAT1 MUT 0.98±0.05 0.94±0.04 CXCL14 WT 1.02±0.04 0.41±0.03*
3 讨 论
肝纤维化会增加肝硬化的发病率[2]。研究[3]显示:通过抑制HSC 活化和减少ECM 沉积或加速ECM 降解是治疗肝纤维化的有效手段。研究[4-5]显示:lncRNA 在肝纤维化的发展中发挥重要作用,lncRNA 可参与多种疾病的发生发展。然而,lncRNA 在肝纤维化中的作用尚未完全阐明。本研究结果显示:MALAT1 的高表达与肝纤维化有关,MALAT1 敲低抑制TGF-β1 诱导HSC 活化,表现为抑制HSC 细胞增殖活性和α-SMA 和COL1A1 蛋白表达。
JI 等[14]于2003 年在非小细胞肺癌中发现MALAT1,MALAT1 位于人类染色体11q13.1 和小鼠染色体19qA,长度约为8 700 nt。研究[15-16]证实:MALAT1 是各种人类癌症的肿瘤促进因子,包括胃癌和乳腺癌等。MALAT1 沉默有助于抑制肿瘤细胞增殖和诱导细胞凋亡[17]。WANG 等[8]报道:肝纤维化患者血清中MALAT1 mRNA 表达水平较高,与肝纤维化程度呈正相关关系。MALAT1 表达的敲低抑制了HSC 活化[9]。本研究结果显示:MALAT1 可作为HSC 活化的激动剂,体外MALAT1 的敲低通过抑制细胞增殖逆转了TGF-β1 干预对HSC 的影响。MALAT1 可能作为竞争性内源RNA (competitive endogenous RNA,ceRNA)参与miR-150-5p 对CXCL14 的调节。
部分lncRNA 可能参与ceRNA 调控回路。MALAT1 在肾纤维化疾病和脑缺血再灌注损伤中负调节miR-145[18-19]。本研究证实了miR-150-5p 与MALAT1 的直接结合能力。miR-150-5p 在各种纤维化疾病中发挥重要作用。研究[20-21]显示:miR-150-5p 抑制肾纤维化和心脏纤维化。DU 等[22]发现:间充质干细胞中miR-150-5p 通过靶向CXCL1在体内和体外明显降低纤维化因子水平,并降低HSC 活化水平,进而减轻肝纤维化。此外,CXCL14 参与肝纤维化的发病,可作为肝纤维化的潜在遗传靶点[23]。CXCL14 沉默可抑制HSC 活化[11]。本研究结果显示:CXCL14 蛋白表达受MALAT1/miR-150-5p 的调节,抑制miR-150-5p 或过表达CXCL14 可明显逆转敲低MALAT1 对HSC增殖和纤维化标志物α-SMA 和COL1A1 蛋白表达的影响,表明敲低MALAT1 可能通过miR-150-5p/CXCL14 轴抑制TGF-β1 诱导HSC 活化。
综上所述,在肝纤维化患者中CXCL14 表达上调,MALAT1 靶向调节CXCL14,形成MALAT1/miR-150-5p/CXCL14 通路调节TGF-β1 诱导HSC活化。MALAT1 调控HSC 活化的机制可能为肝纤维化的发病机制和可能的靶向治疗提供新的依据。

