lncRNA PAX8-AS1 对结直肠癌细胞增殖、凋亡和侵袭的作用及其机制
闫圣玉, 刘昌化, 许志杰, 丁雅婷, 谢亚锋, 张 侨, 刘菀莹
(1.南华大学衡阳医学院附属第二医院肛肠科,湖南 衡阳 421000;2.南华大学衡阳医学院附属第二医院胃肠外科,湖南 衡阳 421001)
结直肠癌(colorectal cancer,CRC)是一种常见的恶性肿瘤,其无特异临床表现且生存时间与确诊时疾病分期密切相关。CRC 在我国消化道肿瘤中发病率位于第3 位,且呈逐年上升的趋势。为了提高CRC 治疗效果、减少副作用并降低发生继发性肿瘤的风险,仍需寻找更好的治疗手段。因此针对CRC 发病特点的定点靶向治疗对CRC 的治疗和预后具有重要意义[1]。研究[2-3]发现:长链非编码RNA(long non-coding RNA,lncRNA)参与CRC的发生发展,可介导CRC 细胞增殖、侵袭和转移。lncRNA 配对盒8 反义RNA 1 (lncRNA PAX8-AS1)在鼻咽癌和乳头状甲状腺癌组织中低表达,其过表达可抑制肿瘤细胞生长[4-5]。但也有研究[6]表明:PAX8-AS1 在非小细胞肺癌中过表达,其沉默可降低非小细胞肺癌的细胞增殖活性和迁移能力。PAX8-AS1 在CRC 组织中高表达,因此CRC细胞恶性生物学行为可能与PAX8-AS1 高表达有关联。微小RNA (microRNA,miRNA)作为一种长度为18~25 个核苷酸的单链非编码RNA,也参与了恶性肿瘤的不同过程,如在CRC 组织和细胞中,miR-22-3p 明显下调,miR-22-3p 能够通过介导RAS 癌基因家族成员RAP2B/磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B (protein kinase B,Akt)通路明显抑制CRC细胞增殖和侵袭[7]。然而PAX8-AS1 是否通过miR-22-3p 介导CRC 的生物学行为尚未完全阐明。本研究探讨PAX8-AS1 和miR-22-3p 在CRC 细胞中表达及其对CRC 细胞增殖、凋亡和侵袭的影响,并阐明其作用机制。
1 材料与方法
1.1 临床资料选择2018 年7 月—2020 年12 月在南华大学衡阳医学院附属第二医院肛肠科行手术切除的94 例CRC 患者为研究对象,所有患者均经证实患有CRC,收集CRC 患者癌组织及对应癌旁组织(距癌灶边缘>5 cm 取材)标本。根据国际抗癌联盟(Union for International Cancer Control,UICC)制订的TNM 分期第8 版标准[8]对CRC 患者进行临床分期,其中Ⅰ~Ⅱ期35 例,Ⅲ~Ⅳ期59 例。
1.2 纳入和排除标准纳入标准:①初次诊断为CRC 者;②临床资料完整;③依从性较好者;④生存时间超过6 个月。排除标准:①并发其他恶性肿瘤者;②患有自身免疫性疾病者;③精神疾病患者。本研究经本院伦理委员会批准,且所有患者知情并签署同意书。
1.3 细胞、主要试剂和仪器人CRC 细胞(SW480、SW620、HT-29 和LoVo)购自中国科学院细胞库,人正常结肠上皮细胞NCM460 购自武汉普诺赛生命科技有限公司。DMEM 和RPMI-1640 培养基(美国Hyclone 公司),胎牛血清(美国Gibco 公司),磷酸盐(phosphate buffer solution,PBS)缓冲液、0.25%胰蛋白酶和DMSO(美国Sigma 公司),MTT 试剂盒(北京索莱宝科技有限公司),Annexin Ⅴ-FITC/PI 凋亡检测试剂盒(上海碧云天生物技术有限公司),TRIzol 试剂(美国Ambion 公司),SYBR FAST qPCR Master Mix(美国KAPA Biosystems 公司),ECL 显影液(美国Millipore 公司),兔抗人B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)抗体、兔抗人Bcl-2 相关 X 蛋白(Bcl-2-associated X protein,Bax)抗体、兔抗人cleaved Caspase-3 抗体和兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(英国Abcam 公司),HRP 标记羊抗兔二抗(武汉爱博泰克生物科技有限公司),小分子si-PAX8-AS1 和miRNA-22-3p 抑制剂(miR-22-3p inhibitors)均由广州锐博生物科技有限公司合成,双荧光素酶报告基因检测质粒由北京擎科生物技术有限公司合成。倒置显微镜(型号:DMIL LED,德国Leica 公司),酶标仪(型号:AMR-100,杭州奥盛仪器有限公司),流式细胞仪(型号:Accuri C6,美国BD 公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RTqPCR)仪(型号:CFX-Connect 96,美国Bio-Rad公司),全自动化学发光分析仪(型号:Tanon-5200,上海天能科技有限公司)。
1.4 细胞转染和分组取冻存的人CRC 细胞(SW480、SW620、HT-29 和LoVo)和人正常结肠上皮细胞NCM460 复苏后,NCM460 细胞采用含10%胎牛血清的DMEM 培养基培养,CRC 细胞采用含10%胎牛血清的RPMI-1640 完全培养基培养,置于37 ℃、5%CO2的培养箱内,培养2~3 d传代1 次。
取对数生长期SW480 细胞,以每孔1×104个细胞的密度接种于24 孔细胞培养板中。待细胞生长融合至80%时,采用LipofectamineTM2000 转染试剂将si-PAX8-AS1 及其小分子序列阴性对照(siRNA-negative control,si-NC)分别或同时与miR-22-3p inhibitors 及其小分子抑制剂阴性对照(inhibitors negative control,inhibitors NC)转染至细胞中,分为si-NC 组(转染阴性序列)、si-PAX8-AS1 组 (转染 PAX8-AS1 siRNA)、si-PAX8-AS1+inhibitors NC 组(共转染PAX8-AS1 siRNA 和 inhibitors NC)和 si-PAX8-AS1+inhibitors 组(共转染PAX8-AS1 siRNA 和miR-22-3p inhibitors),另取未经任何转染的SW480细胞作为对照组。转染48 h后收集各组细胞沉淀用于后续实验。
1.5 RT-qPCR 法检测CRC 患者癌组织、细胞和各组SW480 细胞中PAX8-AS1 mRNA 和miR-22-3p表达水平收集CRC 患者癌组织、癌旁组织及细胞,采用TRIzol 试剂提取癌组织和各组细胞总RNA,逆转录试剂盒将RNA 反转录合成cDNA,以cDNA 为模板,采用RT-qPCR 仪进行PCR 扩增,反应总体积20 μL (SYBR FAST qPCR Master Mix:10 μL,上、下游引物各0.5 μL,cDNA:1 μL,DNase/RNase-Free water:8 μL),反应条件及过程:95 ℃预变性3 min,95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,40 个循环,每个样本设3 个复孔。采用2-ΔΔCt法计算目的基因mRNA 表达水平。引物序列见表1。
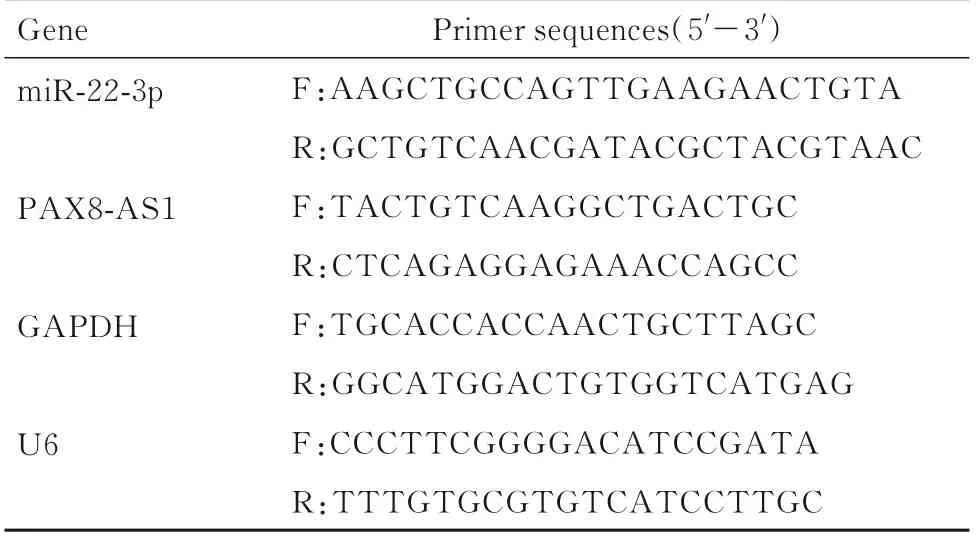
表1 PCR 引物序列Tab.1 Primer sequences of PCR
1.6 MTT 法检测各组细胞增殖活性取转染后的各组细胞,以 1×103mL-1的密度接种于96 孔细胞培养板中,分别于培养 24、48 和72 h 后,吸去原培养基,每孔加入20 μL MTT 充分混匀,室温培养4 h,每孔加入 100 μL DMSO混匀,培养15 min,于酶标仪上检测波长490 nm 处吸光度(A)值,以A(490)值代表细胞增殖活性。
1.7 流式细胞术检测各组细胞凋亡率取转染后的各组细胞,以1.5×104mL-1的细胞密度接种于6 孔细胞培养板中,培养24 h 后收集细胞,500 g 离心5 min,弃上清,加入1 mL 预冷PBS 缓冲液重悬,500 g 离心5 min,弃上清,加入500 μL 1×Binding Buffer 重悬细胞,避光条件下加入 5 μL Annexin Ⅴ-FITC 混匀,再加入10 μL PI 混匀,室温避光孵育15 min,采用流式细胞仪检测细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.8 Transwell 小室实验检测各组细胞迁移和侵袭率取转染后的各组细胞,无血清培养液重悬细胞,调整细胞浓度至1.0×105mL-1,取100 μL接种于Transwell 上室,下室加入含血清培养液,培养48 h,弃去培养液,棉签擦去上层细胞,甲醛固定,加入结晶紫染色30 min,漂洗干燥,用棉签小心擦去Transwell 小室中未迁移细胞,置于200 倍显微镜下观察,计数每个视野中迁移细胞数。采用基质胶包被Transwell 上室,其余操作同迁移实验,计数侵袭细胞数,并计算各组细胞迁移和侵袭率。细胞迁移率=迁移细胞数/接种细胞数×100%;细胞侵袭率=侵袭细胞数/接种细胞数×100%。
1.9 Western blotting 法检测各组细胞中Bcl-2、Bax 和cleaved Caspase-3 蛋白表达水平收集转染后各组细胞,RIPA 裂解液提取细胞全蛋白。采用BCA 法测定蛋白浓度,取25 μg 蛋白配置上样体系,沸水浴变性后采用SDS-PAGE 凝胶电泳分离蛋白,电泳分离后通过湿转法将蛋白转移至PVDF膜上,5 %脱脂奶粉于室温条件下封闭2 h,分别加入一抗Bcl-2 (1∶2 000)、Bax (1∶2 000)、cleaved Caspase-3 (1∶1 000)和GAPDH (1∶5 000),于4 ℃孵育过夜。洗膜后,采用HRP 标记的羊抗兔二抗于室温条件下孵育1 h;洗膜后,采用ECL 发光试剂盒A 液和B 液等比混匀,在凝胶成像系统中显影。采用Image J Plus 7.0 分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.10 双荧光素酶报告基因实验验证PAX8-AS1 与miR-22-3p 的靶向关系采用生物信息学网站Target San 预测PAX8-AS1 与miR-22-3p 的靶向关系。将PAX8-AS1 野生型(WT)和突变型(MUT)基因靶点荧光素酶表达载体分别与mimics NC 和miR-22-3p mimics 共转染至SW480 细胞中,转染48 h 后采用酶标仪检测萤火虫荧光素酶荧光强度(F)值和海肾荧光素酶荧光强度(R)值,计算各组细胞荧光素酶活性。荧光素酶活性=F 值/R 值。
1.11 统计学分析采用SPSS 22.0 统计软件进行统计学分析。CRC 组织及癌旁组织中PAX8-AS1 mRNA 和 miR-22-3p 表达水平,各组细胞增殖活性、细胞凋亡率、细胞迁移率和细胞侵袭率,各组细胞中Bcl-2、Bax 和 cleaved Caspase-3 蛋白表达水平和荧光素酶活性均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 CRC 组织和细胞中PAX8-AS1 mRNA 和miR-22-3p 表达水平RT-qPCR 结果显示:与癌旁组织比较,CRC 组织中PAX8-AS1 mRNA 表达水平明显升高(P<0.01),miR-22-3p 表达水平明显降低(P<0.01)。与NCM460 细胞比较,SW480、SW620、HT-29 和LoVo 细胞中PAX8-AS1 mRNA表达水平明显升高(P<0.05 或P<0.01),miR-22-3p 表达水平明显降低(P<0.05 或P<0.01),其中以SW480 细胞中表达水平差异最为明显。见图1 和2。
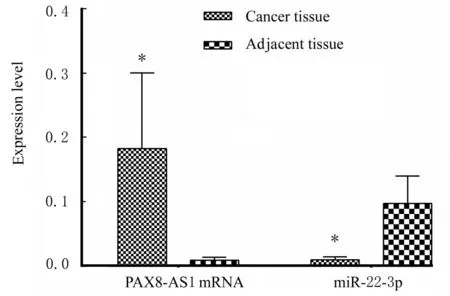
图1 CRC 患者癌组织和癌旁组织中PAX8-AS1 mRNA 和miR-22-3p 表达水平Fig.1 Expression levels of PAX8-AS1H mRNA and miR-22-3p in cancer tissue and adjacent tissue of CRC patients
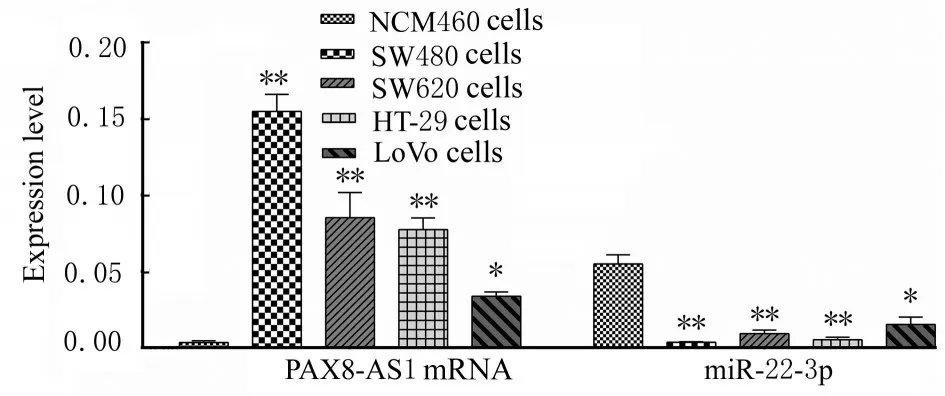
图2 各种细胞中PAX8-AS1 mRNA 和miR-22-3p 表达水平Fig.2 Expression levels of PAX8-AS1 mRNA and miR-22-3p in different kinds of cells
2.2 各组SW480 细胞中PAX8-AS1 mRNA 和miR-22-3p 表达水平与对照组和si-NC 组比较,si-PAX8-AS1 组细胞中PAX8-AS1 mRNA 表达水平明显降低(P<0.01),miR-22-3p 表达水平明显升高(P<0.01)。与si-NC 组比较,si-PAX8-AS1+ inhibitors NC 组细胞中miR-22-3p 表达水平明显升高(P<0.01),si-PAX8-AS1+inhibitors 组细胞中miR-22-3p 表达水平差异无统计学意义(P>0.05)。见图3。
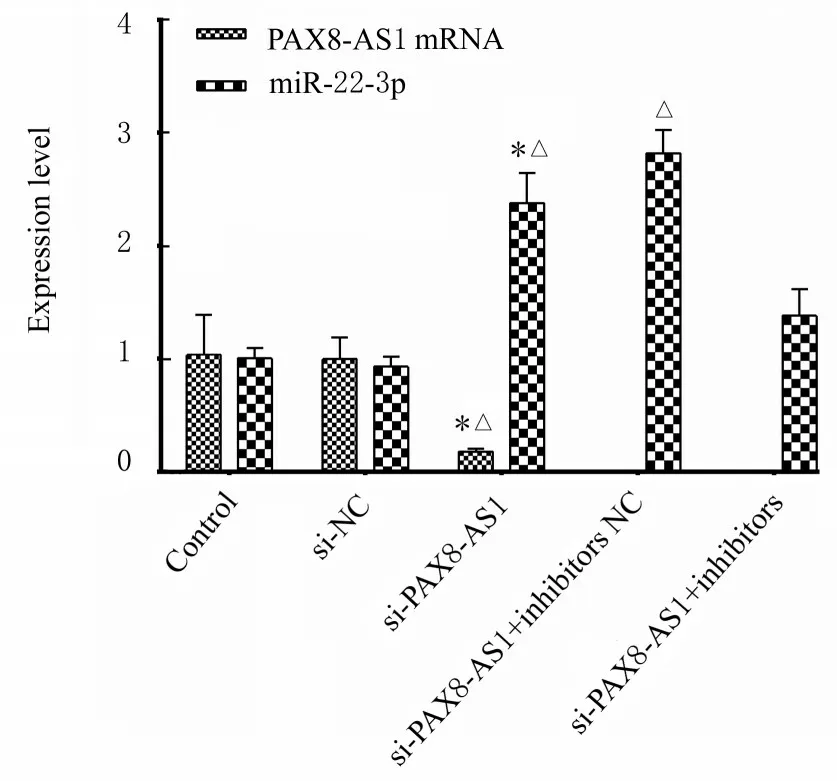
图3 各组SW480 细胞中PAX8-AS1 mRNA 和miR-22-3p 表达水平Fig.3 Expression levels of PAX8-AS1 mRNA and miR-22-3p in SW480 cells in various groups
2.3 不同时间点各组SW480 细胞增殖活性
MTT 法检测结果显示:与对照组比较,si-PAX8-AS1 组、si-PAX8-AS1+inhibitors NC 组和si-PAX8-AS1+inhibitors 组细胞在培养48 和72 h 时细胞增殖活性均明显降低(P<0.01)。与si-NC 组比较,si-PAX8-AS1 组和si-PAX8-AS1+ inhibitors NC 组细胞在培养48 和72 h 时细胞增殖活性均明显降低(P<0.01),si-PAX8-AS1+inhibitors 组细胞在培养24、48 和72 h 时细胞增殖活性差异无统计学意义(P>0.05)。见图4。
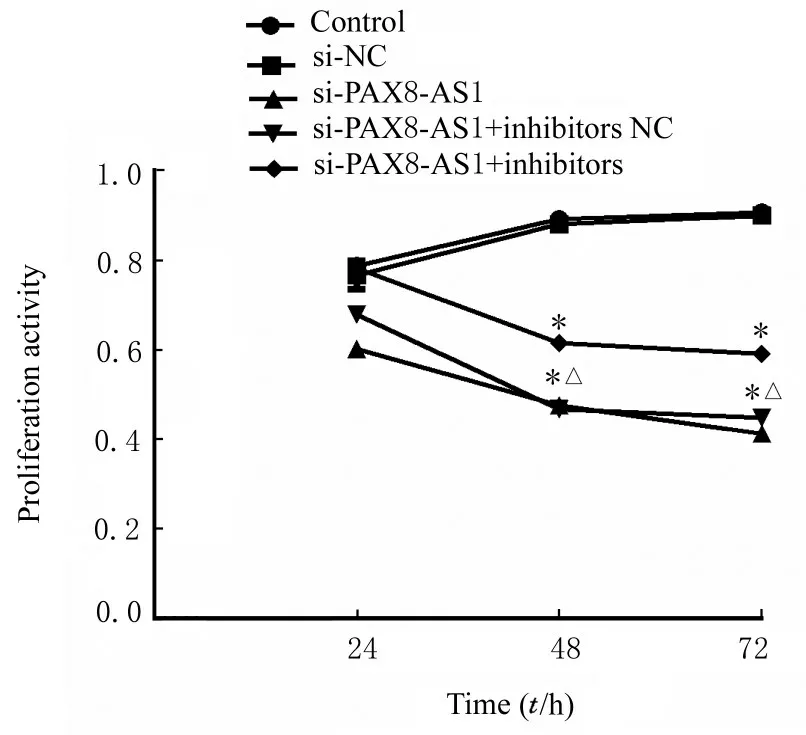
图4 不同时间点各组SW480 细胞增殖活性Fig.4 Proliferation activities of SW480 cells at different time points in various groups
2.4 各组SW480 细胞凋亡率流式细胞术检测结果显示:与对照组比较,si-PAX8-AS1 组细胞凋亡率明显升高(P<0.01)。与si-NC 组比较,si-PAX8-AS1 组和si-PAX8-AS1+ inhibitors NC 组细胞凋亡率明显升高(P<0.01)。见图5。
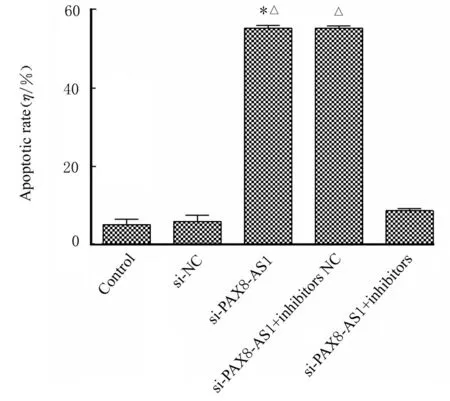
图5 各组SW480 细胞凋亡率Fig.5 Apoptotic rates of SW480 cells in various groups
2.5 各组细胞迁移率和侵袭率Transwell 实验结果显示:与对照组比较,si-PAX8-AS1 组细胞迁移率和侵袭率明显降低(P<0.01)。与si-NC 组比较,si-PAX8-AS1 组和si-PAX8-AS1+ inhibitors NC 组细胞迁移率和侵袭率明显降低(P<0.01),si-PAX8-AS1+inhibitors 组细胞迁移率和侵袭率差异无统计学意义(P>0.05)。见图6。
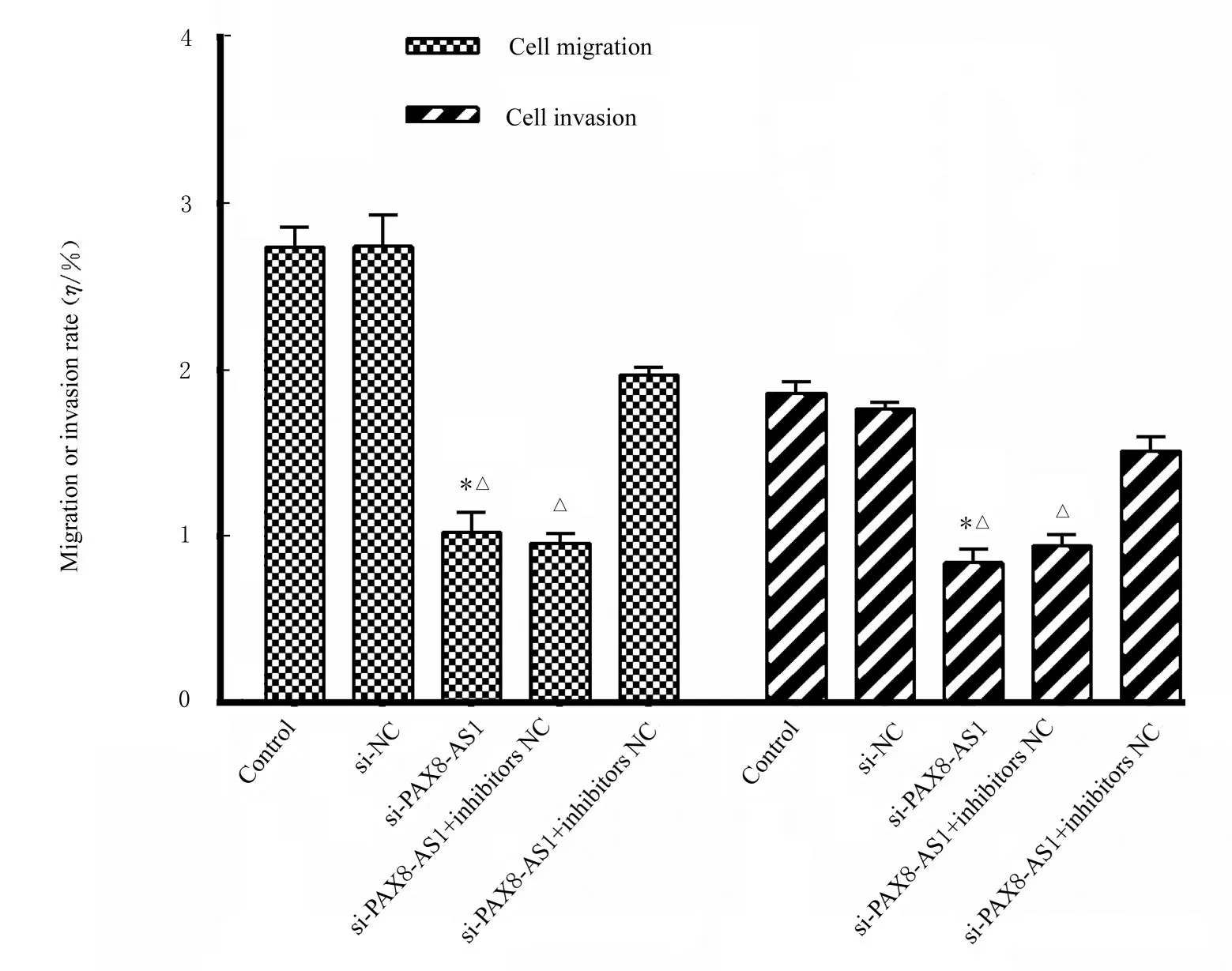
图6 各组细胞侵袭和迁移率Fig.6 Migration and invasion rates of cells in various groups
2.6 各组SW480 细胞中Bcl-2、Bax 和cleaved Caspase-3 蛋白表达水平Western blotting 法检测结果显示:与对照组和si-NC 组比较,si-PAX8-AS1 组SW480 细胞中Bax 和cleaved Caspase-3 蛋白表达水平明显升高(P<0.01),Bcl-2 蛋白表达水平降低(P<0.05)。见图7。
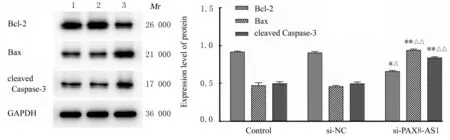
图7 各组SW480 细胞中Bcl-2、Bax 和cleaved Caspase-3 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram (A) and histogram(B) of expressions of Bcl-2, Bax and cleaved Caspase-3 proteins in SW480 cells in various groups
2.7 PAX8-AS1 和miR22-3p 的靶向关系和各组细胞中荧光素酶活性生物信息学网站TargetScan 预测显示:PAX8-AS1 与miR22-3p 存在靶向结合位点。双荧光素酶报告基因实验结果显示:与共转染mimics NC 的细胞比较,共转染miR-22-3p mimics的PAX8-AS1-WT 细胞中荧光素酶活性明显降低(P<0.01),而共转染miR-22-3p mimics PAX8-AS1- MUT 细胞中荧光素酶活性差异无统计学意义(P>0.05)。见图8。
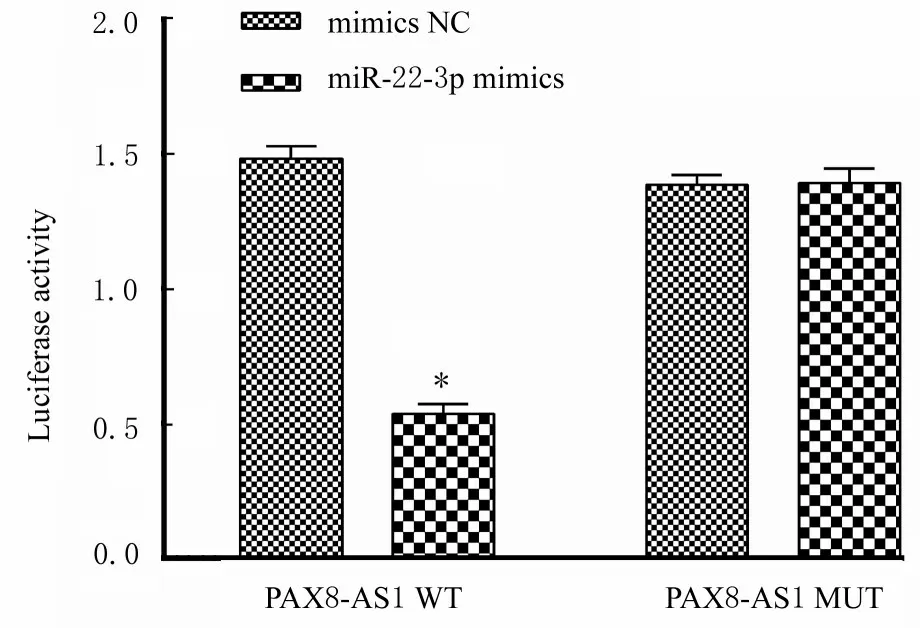
图8 各组细胞中荧光素酶活性Fig.8 Lucriferase activities of cells in various groups
3 讨 论
CRC 是全球最常见的癌症之一,由于其在全球范围内的高发病率和高死亡率,CRC 已成为全球公共卫生问题[9]。寻找CRC 特异性肿瘤标志物和治疗靶点对于 CRC 早期检测和预后预测的准确性具有重要意义。
由于高通量基因组测序工具的发展,发现新的 lncRNAs 通常与癌症有关,特别是与 CRC 有关。在生理条件下,lncRNA 调节基因表达、表观遗传印记或可变剪接,充当原癌基因或肿瘤抑制基因[10]。研究[11]表明:lncRNA 与人类疾病密切相关。作为癌基因或抑癌基因,lncRNA 表达失调与癌症的进展密切相关,其可以调节上皮间质转化(epithelial-mesenchymal transition,EMT)、细胞转移、凋亡、迁移和侵袭[12-16]。本研究结果显示:PAX8-AS1 在 CRC 组织和细胞中高表达。si-PAX8-AS1 转染的CRC 细胞增殖、迁移和侵袭能力受到抑制,凋亡增加。表明PAX8-AS1 在CRC 中作为癌基因影响肿瘤细胞的恶性生物学行为。
研究[17-18]表明:miR-22-3p 作为抑癌基因,在CRC 组织中明显下调,并在体外抑制 CRC 细胞增殖、集落形成、细胞迁移和侵袭能力,在体内抑制 CRC 异种移植肿瘤的生长。本研究结果显示:miR-22-3p 在 CRC 组织和细胞中低表达,与PAX8-AS1 基因高表达呈负相关关系。通过抑制PAX8-AS1 基因的表达,抑制了CRC 细胞的增殖、迁移和侵袭能力,且促进了miR-22-3p 表达水平。提示PAX8-AS1 与miR-22-3p 可能存在靶向调控关系。
研究[19]表明:lncRNA 通过海绵化miRNAs参与内源竞争RNA(competing endogenous RNAs,ceRNAs)。lncRNA HULC 过表达通过海绵化miR-372 促进肝癌的发展和癌细胞侵袭[20]。此外,lncRNA RP4 充当miR-7-5p 的ceRNA 以调控CRC进展[21]。本研究通过生物信息学分析发现PAX8-AS1 可能靶向miR-22-3p。通过荧光素酶报告基因实验验证PAX8-AS1 与miR-22-3p 之间的直接相互作用。抑制PAX8-AS1 表达能够促进 miR-22-3p 表达上调,并进一步抑制CRC 细胞增殖、迁移和侵袭能力,诱导细胞凋亡。
综上所述,PAX8-AS1 通过海绵化吸附 miR-22-3p 对CRC 细胞增殖、凋亡及侵袭产生影响,调控CRC 进展。本研究结果为PAX8-AS1 作为CRC的治疗靶点提供了新的理论依据。

