防风野生品对大鼠类风湿性关节炎的改善作用及其机制
林 喆, 王泰栋, 黄晓巍, 马 超, 庄雪峰, 王雨辰, 林 贺, 郭骏骐, 律广富
(1.长春中医药大学药学院中药药理学实验室,吉林 长春 130117;2.长春中医药大学 吉林省人参科学研究院中药药理组,吉林 长春130117)
类风湿性关节炎是一种以侵蚀性、对称性、多关节性和滑膜慢性炎症为主要特征的全身性自身免疫性疾病,全世界类风湿性关节炎患病率约为1.0%,我国类风湿关节炎患病率约为0.3%[1]。中医学认为类风湿性关节炎属于“痹证”范畴,此病的发生与感受风、寒、湿、热等外邪有关,中医多采用活血养阴、扶正祛邪及祛风除湿等中药治疗方法[2]。防风为伞形科植物防风的干燥根部,味辛、微甘,性温,归肝、膀胱和脾经,具有祛风解表、胜湿止痛及止痉的作用[3]。中医应用防风的历史悠久,《神农本草经》[4]将其列为上品,用于感冒头痛、风湿痹痛、风疹瘙痒和破伤风等症的治疗。中医古籍研究[5]显示:在历代医家治疗类风湿性关节炎的方剂中,防风常作为基础组方之一出现。目前栽培品中药材已成为临床应用主流,但由于各地区环境气候的差异,栽培品中药材的质量良莠不齐,甚至有些中药材出现同种不同效的现象,极大降低了中药材的临床应用效果。本研究采用防风野生品作为实验对象,避免由于栽培品的差异导致临床应用效果不均,最大程度反映中药材防风的传统功效和药理作用,为防风的临床应用和精准培育提供参考[6]。核因子κB(nuclear factor kappa-B,NF-κB)是一种与炎症因子生成、细胞增殖和细胞凋亡密切相关的转录因子[7]。研究[8]显示:NFκB 过度活化所引起的前炎性细胞因子合成和释放是类风湿性关节炎发生发展的重要因素。尽管防风在多种治疗类风湿性关节炎的方剂中均有应用,但目前关于防风单味药治疗类风湿性关节炎的研究较少,且其作用机制尚不明确。本研究探讨防风治疗类风湿性关节炎的作用及其对NF-κB 信号通路的影响,为防风在临床治疗类风湿性关节炎的应用提供依据。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器健康6~8 周龄SPF 级雄性SD 大鼠50 只,体质量(200±20)g,由长春亿斯实验动物技术有限公司提供,动物生产许可证号:SCXK-(吉)-2020-0002。大鼠饲养于长春中医药大学实验动物室,饲养期间大鼠自由饮水和进食,实验过程经长春中医药大学实验动物伦理委员会审查,符合实验动物福利与伦理规范,伦理编号:2021247。牛Ⅱ型胶原和弗氏完全佐剂(德国Sigma 公司,批号:C7806 和BJ-012-0392),防风野生品(由白山职业技术学院提供,经过长春中医药大学中药资源教研室鉴定,批号:20200901),地塞米松(广东华南药业集团有限公司),戊巴比妥钠(广州化学试剂厂),白细胞介素1β (interleukin-1β,IL-1β)、白 细 胞 介 素 6(interleukin-6,IL-6)和肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)(江苏酶免实业有限公司,货号:MM-0047R1、MM-0190R1 和MM-0180R1),NF-κB p65、NF-κB 抑制因子α (NF-κB inhibitor protein-α,IκB-α)、IκB-α 激酶β(IκB-α kinase-β,IKK-β)及环氧合酶2(cyclooxygenase-2,COX-2)一抗和二抗(武汉三鹰生物技术有限公司,货号:10745-1-AP、10268-1-AP、15649-1-AP、26593-1-AP 和SA00001-2),TNF-α 抗体(沈阳万类生物科技有限公司,货号:WL01581),RIPA 裂解液和BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,货号:P0013B 和P0010),蛋白酶抑制剂混合液(上海雅酶生物医药科技有限公司,货号:GRF101),苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(武汉塞维尔生物科技有限公司,货号:G2008)。冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:TGL-16),Invitrogen iBright成像系统(美国Thermo公司,型号:CL750),PowerPacTM基础电泳仪(美国Bio-Rad 公司,型号:1645050)。
1.2 防风水煎液制备防风野生品阴干,切制后得饮片500 g,后于陶瓷煎药锅中用水浸泡30 min,浸泡过后煎煮30 min,最后浓缩至1 g·mL-1。
1.3 实验动物分组、造模和给药50 只大鼠随机分为对照组、模型组、地塞米松组、低剂量防风组和高剂量防风组,每组10 只。除对照组外,其余各组大鼠制备类风湿性关节炎模型。称取5 mgⅡ型胶原,采用0.1 mol·L-1冰醋酸于冰水浴中,定容于25 mL 容量瓶中,4 ℃静置过夜,随后将制好的溶液与25 mL 弗氏完全佐剂于冰水浴中混匀乳化制成0.1 g·L-1胶原乳剂,在大鼠尾根部和左后足跖处两点皮内注射0.1 mL 胶原乳剂,共0.2 mL,10 d 后进行二次免疫,大鼠左足明显红肿和体积增大表明造模成功。对照组大鼠注射等量注射用水,其余操作与实验组大鼠一致[9]。
造模结束后低剂量防风组大鼠以0.45 g·kg-1剂量灌胃给药,高剂量防风组大鼠以0.90 g·kg-1剂量灌胃给药,地塞米松组大鼠灌胃2 mg·kg-1地塞米松混悬液,对照组和模型组大鼠灌胃等体积生理盐水,共计给药14 d。
1.4 各组大鼠关节炎指数(arthritis index,AI)评分检测治疗前后采用关节炎评分标准评价各组大鼠的左后足AI。评分标准:足关节无明显红肿计0 分;趾关节出现红肿计1 分;趾关节和足趾肿胀计2 分;踝关节以下足爪肿胀计3 分;全部足爪肿胀计4 分。
1.5 各组大鼠足肿胀程度检测于造模结束后和末次给药后,采用手术线环绕各组大鼠左下足跖部位,以手术线环绕1 周的长度作为大鼠足跖围,直尺测量各组大鼠足跖围变化,以各组大鼠的足跖围判定足肿胀程度。
1.6 各组大鼠脏器指数计算处死各组大鼠,取脾脏和胸腺,采用生理盐水冲洗后沥干水分,记录各组大鼠脾脏和胸腺质量,计算脏器指数。脏器指数=器官质量/大鼠体质量,单位为mg·100 g-1。
1.7 酶 联 免 疫 吸 附 测 定(enzyme-linked immunosorbent assay,ELISA)法检测各组大鼠血清中TNF-α、IL-1β 和IL-6 水平实验结束后采用戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉后进行腹主动脉取血,3 500 r·min-1低温离心10 min,分离血清,-20 ℃保存备用。按照ELISA 试剂盒说明书操作,检测各组大鼠血清中TNF-α、IL-1β 和IL-6 水平。
1.8 HE 染色观察各组大鼠滑膜组织病理形态表现实验结束后分离大鼠踝关节,剔除周围组织,取包埋后的踝关节进行石蜡切片,随后将切片进行二甲苯脱蜡,HE 染色后光镜下观察各组大鼠踝关节滑膜组织病理形态表现。
1.9 Western blotting 法检测各组大鼠滑膜组织中NF-κB、IκB-α、IKK-β、COX-2 和TNF-α 蛋白表达水平大鼠取血后,分离左足关节滑膜组织,置入EP 管中,液氮中保存。将40 mg 大鼠滑膜组织匀浆,并在RIPA 裂解缓冲液中裂解。12 000 r·min-1、4 ℃ 离心10 min,收集上清,采用BCA 蛋白检测试剂盒测定蛋白浓度,-80 ℃保存备用。制备SDS PAGE 凝胶,电泳后转膜至PVDF 膜上,封闭,孵育一抗和二抗。采用ECL 化学发光法于成像系统中进行曝光显影,采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平= 目的蛋白条带灰度值/内参蛋白条带灰度值。
1.10 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组大鼠AI 评分,足肿胀程度,脏器指数,血清中TNF-α、IL-1β 和IL-6 水平及滑膜组织中NF-κB、IκB-α、IKK-β、COX-2 和TNF-α蛋白表达水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠AI评分 与对照组比较,模型组大鼠AI 评分明显升高(P<0.01)。与模型组比较,地塞米松组、低剂量防风组和高剂量防风组大鼠AI 评分明显降低(P<0.01)。见表1。
表1 各组大鼠AI 评分Tab.1 AI scores of rats in various groups (n=10,¯±s)

表1 各组大鼠AI 评分Tab.1 AI scores of rats in various groups (n=10,¯±s)
*P<0.01 vs control group;△P<0.01 vs model group.
Group Control Model Dexamethasone Low dose of Saposhnikoviae Radix High dose of Saposhnikoviae Radix AI score 0.00±0.00 2.40±0.49*1.00±0.00△1.00±0.00△1.40±0.49△
2.2 各组大鼠足肿胀程度与对照组比较,模型组大鼠足肿胀程度明显加重(P<0.01)。与模型组比较,地塞米松组、低剂量防风组和高剂量防风组大鼠足肿胀程度明显减轻(P<0.05 或P<0.01)。见表2。
表2 各组大鼠足肿胀程度Tab.2 Swelling degrees of feet of rats in various groups(n=10,¯±s,l/cm)
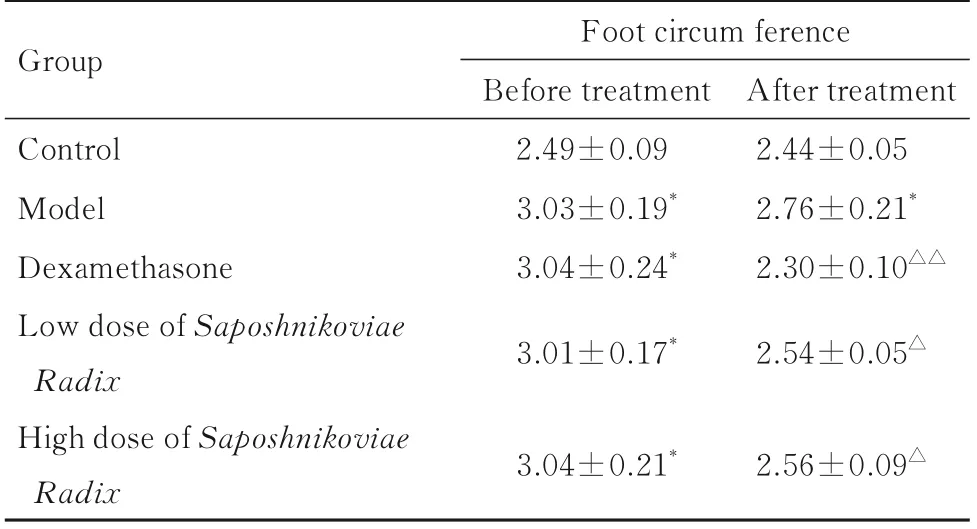
表2 各组大鼠足肿胀程度Tab.2 Swelling degrees of feet of rats in various groups(n=10,¯±s,l/cm)
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs model group.
Group Control Model Dexamethasone Low dose of Saposhnikoviae Radix High dose of Saposhnikoviae Foot circum ference Before treatment 2.49±0.09 3.03±0.19*3.04±0.24*3.01±0.17*After treatment 2.44±0.05 2.76±0.21*2.30±0.10△△2.54±0.05△Radix 3.04±0.21*2.56±0.09△
2.3 各组大鼠脏器指数与对照组比较,模型组大鼠胸腺指数明显升高(P<0.01)。与模型组比较,地塞米松组、低剂量防风组和高剂量防风组大鼠胸腺指数明显降低(P<0.01)。各组大鼠脾脏指数比较差异均无统计学意义(P>0.05)。见表3。
表3 各组大鼠脏器指数Tab.3 Organ indexes of rats in various groups (n=10,¯±s,mg·100 g-1)
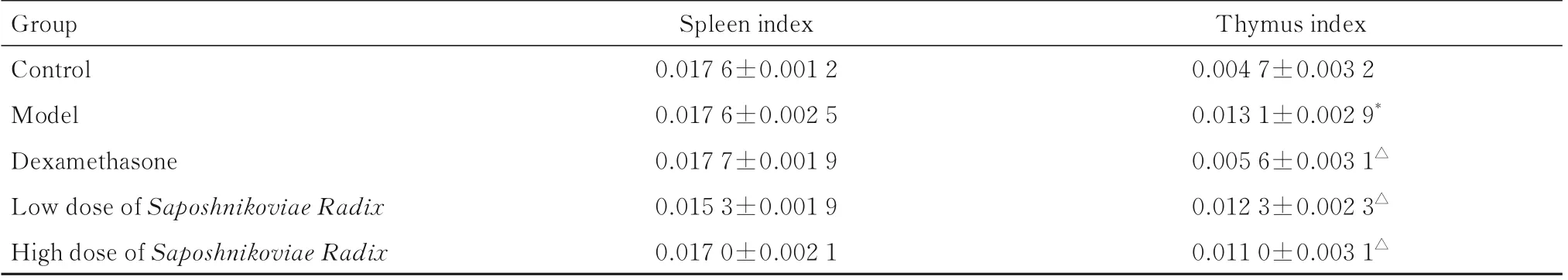
表3 各组大鼠脏器指数Tab.3 Organ indexes of rats in various groups (n=10,¯±s,mg·100 g-1)
*P<0.01 vs control group;△P<0.01 vs model group.
Group Control Model Dexamethasone Low dose of Saposhnikoviae Radix High dose of Saposhnikoviae Radix Thymus index 0.004 7±0.003 2 0.013 1±0.002 9*0.005 6±0.003 1△0.012 3±0.002 3△0.011 0±0.003 1△Spleen index 0.017 6±0.001 2 0.017 6±0.002 5 0.017 7±0.001 9 0.015 3±0.001 9 0.017 0±0.002 1
2.4 各组大鼠血清中TNF-α、IL-1β 和IL-6 水平与对照组比较,模型组大鼠血清中TNF-α、IL-1β和IL-6 水平明显升高(P<0.01)。与模型组比较,地塞米松组、低剂量防风组和高剂量防风组大鼠血清中TNF-α、IL-1β 和IL-6 水平明显降低(P<0.01)。见表4。
表4 各组大鼠血清中TNF-α、IL-1β 和IL-6 水平Tab.4 Levels of TNF-α, IL-1β, and IL-6 in serum of rats in various groups [n=10,¯±s,ρB/(ng·L-1)]

表4 各组大鼠血清中TNF-α、IL-1β 和IL-6 水平Tab.4 Levels of TNF-α, IL-1β, and IL-6 in serum of rats in various groups [n=10,¯±s,ρB/(ng·L-1)]
*P<0.01 vs control group;△P<0.01 vs model group.
Group Control Model Dexamethasone Low dose of Saposhnikoviae Radix High dose of Saposhnikoviae Radix IL-6 23.85±1.68 70.93±8.31*38.10±2.76△59.34±6.53△46.88±5.08△TNF-α 30.46±2.48 85.67±9.25*45.58±5.63△65.72±7.52△60.45±6.83△IL-1β 48.36±3.67 105.62±15.71*60.92±5.78△77.23±8.03△69.55±7.36△
2.5 各组大鼠滑膜组织病理形态表现对照组大鼠滑膜组织未见异常;模型组大鼠踝关节滑膜组织增生并伴有大量炎症细胞浸润;地塞米松组、低剂量防风组和高剂量防风组大鼠踝关节滑膜组织增生程度减轻且炎症细胞数减少。见图1。
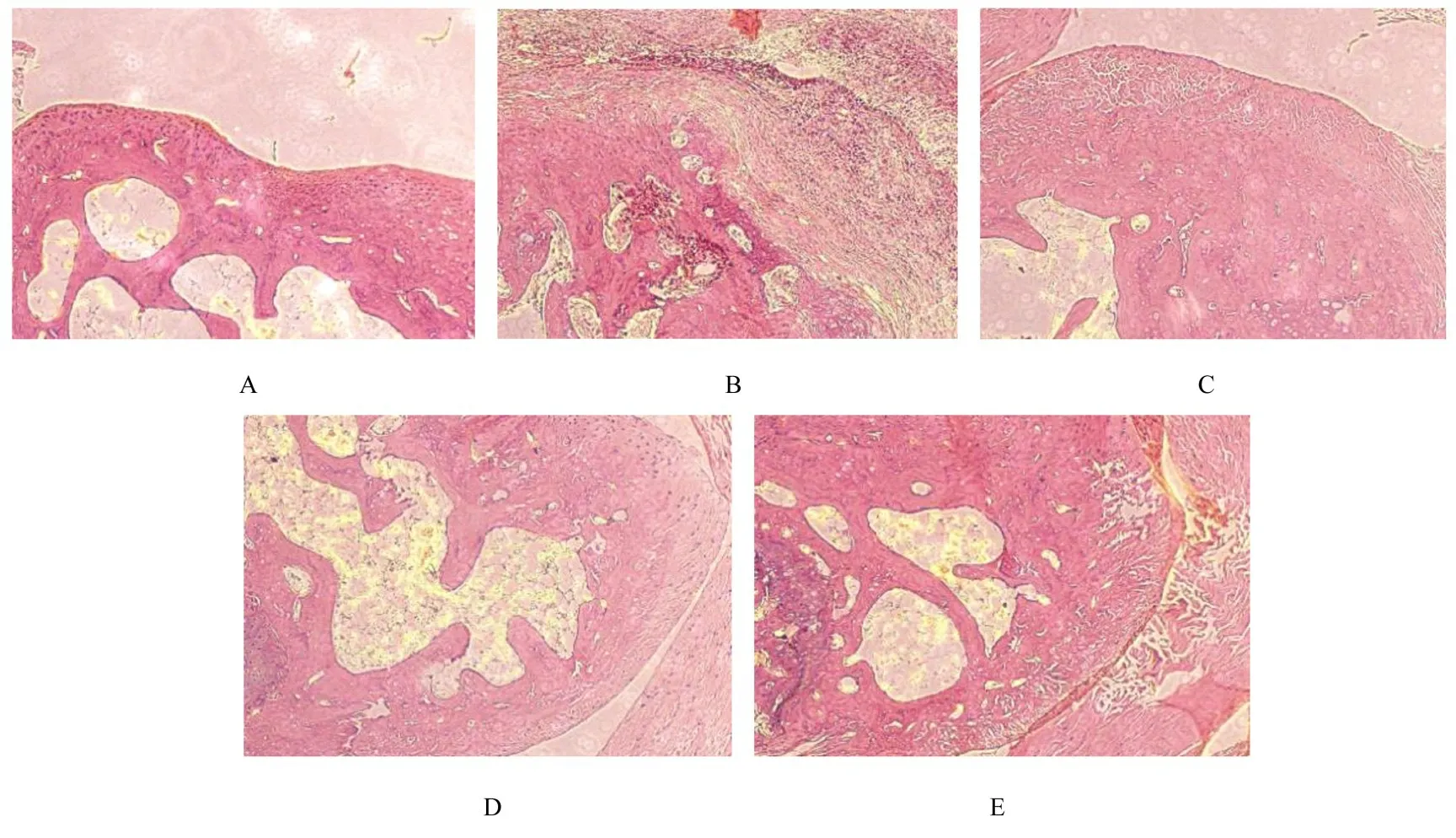
图1 各组大鼠踝关节滑膜组织形态表现(HE,×200)Fig.1 Morphology of synovial tissue of ankle joint of rats in various groups(HE,×200)
2.6 各组大鼠滑膜组织中NF-κB、IκB-α、IKK-β、COX-2 和TNF-α 蛋白表达水平与对照组比较,模型组大鼠滑膜组织中NF-κB、IKK-β 、COX-2 和TNF-α 蛋白表达水平明显升高(P<0.01),IκB-α蛋白表达水平明显降低(P<0.01)。与模型组比较,地塞米松组、低剂量防风组和高剂量防风组大鼠滑膜组织中NF-κB、IKK-β、COX-2 和TNF-α 蛋白表达水平明显降低(P<0.01),IκB-α 蛋白表达水平明显升高(P<0.01)。见图2 和3。
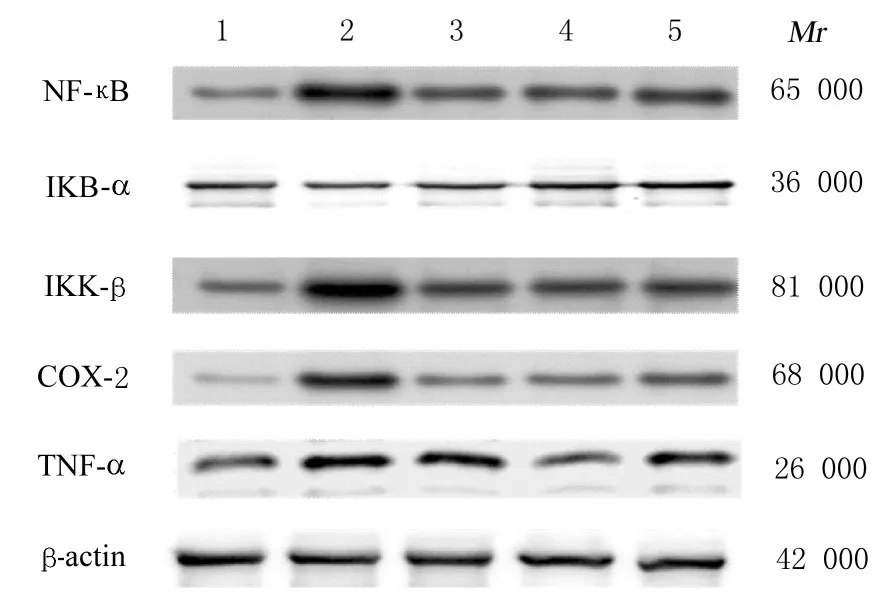
图2 各组大鼠滑膜组织中NF-κB、IκB-α、IKK-β、COX-2 和TNF-α 蛋白表达电泳图Fig.2 Electrophoregram of expressions of NF-κB,IκB-α,IKK-β,COX-2, and TNF-α proteins in synovial tissue of rats in various groups
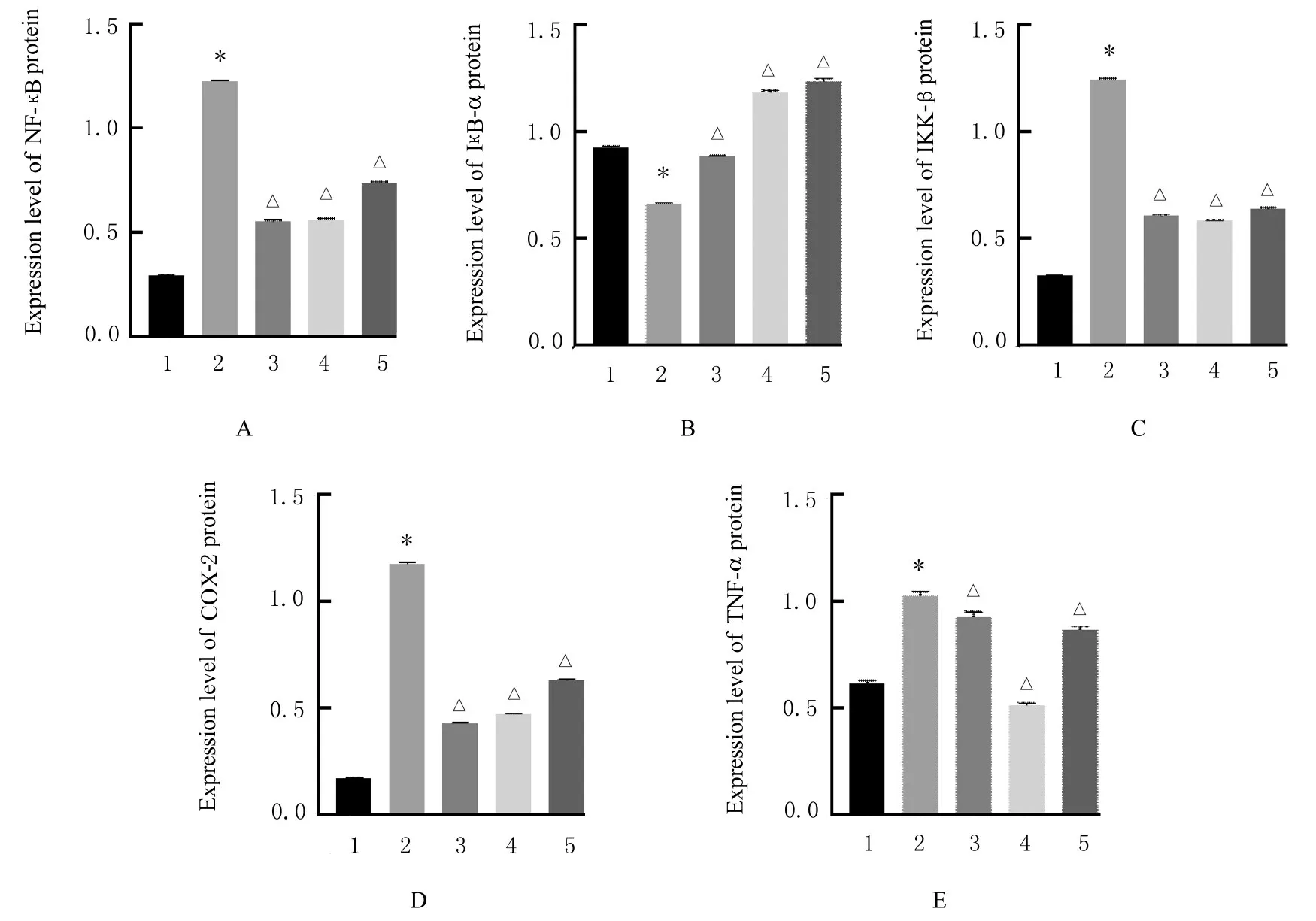
图3 各组大鼠滑膜组织NF-κB(A)、IκB-α(B)、IKK-β(C)、COX-2(D)和TNF-α(E)蛋白表达水平Fig.3 Expression levels of NF-κB(A), IκB-α(B), IKK-β(C), COX-2(D), and TNF-α(E) proteins in synovial tissue of rats in various groups
3 讨 论
类风湿性关节炎病理学表现为滑膜组织增生、炎症细胞浸润、血管翳形成、关节软骨损伤和骨侵蚀[10-12]。因此,减轻滑膜炎症反应和抑制滑膜异常增生是治疗类风湿性关节炎的有效方法[13]。类风湿性关节炎大鼠模型是一种可靠且与人类病理状态相似的动物模型[14]。本研究结果显示:与对照组比较,模型组大鼠踝关节均出现明显肿胀,AI 评分明显升高,滑膜组织增生并伴有大量炎症细胞浸润,表明类风湿性关节炎模型制备成功,而地塞米松组和不同剂量防风组能够明显减轻大鼠关节肿胀程度,降低AI 评分,抑制滑膜组织增生,降低炎症细胞数量,表明防风能够有效缓解大鼠类风湿性关节炎症状。脾脏和胸腺作为机体两大免疫器官在免疫应答中发挥重要作用[15-16]。本研究结果显示:模型组大鼠胸腺指数升高,经防风给药后大鼠胸腺指数降低,表明防风能够缓解由类风湿性关节炎引起的免疫器官肿大,因此认为防风野生品能够通过抑制机体过度免疫应答对类风湿性关节炎起到治疗作用。TNF-α、IL-1β 和IL-6 被认为是类风湿关节炎中重要的促炎细胞因子,参与关节组织炎症形成和关节破坏[17-18]。研究[19-21]显示:类风湿性关节炎患者血清中TNF-α、IL-6 和IL-1β 高于正常水平,且类风湿性关节炎严重程度与TNF-α、IL-6和IL-1β 水平呈正相关关系。本研究结果显示:防风野生品能够降低类风湿性关节炎大鼠血清中TNF-α、IL-6 和IL-1β 水平,减轻体内炎症反应,表明防风野生品对类风湿性关节炎具有治疗作用,该作用与防风野生品抑制机体异常免疫应答及降低炎性因子水平有关。
NF-κB 在多种自身免疫性疾病中被活化,其中包括类风湿性关节炎[22-23]。NF-κB 被激活后能够通过调控细胞因子、黏附分子和趋化因子等途径参与机体炎症反应,激活后的NF-κB 释放入核还能够继续诱导下游COX2、TNF-α、IL-6 和IL-1β 等促炎细胞因子的产生,进一步加剧炎症反应[24-28]。本研究结果显示:与对照组比较,模型组大鼠滑膜组织中NF-κB 和IKK-β 蛋白表达水平升高,IκB-α 蛋白表达水平降低,表明在大鼠滑膜组织中NF-κB信号通路被激活,而不同剂量防风组大鼠滑膜组织中NF-κB 和IKK-β 蛋白表达水平较模型组明显降低,IκB-α 蛋白表达水平较模型组明显升高,表明大鼠滑膜组织NF-κB 信号通路的激活得到有效抑制。
综上所述,防风野生品对类风湿性关节炎有较好的治疗效果,其通过降低血清中促炎细胞因子TNF-α、IL-6 和IL-1β 水平,抑制滑膜组织中NFκB 信号通路的过度激活,从而发挥治疗作用。

