四种植物的根系在黏质红壤的分布特征及对土壤大孔隙的影响
吴章丽

摘 要 为探究植物根系在黏质红壤中的分布特征及对土壤大孔隙的影响,选取普通甘蓝型油菜(华双4号,简称RapeC)、深根油菜(西南28,简称RapeD)、紫花苜蓿(拉迪诺,简称Luc1Y)和香根草(野生型,1年生和多年生简称Vet1Y和Vet5Y)4种植物作为研究对象,种植一年和多年后,通过剖面墙法和常规取根法分析不同植物的根系下扎深度、总根系密度、根径级配内的根长分布、根系数目密度及土壤大孔隙分布。结果表明,在1年生植物中,不同植物之间的根系下扎深度有显著性差异;不同植物的根长密度随土壤深度的增加逐渐降低,最大根长密度普遍集中在20~30 cm和
40~60 cm土壤深度;根径级配中,油菜(RapeD和RapeC)的根系密度有90%集中在细根和中根根段内,而Luc1Y、Vet5Y和Vet1Y在中根和粗根根段内较多,占比分别为8%和11%;植物根系能够改善土壤的大孔隙结构,与休耕无植物地块(LandF)相比,植物根系都显著增加土壤的总孔隙度,尤其是深层土壤(40 cm以下),总孔隙度依次为Vet5Y>Luc1Y>Vet1Y>RapeD>LandF。从通气孔隙度和毛管孔隙度来看,不同植物種植后的通气孔隙和毛管孔隙之间有显著性差异(P<0.05),其中Vet5Y和Luc1Y在通气性的改善上显著高于其他植物,而Vet1Y对土壤毛管孔隙的影响较大。
关键词 深根植物;根系密度;根径级配;土壤大孔隙结构
中图分类号:S151.92 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.08.076
分布在我国南方的亚热带红壤区水热资源丰富,是种植粮食作物、经济作物及林果草的重要地区。受海洋性季风气候影响,该地区总体雨量充沛,但降雨时空分布不均,在作物需水少时表层含水量较高,导致根系无下扎动力。此外,红壤黏粒含量高,具有大孔隙少、通气性差及持水能力弱等特点,在少雨强热叠合的夏秋季易发生季节性干旱。在土壤-植物-大气连续体(Soil-Plant-Atmosphere Continuum,SPAC)中,土壤在干旱中占主体,是供水和储水的关键,根是土壤结构和孔隙形成的关键驱动因素,根系分布较浅会导致植物无法利用深层水分[1]。通过植物根系改善土壤性质已成为提高植物抗旱能力、防御土壤干旱的可持续有效途径,改善土壤物理性质为后季作物防御季节性干旱具有重要意义。
植物根系在获取水分和养分方面具有重要作用,在干旱期,深根植物根系能够下扎到深层土壤吸收利用底层水分。植物根系分为直根系和须根系,直根系植物根径较为中等、分布均匀,而须根系植物根径直径范围大。不同植物根系穿透紧实土壤的能力不同。有研究表明,在紧实的土壤中,直径大的根比直径小的根更容易穿透土层[2]。有相关文献报道,香根草、紫花苜蓿等植物根系下扎较深,根系数量和密度都随土层深度的加深而逐渐降低,且紫花苜蓿生长1年的根深在1.14 m以下[3-4]。孙洪仁等研究表明,紫花苜蓿根系主要分布在0~30 cm土层,在离地面10~20 cm的主根处,侧根发生的数量占总侧根数的40%以上,而在干旱地区,表土层为疏松的耕作层,不利于侧根发生。同时,30~50 cm土层深度为紫花苜蓿侧根发生的集中段,在80 cm以下几乎没有侧根发生[4]。尽管目前对植物根系分布研究的较多,但将不同植物类型的根系放在一起集中比较及从“根-土”关系方面着手,探究不同植物根系分布对土壤大孔隙分布影响的研究较少。
在深层土壤中,根径较粗的主植物根系对土壤孔隙具有更好的改善效果,但也有研究发现,具有高密度和细根优势的须根系植物在改善土壤孔隙时具有更大优势,细根植物虽然有较低的大孔体积,但细微孔体积较大,细根能更好利用现有孔隙空间穿透土壤[5-6]。上述结果仅限于室内试验,还需进一步田间试验验证。因此,本研究结合植物种类及根系特点选取红壤区典型的香根草、苜蓿、深根油菜和普通油菜为研究对象,在具有旱、瘠、酸等特点的红壤区种植深根植物,对种植物的根系分布及种植后土壤孔隙的改变进行探究,为深入分析植物根系通过改善土壤孔隙结构进而提高对后季作物抗旱能力的影响提供理论依据。
1 材料与方法
1.1 研究区概况
试验地位于湖北省咸宁市长江中游教育部野外科学观测站,该站位于东经114°21′35″,北纬30°01′45″,海拔44.3 m,属亚热带季风气候区,年平均气温16.5 ℃,年平均降水量1 474 mm。该地区降水集中在春季和夏初,晴热少雨的夏秋季(7―10月)极易发生季节性干旱。供试土壤主要为第四纪红色黏土母质发育的红壤,土壤质地主要为黏土(美国制),种植前试验土壤的理化性质见表1。
1.2 试验设计
本试验主要在野外田间小区内进行,时间为2018年7月至2019年8月。试验共设置6个处理:休耕无植物地块、普通甘蓝型油菜(华双4号)、深根油菜西南28)、紫花苜蓿(拉迪诺)、一年生香根草(野生型)和多年生香根草(前期已种植5年),其分别简写为LandF、RapeC、RapeD、Luc1Y、Vet1Y和Vet5Y。
试验共设置30个小区,每个小区面积6 m2,各
4次重复,株行距为30 cm×20 cm。试验材料均采用先种植后移栽方法。Luc1Y采用先撒播后间苗的方式,种植密度为30 kg·hm-2;油菜等材料于2018年7—9月种植,9月至10月下旬移栽,2019年5月开始收获并开展试验。所有小区施用氮肥为尿素[ω(N)=46.4%],磷肥为过磷酸钙[ω(P2O5)=12%],钾肥为氯化钾[ω(K2O)=60%]。氮肥、磷肥、钾肥均以基肥一次施入,用量分别为100 kg·hm-2、100 kg·hm-2、50 kg·hm-2。播种前,翻耕土壤30~50 cm,使整个地块平坦,土样混合均匀。
1.3 检测方法
1.3.1 土壤理化性质测定
土壤有机质含量用重铬酸钾-外加热法测定,碱解氮、速效磷和速效钾测定方法分别为碱解扩散法、NH4OAc浸提-火焰光度法和0.03 mol·L-1 NH4F-0.025 mol·L-1 HCl法,土壤质地和土壤pH测定分别用吸管法和pH计,土壤容重和毛管孔隙度采用环刀法测定。
1.3.2 植物根系分布与土壤孔隙测定
植物根系分布测定采用常规取土洗根法和剖面墙法。在植物收割后,用定制的200 cm3大环刀在地块不同土层(0~10、10~20、20~30、30~40、40~60、60~80 cm和80~100 cm)采集包含根系的土壤样品,每层3次重复,根系采样点设在植株间和植株上。土壤样品采集后放入尼龙网中,用自来水冲洗过筛,漂洗根系时去除死根和杂根,将筛选出的根系装在自封袋中放于室内-18 ℃冰箱保存。在室内用Epson perfection V800 photo根系扫描仪对根系进行扫描,用WinRHIzo Pro2009c根系分析系统进行分析,计算得到根长百分比、根长密度及根径分布。
逐层测量后在地块间形成一个土坑,继续采用剖面墙法测量根系空间分布,开挖修整完,使之在地块上形成一个垂直剖面观测坑(50 cm×100 cm),用自来水湿润,剥离0.5 cm厚的土壤使根系露出,然后用矩形钢丝方框(50 cm×20 cm,分成5 cm×5 cm小格)分层紧贴观测面,对小格内可见的根系进行计数,计算出垂直剖面上的根系数目密度分布。其中根质量密度(Root Mass Density,RMD)根长密度(Root Length Density,RLD)和根系數目密度(Root Number Density,RND)计算公式如下:
(1)
(2)
(3)
式中:ρRM为根质量密度,mg·cm-3;m为根质量,
mg;v为土体体积,cm3;ρRL为根长密度,cm·cm-3;L为根长,cm;ρRN为根系数目密度,根·cm-2;N为根系数目,根;A为剖面面积,cm2。
大孔隙和孔隙密度分布用环刀法和肉眼计数法测定。开挖土壤时,在各个深度(0、10、20、30、40、60 cm和80 cm)挖出一个50 cm×50 cm的平面,
扫除土面上细小土粒和土块,将透明塑料薄膜
(32.2 cm×23.2 cm)覆盖于土面,用记号笔在塑料膜上圈出肉眼可见大孔隙,并标注出土面大小,然后拍照留存进行室内数目核对,从而计算出各个土层土壤孔隙密度分布(根·m-2),肉眼计数完成后称重。根据各土层中测定的容重及孔隙度作图,其中总孔隙度、毛管孔隙在各深度用普通环刀取样,将样品带回实验室后,用滤纸和纱布包扎好刀口那端的土样垂直向下放入已饱和的沙盘中浸泡,盖好盖子。待充分吸水至恒重后去纱布和滤纸,用天平称重后将样品放置在烘箱内,在100~105 ℃下烘24~48 h至恒重,取出冷却一段时间,总孔隙度、毛管孔隙度、通气孔隙度计算公式如下:
(4)
(5)
P3=P2-P1(6)
式中:P1为总孔隙度,%;D为土壤容重,g·cm-3;d为土壤密度,g·cm-3;P2为毛管孔隙度,%;vw为毛管水体积,cm3;vs为土体体积,cm3;P3为通气孔隙度。
1.4 数据处理与分析
数据使用Excel 2016进行处理,统计分析在SPSS 20.0中进行,采用方差一般线性单变量模型和Duncan法比较不同植物根系、不同根系直径间的根长密度和土壤性质差异性,显著水平设定为α=0.05。相关图表制作在Excel 2016和Origin 8.0中完成。
2 结果与分析
2.1 根系下扎深度
根系下扎深度也称根系延伸深度,可以直接反映植物根系在整个剖面上的分布情况,根系长度累计百分比≥95%的根系深度称为95%根系深度。由表2可知,不同植物根系的下扎深度具有显著性差异,试验组的根系下扎深度均显著高于对照组(普通油菜),Vet5Y、Vet1Y、Luc1Y、RapeD、RapeC的根系下扎深度分别为100 cm、100 cm、80 cm、60 cm、40 cm。此外,在黏重紧实的红壤中,3种深根植物(深根油菜、苜蓿、香根草)的95%根系深度均显著高于RapeC,且Vet5Y、Vet1Y、Luc1Y、RapeD分别是RapeC的2倍、1.5倍、1.5倍、1.5倍。
2.2 总根系密度
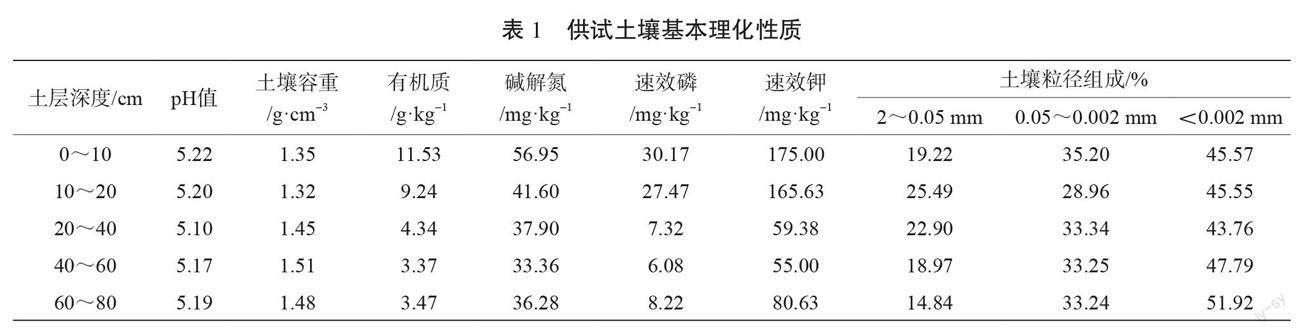
4种植物的根长密度随土壤深度的增加呈先减小后增大再减小的趋势,但发生转折的深度有差异,如图1(a)所示。植物总根长密度的突增点集中于20~30 cm和40~60 cm土壤深度,油菜(RapeC
和RapeD)集中在20~30 cm土壤深度,Luc1Y和Vet5Y集中在40~60 cm土壤深度,而Vet1Y略微有些不同,集中在30~40 cm土壤深度,说明生长年限和植物种类对植物的根长密度有显著影响。相比根长密度在剖面深度的复杂变化,植物根质量密度随土层深度的增加单调下降,不同植物根质量密度差异显著,尤其在浅土层(0~40 cm),根质量密度为苜蓿(LuclY)>香根草(Vet1Y和Vet5Y)>油菜(RapeC和RapeD),但同种植物(RapeC和RapeD、Vet1Y和Vet5Y)根质量密度之间无显著性差异,如图1(b)所示。
2.3 根径级配内的根长分布
不同植物的根长密度有显著性差异,且不同植物种类、不同土层深度中各根径(Root Diameter,RD)级配内的根长占总根长的百分比也有显著性差异。本文将根径级配划分为精细根(RD≤0.2 mm)、细根(0.2 mm<RD≤0.5 mm)、中根(0.5 mm<RD≤
1.0 mm)和粗根(RD>1.0 mm)。从整个土壤剖面来看,油菜细根、中根较多,两者根长占比高达90%,其粗根较少,占比低于3%,如图2(a)和图2(b)所示。Luc1Y粗根较多,占总根长的8%,显著高于油菜,如图2(c)所示。相比主根系植物,须根系香根草的中根和粗根较多,分别占总根长的37%和11%,如图2(d)所示。就种植时间来说,Vet5Y的精细根(14%)和粗根(19%)占比显著高于Vet1Y的精细根(8%)和粗根(11%),如图2(d)和图2(e)所示。不同植物在根径级配内的根长密度之间有显著性差异,尤其在深层(40 cm以下土层)土壤中。
2.4 根系数目密度(RND)
整个剖面上,随土层深度的增大,植物根系数目密度呈降低趋势。由图3可知,不同植物RND差异显著,深层土壤中,香根草根系数量密度为最大,根系分布较多,其次是Luc1Y和油菜,两种方法测量结果一致。
2.5 土壤大孔隙分布
由图4可得,有根系控制(有植物)地块的总孔隙体积和毛管孔隙体积显著高于休耕地块。浅层土壤中(0~40 cm),除Vet5Y外,对土壤总孔隙大小影响依次为Luc1Y>Vet1Y>RapeD>RapeC>LandF;深层土壤中(40 cm以下),Vet5Y和Luc1Y总孔隙度显著高于Vet1Y、RapeD和LandF。就通气孔隙而言,在40~60 cm土壤深度中,Vet5Y和Luc1Y通气孔隙分别为3.31%、2.74%,显著高于Vet1Y、RapeD和RapeC。浅层土壤中(20~30 cm),根系对土壤毛管孔隙体积影响大小依次为Vet1Y>Luc1Y>RapeD>RapeC>LandF>Vet5Y;深层土壤中,Vet5Y、Luc1Y和Vet1Y之间并无显著性差异,但都显著高于休耕地块。
3 讨论
3.1 植物根系在黏质红壤中的生根与下扎能力
黄德华等研究表明,多数植物根系下扎深度在10~50 cm,而深根植物根系分布深度在50~100 cm[7]。
在此次田间试验中,RapeD、Luc1Y和香根草的根系分布深度均在此范围内。相关文献表明,用苜蓿、菊苣、加拿大油菜和高羊茅等植物具有较强的生根能力,不仅可以改善不适宜的表土条件,并开发较深底土层中的营养物质和水分,也可为后续作物创造根部通道,其中双子叶植物(主根系)比单子叶植物(须根系)具有更大的生长潜力,更能穿透紧实的土壤[8-10]。同一物种的不同品种穿透能力也不相同。在本次的研究中,Vet5Y的根系下扎深度显著高于Luc1Y和RapeD,而1年生植物对比可知,香根草、RapeD和Luc1Y的根系下扎深度并无显著性差异,由此可以得出植物根系下扎深度与种植年限有关,1年生植物差异不显著可能是种植年限较短所致。就根长密度而言,Vet5Y在整个剖面上的根系密度显著较低可能是种植多年,根系已经老化,取样时发现老根和死根较多,而Luc1Y在40~60 cm的总根长密度出现增加趋势是因为在50 cm处根系侧根分支较多,张建波和郭正刚等研究结果也证明了这一点[11-12]。根据植物根系多样性分析可知,根系主要分两种类型,即具有较高密度须根系植物和具有较低密度主根系植物,主根系植物根径较粗,根径分布均匀,须根系植物根径大小不一,直径范围广[13]。因此,在研究根系对土壤孔隙结构影响时,需结合根径及根径级配内的根长密度进行分析。
3.2 植物根系对土壤孔隙结构的影响
根是改变土壤结构和水文状况的关键因素[14]。研究发现,没有种植植物的土壤和种植植物的土壤之间孔隙演化存在一定的差异,从根系特征上看,较大的根长密度对土壤孔隙度的影响更大,在一定程度上,植物根系可以在机械层松动后增加土壤孔隙体积[15-16]。
本研究结果表明,深层土壤中Vet5Y的根长密度为最大,其次是Luc1Y和Vet1Y,而与此对应的土壤总孔隙度可得,Vet5Y对土壤的总孔隙度影响较大,其次是Luc1Y和Vet1Y,浅层土壤(0~40 cm)中Vet5Y的孔隙体积较低可能是由于种植多年未进行耕作,而其他植物种植后的土壤总孔隙偏高很有可能是前期种植时的耕作所致。从根径分级来看,深层土壤中Vet5Y在粗根(RD>1.0 mm)根段内的根长密度显著高于Luc1Y和Vet1Y,且Vet1Y和Luc1Y的根長密度并无显著性差异,但在深层土壤中对通气孔隙体积的影响是Vet5Y和Luc1Y显著高于Vet1Y。因此,在穿透阻力较大的黏质红壤时,种植根系较粗的深根植物有助于发挥植物抗旱能力[17]。但有学者提出粗根虽能移动土壤颗粒,但粗根在穿透阻力较大的土壤时根部弯曲的趋势较低,较细的侧根更能够进入较小的孔[18]。因此要想从根-土关系上探究植物根系的改土效果,后续还需结合后季植物的根系特征及生长情况进行分析。
4 结论
根系与土壤相互影响,本文以4种植物作为研究对象,分析了植物根系的形态变化及根系分布对土壤孔隙影响的差异性,进而得出深根植物能够在黏质红壤中下扎到深层,且植物根系密度及根径分布对土壤大孔隙有较大影响。在作物休闲期种植深根植物能够增加土壤大孔隙数量,改善土壤通气状况。因此,在季节性干旱地区,选育具有深根系统的粗根植物进行种植将会对后季作物抗旱及产量提高带来很大的益处。
参考文献:
[1] 王峰.亚热带红壤—作物系统对季节性干旱的响应与调控[D].武汉:华中农业大学,2017.
[2] PAG?S L. Branching patterns of root systems: comparison of monocotyledonous and dicotyledonous species[J].Annals of Botany,2016,118(7):1337-1346.
[3] 肖宏彬,赵亮,李珍玉.香根草根系的分布形态及抗拉强度试验研究[J].中南林业科技大学学报,2014,34(3):6-10.
[4] 孙洪仁,武瑞鑫,李品红,等.紫花苜蓿根系入土深度[J].草地学报,2008(3):307-312.
[5] ZOBEL R W. Hardware and software efficacy in assessment of fine root diameter distributions[J].Computers and Electronics in Agriculture,2008,
60(2):178-189.
[6] 陈正法,张茜茜.我国南方红壤区季节性干旱及对林果业的影响[J].农业环境科学学报,2002,21(3):241-244.
[7] 黄德华,陈佐忠.内蒙古锡林郭勒沙地草场49种植物根系分布深度的初步观察[J].中国草地学报,1986(2):33-34.
[8] HAN E, KAUTZ T, PERKONS U, et al. Quantification of soil biopore density after perennial fodder cropping[J]. Plant and Soil,2015,394(1/2):
73-85.
[9] PERKONS U, KAUTZ T, UTEAU D, et al. Root-length densities of various annual crops following crops with contrasting root systems[J]. Soil and Tillage Research,2014,137:50-57.
[10] HAN E, KAUTZ T, K?PKE U. Precrop root system determines root diameter of subsequent crop[J].Biology and Fertility of Soils,2016,52(1):113-118.
[11] 张建波,白史且,张新全,等.Luc1Y根系与土壤物理性质的关系[J].安徽农业科学,2006(14):
3424-3427.
[12] 郭正刚,张自和,肖金玉,等.黄土高原丘陵沟壑区Luc1Y品种间根系发育能力的初步研究[J].应用生态学报,2002,13(8):1007-1012.
[13] JIN K, SHEN J, ASHTON R W, et al. How do roots elongate in a structured soil?[J].Journal of Experimental Botany,2013,64(15):4761-4777.
[14] BENGOUGH A G. Water dynamics of the root zone: rhizosphere biophysics and its control on soil hydrology[J].Vadose Zone Journal,2012,11(2):
460-460.
[15] SCHOLL P, LEITNER D, KAMMERER G, et al. Root induced changes of effective 1D hydraulic properties in a soil column[J].Plant and Soil, 2014,381(1/2):193-213.
[16] BODNER G, SCHOLL P, LOISKANDL W, et al. Environmental and management influences on temporal variability of near saturated soil hydraulic properties[J].Geoderma,2013,204:120-129.
[17] CHIMUNGU J G, MALIRO M F A, NALIVATA P C, et al. Utility of root cortical aerenchyma under water limited conditions in tropical maize[J]. Field Crops Research,2015,171:86-98.
[18] BENGOUGH A G, MCKENZIE B M, HALLETT P D, et al. Root elongation, water stress, and mechanical impedance: a review of limiting stresses and beneficial root tip traits[J].Journal of Experimental Botany,2011,62(1):59-68.
(責任编辑:张春雨)

