血清维生素D治疗超重肥胖妊娠期糖尿病的疗效
崔丽茹,刘田田,李文辉,胡雪英
(1.保定市儿童医院新生儿科;2.保定市第二医院产科;3.保定市妇幼保健院产科,河北 保定 071000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)特发于妊娠期,在妊娠前无糖代谢异常,而在妊娠后血糖水平异常增高,是较为常见的妇产科合并症[1-2]。GDM可导致患者内分泌失调、高血压、免疫力降低,并易引发早产、低体质量儿、胎儿畸形等一系列不良妊娠结局,严重威胁母婴健康[3]。虽然多数GDM患者产后糖代谢能够恢复正常,但仍有部分患者或胎儿存在远期不良影响,例如增加日后2型糖尿病患病风险[4]。维生素D是一种神经-内分泌-免疫调节激素,其参与胰岛β细胞的信号转导,从而增强胰岛素的分泌,缓解胰岛素抵抗,而胰岛素抵抗及胰岛β细胞功能不全是妊娠期糖尿病的基础,因此机体维生素D水平低与GDM风险增加相关[5-6]。已有研究[7]证实,孕前肥胖、超重是诱发GDM的主要因素之一,这是由于脂肪组织可分泌的多种细胞因子,参与糖脂代谢及胰岛素信号传导。肥胖人群维生素D缺乏情况更为普遍[8],而针对维生素D与超重肥胖GDM患者的相关研究较少。基于此,本研究拟对超重肥胖与非肥胖GDM患者的维生素D3、糖脂代谢及胰岛素抵抗情况进行比较,并探究口服维生素D3对维生素缺乏/不足的超重肥胖GDM患者的干预效果。
1 资料与方法
1.1 一般资料
选取2020年7月至2020年12月保定市第二医院收治的50例超重肥胖GDM患者(超重肥胖组)及50例非肥胖GDM患者(非肥胖组)为研究对象。纳入标准:(1)符合GDM诊断标准[9],超重肥胖组体质量指数(BMI)≥25.0 kg/m2,非肥胖组BMI为18.5~24.9 kg/m2;(2)孕龄≤12周;(3)年龄18~35岁;(4)单胎、头位妊娠;(5)临床资料完整。排除标准:(1)孕前糖尿病患者;(2)近3个月内服用过影响糖脂代谢、胰岛功能药物或维生素D制剂者;(3)合并恶性肿瘤、重要脏器功能不全、免疫系统、血液系统及其他内分泌疾病者;(4)合并其他妊娠并发症者;(5)吸烟、饮酒及放射性接触史者。两组患者年龄、孕周比较,差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准,患者自愿参加试验并签署知情同意书。
1.2 方法
1.2.1 实验室指标测定 抽取患者清晨空腹外周静脉血5 mL,于37 ℃条件下静置30 min,采用低温高速离心机以3 000 r/min的转速离心10 min,分离上层血清,置于抗凝管内标记后保存于-80 ℃冰箱内待测。采用美国Beckman公司生产的AU5800型全自动生化分析仪测定两组患者血清空腹血糖(FBG)、糖化血红蛋白A1c(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)以及高密度脂蛋白胆固醇(HDL-C)水平。采用电化学发光法测定血清空腹胰岛素(FINS)水平,检测试剂盒购自瑞士罗氏公司,计算稳态模型胰岛素抵抗指数(HOMA-IR),公式为:HOMA-IR=FBG×FINS/22.5。维生素D含量以血清25-羟基维生素D3[25-Hydroxyvitamin D3,25-(OH)D3]水平表示,采用酶联免疫吸附试验(ELISA)测定,参照美国2011年制定的关于《评价、治疗及预防维生素D缺乏》[10]的内分泌学会临床指南中推荐水平,维生素D3正常指25-(OH)D3≥30 nmol/L,维生素D3不足指25-(OH)D3为21~29 nmol/L,维生素D3缺乏指25-(OH)D3≤20 nmol/L。
1.2.2 干预方法 对两组中维生素不足、缺乏患者,给予口服维生素D3干预,剂量400 U/d,连续服用两周。
1.3 统计学分析
2 结果
2.1 两组患者维生素D水平比较
超重肥胖组患者血清25-(OH)D3水平、维生素D正常者占比低于非肥胖组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者维生素D水平比较
2.2 两组患者糖脂代谢指标水平比较
超重肥胖组患者血清FBG、HbA1c、FINS、HOMA-IR、TC、TG、LDL-C水平高于非肥胖组(P<0.05);血清HDL-C水平低于非肥胖组(P<0.05)。见表2。
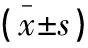
表2 超重肥胖与非肥胖GDM患者糖脂代谢指标水平比较
2.3 超重肥胖GDM患者维生素D水平与糖脂代谢、胰岛素抵抗的相关性分析
经Pearson相关性分析,超重肥胖GDM患者血清25-(OH)D3水平与FBG、HbA1c、FINS、HOMA-IR、TC、TG、LDL-C呈负相关(P<0.05);与HDL-C呈显著正相关(P<0.05)。
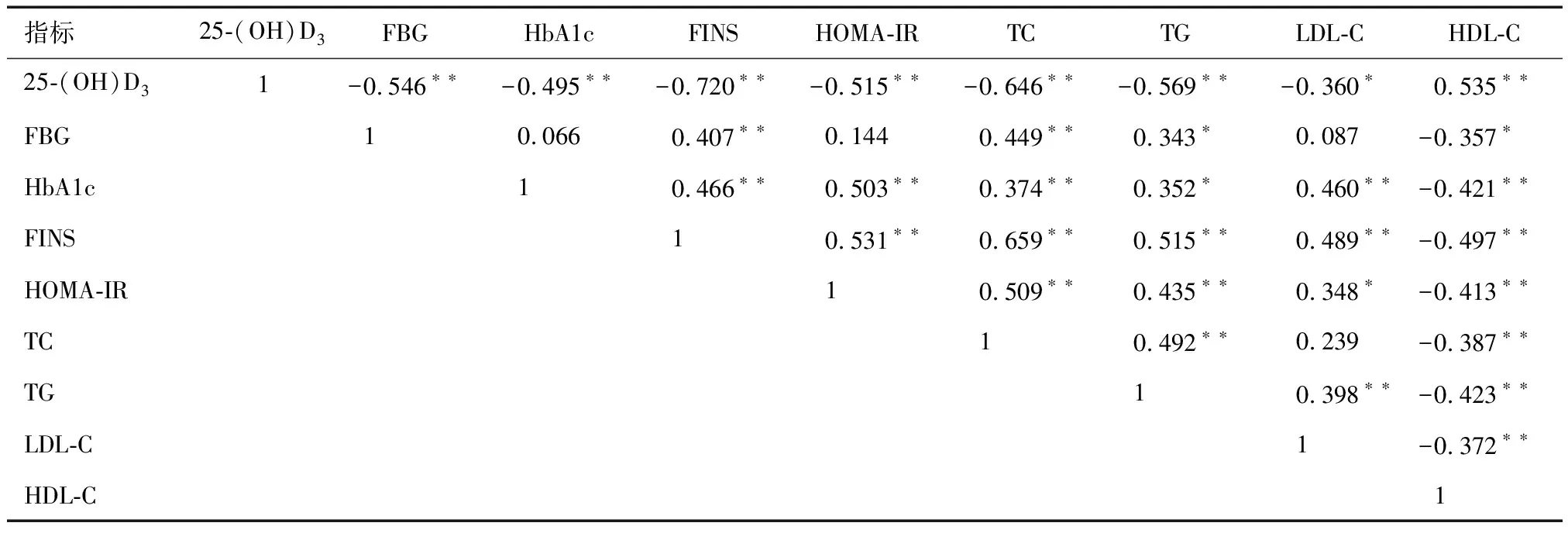
表3 超重肥胖GDM孕妇维生素D水平与糖脂代谢、胰岛素抵抗的相关性分析(r)
2.4 维生素D缺乏及不足的超重肥胖GDM患者干预前后维生素D、胰岛素抵抗水平比较
干预前,两组维生素D缺乏及不足患者血清25-(OH)D3、HOMA-IR比较,差异无统计学意义(P>0.05)。干预后,两组25-(OH)D3水平均高于干预前、HOMA-IR值均低于干预前(P<0.05),但组间差异无统计学意义(P>0.05)。见表4。

表4 维生素D缺乏及不足的GDM患者干预前后维生素D、HOMA-IR水平比较
3 讨论
GDM会影响患者的体内代谢,进而导致多种妊娠不良情况发生。因肥胖引起的胰岛素抵抗被认为是GDM的病理基础之一[11]。25-(OH)D3又被称为活性维生素D,通常由体内维生素D经阳光中紫外线照射转化生成,是衡量体内维生素营养状况的最佳指标[12-13]。肥胖、GDM同为维生素D缺乏的风险因素,Al-Shafei等[14]指出,血清25-(OH)D3水平是GDM的独立影响因素;董志萍等[15]以成人肥胖患者为研究对象,发现其25-(OH)D3水平低于正常对照人群。在本研究中,超重肥胖组GDM患者血清25-(OH)D3水平、维生素D正常者占比低于非肥胖组GDM患者(P<0.05),与上述研究结论基本一致,分析原因一方面是由于超重、肥胖的GDM患者户外活动相对较少、阳光照射量不足,因此通过表皮产生的维生素D量降低;另一方面可能由于超重、肥胖的GDM患者脂肪中溶解与储存的维生素D较多,从而表现为循环维生素D水平较低。
研究[16-18]表明,肥胖可增加多种慢性疾病的患病风险,其中孕前BMI及孕期增重与GDM密切相关已被证实。本研究中,超重肥胖组GDM患者血清FBG、HbA1c、FINS、HOMA-IR、TC、TG、LDL-C水平高于非肥胖组GDM患者,血清HDL-C水平低于非肥胖组GDM患者,分析原因是由于超重、肥胖患者内脏脂肪组织分泌的炎性细胞因子更多,对Ins信号造成损伤,引起脂肪堆积、糖脂代谢紊乱及胰岛素抵抗。李卫红等[19]对江西省4 790名成人进行调查发现,BMI与糖脂代谢紊乱密切相关。本研究经Pearson相关性分析,超重肥胖GDM患者血清25-(OH)D3水平与FBG、HbA1c、FINS、HOMA-IR、TC、TG、LDL-C呈负相关(P<0.05);与HDL-C呈正相关(P<0.05),分析原因可能是由于胰岛素抵抗参与肥胖的发生发展,维生素D缺乏或不足可能对脂肪细胞代谢、低度炎症反应、免疫应答、氧化应激以及线粒体功能等途径产生影响,引起机体糖脂代谢异常、增加胰岛素抵抗风险,因此其与上述指标具有明显相关性。本研究还发现,干预后,两组维生素不足及缺乏患者25-(OH)D3水平均高于干预前、HOMA-IR值均低于干预前,提示补充维生素D3有利于改善其胰岛素抵抗,分析原因与补充维生素D可降低脂肪细胞内脂肪堆积、缓解脂肪组织白细胞浸润、改善特异性免疫功能紊乱、提升血清总的抗氧化能力、调节线粒体调节功能等途径相关。王永祥等[20]发现,孕前肥胖患者口服高剂量维生素D后多项生理指标得到改善,妊娠并发症及不良妊娠结局发生率明显降低。在王孝君等[21]研究中,GDM 组血清25-(OH)D3水平低于正常妊娠组,并提出血清25-(OH)D3缺乏是GDM高危因素,早期补充维生素D可缓解胰岛素抵抗情况,上述研究均与本研究结论类似。
综上,相较于非肥胖GDM患者,超重肥胖的GDM患者血清25-(OH)D3水平较低,且与糖脂代谢、胰岛素抵抗相关;补充维生素D3有利于改善维生素D3不足、缺乏的GDM患者胰岛素抵抗情况。

