基于文献与网络药理学分析黄芪-地黄在气阴两虚糖尿病中的作用机制
侯亚琼,王辉,郭彦魁,宋献美
1.河南中医药大学,河南 郑州 450046;2.河南医学高等专科学校,河南 郑州451191
糖尿病是由遗传和环境因素相互作用而引起的一组以慢性高血糖为共同特征的代谢异常综合征。随着糖尿病在疾病谱中的比重不断上升从而逐渐成为威胁人类健康的巨大杀手,传统中医药对糖尿病良好的疗效引发了更多的关注。糖尿病中90%以上患者是2 型糖尿病(T2DM)[1],而根据《中国2 型糖尿病防治指南(2020 年版)》,除了现代医学的治疗方式以外,中医治疗中将T2DM 分三型辨证:阴虚热盛、气阴两虚和阴阳两虚[2]。《中医内科学》教材中也明确提出消渴病本质以“阴虚为本,燥热为标”[3]。根据消渴证病机特点,初期为阴虚热盛阶段,由于消渴本质是虚证,热盛阶段不能持久,伤阴耗气会后很快进入气阴两虚阶段。而至阴阳两虚阶段,概因疾病迁延,气阴损耗日久至阴损及阳,元阳亏损以至于阴阳两虚。故气阴两虚证型在糖尿病中持续时间最久,且贯穿于糖尿病整个病程的中后期。在知网和万方数据库中试检索后,气阴两虚的研究文献显著多于其他两种类型。因此研究T2DM 气阴两虚证型的中医药疗法具有较大意义。
1 气阴两虚型T2DM 数据挖掘
以中国知网和万方平台为依托使用专业检索,检索现存截至2022 年1 月以来,有完整内服方药组成的中医药临床辨证治疗T2DM 且疗效确切的相应证型的文献。可以包含西药联合中药方剂的治法和名中医验方或专家经验,排除非本证型以外的其他证型和动物实验类文献。知网平台检索式为SU=(“糖尿病”+“消渴”+“T2DM”+“TⅡDM”+“DMⅡ”)ד气阴两虚”,万方平台检索式为(“糖尿病”or“消渴”or“T2DM”or“TⅡDM”or“DMⅡ”)and“气阴两虚”)。气阴两虚型共计采集收录符合标准的方剂395首,累计中药217 种。使用中医传承平台计算平台(TCMSP)v3.0 对结果进行分析。统计结果包含药物频次、关联规则和聚类分析。
1.1 药物频数统计通过TCMSP 分析,气阴两虚证型中,用药频次在2%以上的药物,如表1,占方比指在本证型中,含有某一味中药的方剂数量与收录方剂总数量的比值。
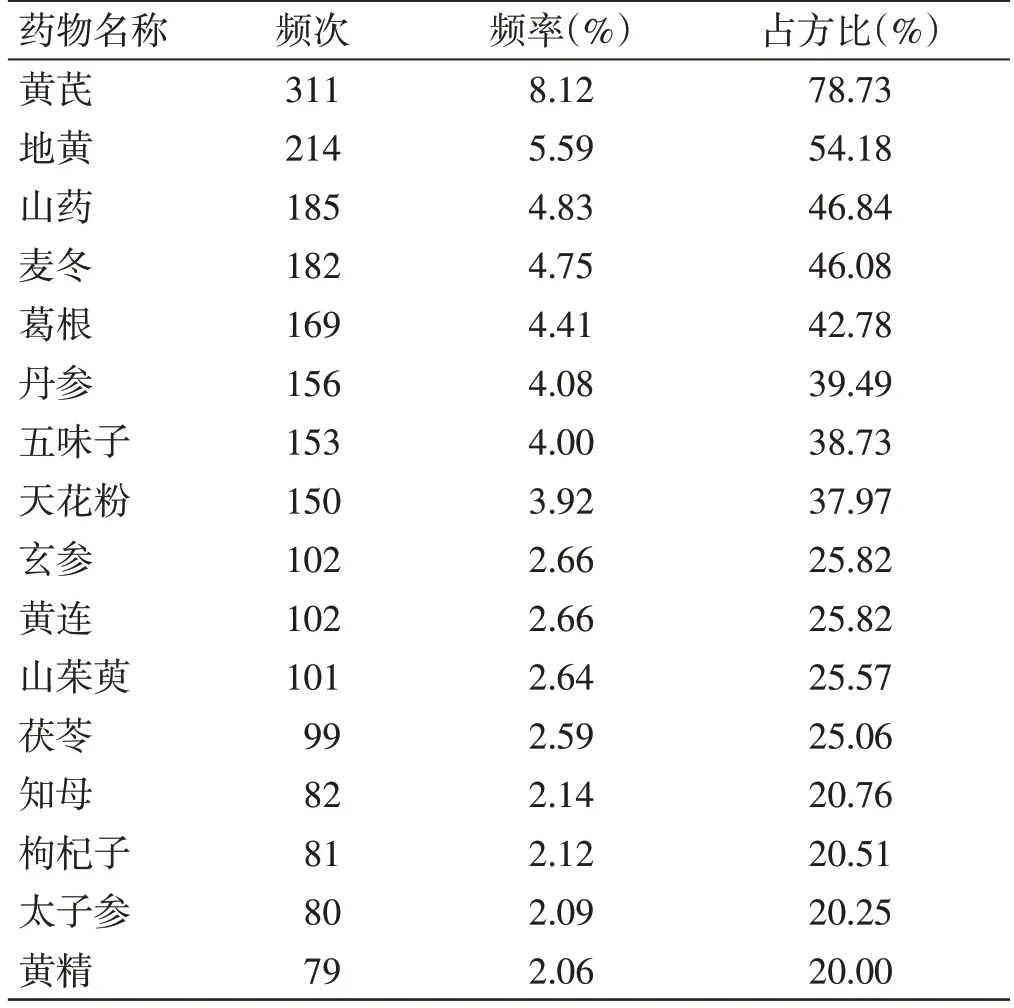
表1 气阴两虚型常用药物(单味药物频率≥2%)
1.2 关联规则将气阴两虚组数据的置信度设≥80%,支持度设为30%(支持个数为118 个)可得到8 个药物组合,黄芪-地黄频次为180 次居于首位,其药物组合关联规则置信度为0.84。
1.3 聚类分析应用TCMSP 平台“方剂分析”中的“聚类分析”(采用k-means 算法+回归模拟),将聚类个数设置为3时,可以得到3 个核心药物聚类。聚类频率首位59.75%的药物组合为:黄芪、地黄、山药、葛根、麦冬。且3 个核心药物组成中有2 个都含有黄芪-地黄。聚类分析图的离散和聚集程度如图1。
2 网络药理学分析黄芪-地黄药对治疗T2DM 作用机制
由数据挖掘结果析可知,在气阴两虚证型中,使用频率最高的药物为黄芪,使用率为8.12%,使用频次为311,占方比为78.73%;一半以上的方剂使用了黄芪、地黄(占方比>50%)。在关联规则中,设置置信度条件下,黄芪、地黄药对频词居于首位,且置信度较高为0.84;核心方剂三聚类时,2 个核心方剂中均出现黄芪、地黄药对组合。说明黄芪-地黄药对组合在糖尿病气阴两虚证型中居于极其重要的地位和治疗作用,研究黄芪、地黄药对组合的多种成分和糖尿病之间的相互关系,有较大的意义。
2.1 黄芪-地黄有效成分筛选通过TCMSP 平台搜寻黄芪成分,设置OB≥30%,类药性DL≥0.18,得到有效成分后通过其MOL.ID 号搜寻单味药成分作用靶点。通过文献收集地黄有效成分,并运用Pubchem数据库获得地黄成分SMILES。导入到结构相似度预测靶点数据库Swiss Target Prediction 预测靶点。然后通过herb 平台补充地黄有效靶点,最后利用uniprot数据库下载化合物Excel 数据表格,运用“TRIM”函数优化数据,使用“VLOOKU”函数匹配靶点基因名。并查阅相关文献补充未匹配到的基因名称。最后,将综合得到的化学成分的相关靶点蛋白利用Uniprot 数据库,对其进行注释。并利用Cytoscape 3.8.2 将其可视化。
2.2 糖尿病靶点预测及关键靶点获取运用Gene-Cards(https://www.genecards.org/)和 OMIM(https://www.omim.org/)平台获取疾病相关靶点,疾病名称取“Diabetes”为关键词搜索相关靶点。设置对象为“human”,使用“VLOOKUP”函数匹配靶点基因名并筛选交集基因。从Venny(https://bioinfogp.cnb.csic.es/tools/venny/)软件获取中药活性化合物作用靶点与糖尿病的交集靶点,即为黄芪-地黄治疗糖尿病的潜在靶点。
2.3 蛋白质-蛋白质相互作用(PPI)网络图构建通过String(https://string-db.org/)平台,导入交集基因,对象设置(homo sapiens)、取最高置信度0.9,隐藏游离基因节点,得到蛋白互作关系。结果导入Cytoscape 3.7.2,选择“network Analyzer”。取Degree值的二倍中位数以上,BC 和CC 的中位数上作为衡量标准筛选中药与疾病的核心靶点。
2.4 GO 及KEGG 富集分析利用Metascape(http://metascape.org/)平台进行GO 功能、KEGG 通路富集分析,把所得交集靶点导入列表中,对象设为“human”,设置最小重叠(Min Overlap)为3、p 值取0.05、最低浓缩度为1.5,并将分析结果可视化。
2.5 黄芪-地黄关键成分与重要靶点的分子对接将药对关键成分与重要靶点进行分子对接验证。从RCSBPDB(https://www.rcsb.org)数据库中下载重要核心靶点PDBID 的PDB 格式,通过PvMOL2.2.0 软件去除溶剂分子与配体。利用TCMSP 数据库获取核心活性成分,并在Pubchem(https://pubchem.ncbi.nlm.nih.gov)数据库中下载核心成分3D 结构的sdf 格式,通过OpenBabel3.1.1 软件转化为mol2 格式。利用AutoDockTools1.5.7 软件对核心靶点及核心成分进行加氢、计算电荷数量、加ROOT 等操作。最后利用AutoDockTools1.5.7 软件进行分子对接运算与分析,算法选择“Local Search Parameters”,并借助OpenBabel、PyMOL 软件完成文件格式转化与分子对接视图输出。
3 网络药理学分析结果
3.1 黄芪-地黄成分筛选在TCMSP 中检索黄芪-地黄药对的化学成分并进行筛选(设置OB≥30%,DL≥0.18),获取黄芪活性成分11种,地黄活性成分5 种。获得黄芪和地黄活性成分对应的靶点555 个。此外根据检索结果得到4 458 个糖尿病治疗作用相关的靶点。将黄芪-地黄有效成分的555 个靶点与糖尿病治疗作用相关的4 458 个靶点,利用韦恩图进行可视化,见图2,可以看到药物活性成分与疾病之间有310 个共同靶点。

图2 黄芪-地黄与T2DM 共同靶点韦恩图
3.2 黄芪-地黄活性成分-靶点见图3。利用Cytoscape3.7.2 构建黄芪-地黄干预糖尿病的“药物-成分-靶点”网络图,图中青色方块形状部分为靶点,共计555 个节点。红色为黄芪活性成分,共计11 个节点。蓝色为地黄活性成分共计5 个节点。加上2 个药物节点一共573 个节点。
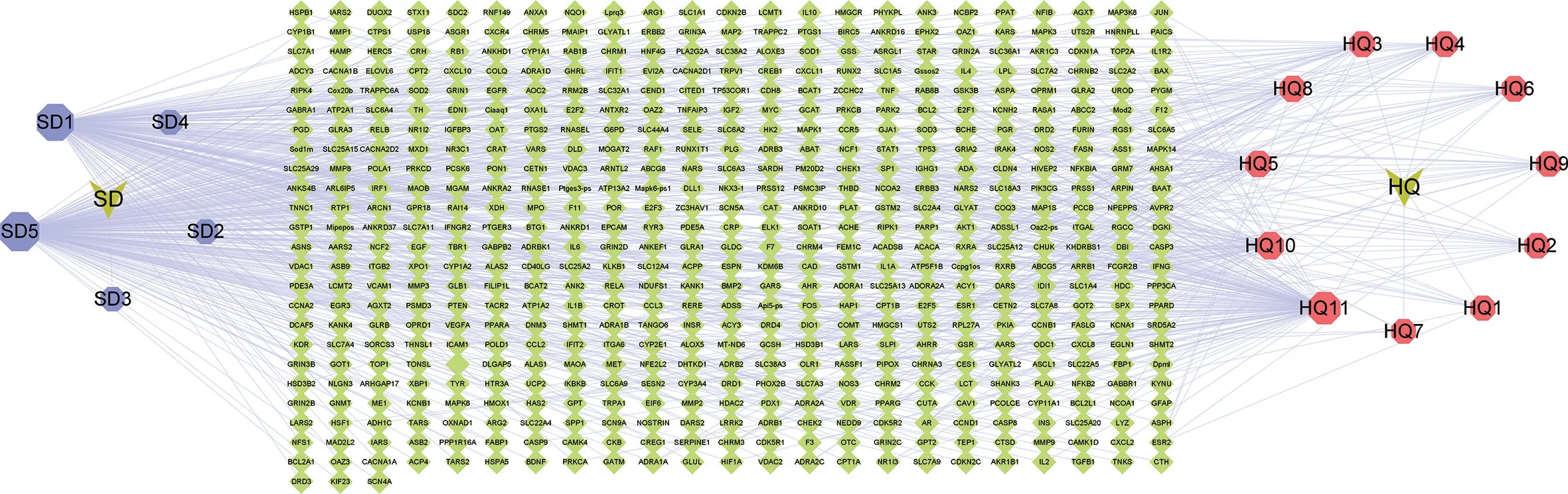
图3 “药物-成分-靶点”网络图
3.3 PPI 网络构建见图4。利用String 导入交集基因,设置对象(homo sapiens)、取最高置信度0.900,隐藏游离基因节点。结果导入软件Cytoscape3.7.2,选择“network analyzer”,得到网络拓扑学参数作图。得出130 个节点和1 034 条边。选择Degree 值的二倍中位数以上,BC 和CC 的中位数上作为衡量标准筛选核心成分靶点,得出核心成分靶点为TP53、AKT1、TNF、JUN、IL-6、MAPK3。

图4 黄芪-地黄干预T2DM PPI 网络图
3.4 GO 功能富集分析与KEGG 通路富集分析见图5。将交集靶点进行GO 功能和KEGG 富集分析,GO 富集中得到BP 4 952条,MF 717条,CC 387 条。由GO 富集功能可见其干涉疾病的生物过程主要涉及药物反应、营养水平、活性氧代谢、氧化应激反应、细胞对化学压力和脂多糖的反应等方面。分子功能主要涉及儿茶酚胺结合、核受体活动、配体激活的转录因子活性、羟酸结合等方面;细胞组分主要涉及膜阀、膜微结构域、膜区域、突触后膜、突触膜等方面。KEGG 富集得到通路289条,根据所有通路的LogP 值、富集分数、基因数目,筛选出10 条信号通路,并进行可视化分析,如图6。黄芪-地黄治疗气阴两虚型糖尿病可能与AGE-RAGE 通路、白细胞介素(IL)-17 信号通路、肿瘤坏死因子(TNF)信号通路、药物反应通路、化学致癌-活性氧通路、化学致癌受体激活以及人类巨细胞感染通路等有关。

图5 黄芪-地黄干预T2DM 关键靶点GO 功能富集分析图
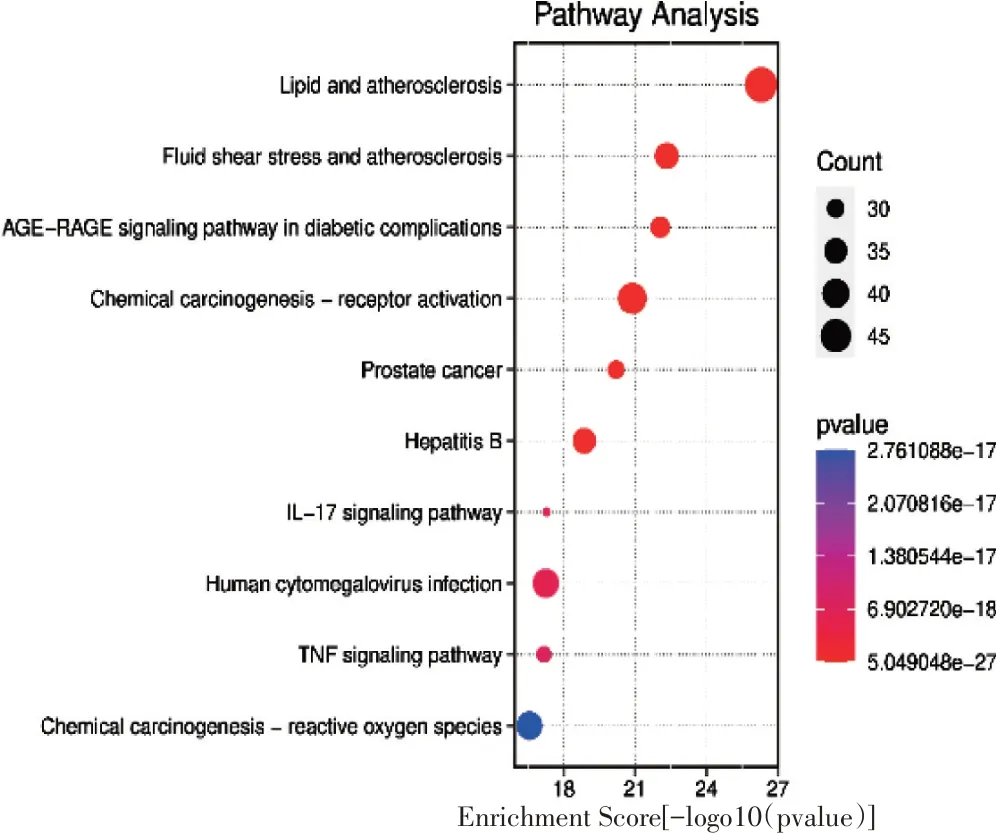
图6 黄芪-地黄干预T2DM 关键靶点KEGG 功能富集分析图
3.5 分子对接见表2、图7~11。将黄芪-地黄中的核心成分槲皮素、山奈酚、7-O-甲基异丁香酚、γ-氨基丁酸和PPI 网络中的核心成分靶点TP53(1gzh)、AKT1(7nh5)、TNF(7ta3)、JUN(1jnm)、IL-6(1il6)、MAPK3(7nrb)进行分子对接验证,结果如表2。当化合物与靶点之间结合能<0 的时候,认为蛋白靶点与化合物之间可以自行结合。若结合能<-1.2,则表明活性成分与靶点蛋白之间的对接活性良好。本次分子对接结果中大部分结合能<-5,可以认为化合物和靶点之间具有较强的结合能力。表明黄芪-地黄对糖尿病的干预效果较好,与文献数据挖掘中的结果相符。表2 每横列为同一化合物与各个主要靶点的结合能,每竖列为同一靶点和不同化合物的结合能。对接结合能越小,表明化合物和靶点之间的结合越紧密。取每横列及每竖列的最小对接结果,去除>-5 的对接结果及构象不理想的对接结果,得到对接活性较好的部分通过Pymol 软件进行可视化展示,如图7~11。

图7 AKT1-槲皮素
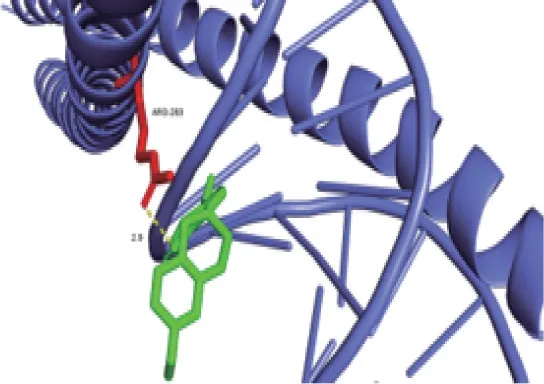
图8 JUN-7-O-甲基异丁香酚

图9 JUN-山奈酚
图10 IL-6-山奈酚

图11 MAKP3-山奈酚

表2 黄芪-地黄核心成分与核心靶点分子对接 kcal/mol
4 讨论
网络药理学分析显示,黄芪-地黄药对中的潜在活性成分有16种,主要成分有槲皮素、山奈酚、7-O-甲基异丁香酚、γ-氨基丁酸等。槲皮素除了抗炎、抗氧化作用外,可以通过抑制α-葡萄糖苷酶来增强db/db 小鼠的胰岛素敏感性和胰岛素信号传导,从而改善空腹高血糖。同时,槲皮素中的醛糖还原酶抑制剂可以通过抑制醛糖还原酶(AR)活性控制过量葡萄糖代谢,减少山梨醇的积聚,改善一系列眼部并发症的症状。此外,生理浓度范围内的槲皮素可通过激活CaMKKβ/AMPK 通路和胰岛素信号通路,增加肌肉细胞对葡萄糖的摄取,从而达到降低血糖的目的[4]。山奈酚在动物实验中不但可以有效地改善糖尿病大鼠空腹血糖,同时还可以保护糖尿病大鼠肾损伤,对糖尿病造成的病理组织起到保护作用[5]。γ-氨基丁酸可通过激活GSK-3β/Nrf2 通路来保护胰腺组织。在糖尿病动物模型中单独使用、与其他成分联合使用都能有效改善动物血糖。T2DM 大鼠食用含γ-氨基丁酸的饲料后,体内磷脂酰肌醇3-激酶、蛋白激酶B、核因子E2 相关因子2(Nrf2)基因水平上调,糖原合成激酶3β(GSK-3β)基因水平下降,血糖和胰岛素水平得到改善[6]。
PPI 网络图提示TP53、AKT1、TNF、JUN、IL6、MAPK3 为黄芪-地黄药对治疗T2DM 的关键靶点。现代研究显示,TP53 可诱导细胞生长停滞、细胞凋亡和细胞分化,参与平滑肌细胞凋亡调控,其高表达可减少心血管疾病及主要心血管不良事件的发生,参与糖的稳态调控[7-8]。AKT1 在多种组织中表达,以心、脑、肺中多见,能够广泛参与细胞的生长和增殖。ATK1 是IRS-2 下游信号的主要部分,被胰岛中的IRS-2 激活后,进而介入胰岛细胞增殖,是胰岛β 细胞增殖所必须的[9]。此外,ATK1 与TSC22D4 相互作用时,能够降低饥饿期间AKT 其下游靶标的基础磷酸化,促进胰岛素敏感性并改善葡萄糖代谢[10]。
TNF-α 是重要的炎性介质,参与体内免疫平衡调节过程,彭航娅等[11]研究表明TNF-α 与胰岛素抵抗相关,且骨骼肌分泌的TNF-α 与葡萄糖的摄取和利用呈负相关。王迪等[12]研究表明,单纯T2DM 患者血清TNF-α 大于健康对照组。T2DM 患者血清中TNF-α 与骨密度呈现负相关,TNF-α 升高时,患者骨密度下降,合并骨质疏松并发症的可能性升高。且T2DM 患者肠道菌群水平紊乱水平与TNF-α 存在相关性[13]。研究发现,通过抑制c-Jun,c-Fos 的基因表达,下调AP-1 水平,可有效改善糖尿病大鼠肾皮质功能损伤[14]。此外发现T2DM 患儿外周血JUN的基因表达降低,JUN 与儿童T2DM 密切相关[15]。IL-6 是一种多功能的细胞因子,与T2DM 的病理生理学相关。IL-6 循环水平的升高是T2DM 的独立预测因子,被认为与炎症、胰岛素抵抗以及β 细胞功能障碍发展有关。此外多种证据能够表明IL-6 具有抗炎作用并能够改善葡萄糖代谢[16]。邢旭[17]临床观察表明T2DM 患者血清中IL-6 异常表达,且与肾脏损伤程度相关。
KEGG 的通路富集结果显示,黄芪-地黄干预糖尿病的信号通路主要与AGE-RAGE 通路、IL-17 信号通路、TNF 信号通路等相关。AGEs 是在高糖环境下的代谢产物,其毒性作用可直接破坏肾脏细胞及其组织,也称为“糖毒素”。RAGE 是一种具有独特氨基酸末端序列多肽,是细胞表面分子中免疫球蛋白超家族中的一个多配体成员,在众多疾病中的发生和发展中发挥重要作用。许多细胞如内皮细胞、单核-巨噬细胞、血管平滑肌细胞、肾小球上皮细胞、星形细胞和小神经胶质细胞的表面都可见RAGE的表达[18]。健康人体中的RAGE 表达低下,持续的高糖状态或糖尿病时,RAGE 出现高表达[19]。AGEs-RAGE 信号通路可以激活下游信号传导通路包括p38MAPK、NF-κB 等共同参与氧化应激与炎症,引起糖尿病微血管并发症[20]。此外AGEs-RAGE 信号通路可以激活肾素-血管素紧张素-醛固酮系统,促使血管内皮细胞增生,活性氧(ROS)的生成加速,从而造成足细胞的损伤[18]。越来越多的观点认同糖尿病是一种由慢性脂糖代谢引起的炎性疾病。炎性因素在糖尿病发生和发展中占重要地位。TNF-α 可通过多种信号转导途径引起炎症因子升高及胰岛素抵抗[21]。JNK 信号通路在肥胖引起的胰岛素抵抗中起关键作用,而TNF-α 可以激活JNK。TNF-α 还可通过诱导SOCS 家族成员中SOCS3 的表达来参与介导细胞因子对胰岛素信号通路的抑制。一氧化氮(NO)在诱生型一氧化氮合酶(iNOS)/NO 信号通路中参与胰岛素抵抗,介导炎症因子、脂质和葡萄糖诱导的B 细胞损伤,同时也是导致B 细胞凋亡的重要介质。而TNF-α和TNF-γ 可以通过诱导L6 骨骼肌细胞iNOS 表达,催化NO 产生,从而导致胰岛素抵抗,并通过介导炎症因子、脂质及高糖所致的胰岛B 细胞功能障碍,在T2DM 发病中起到非常重要的作用[22]。IL-17 在T1DM 和T2DM 患者的胰岛中均有表达,T2DM 患者胰岛中IL-17 的表达最高[23]。有研究表明,IL-17 可能通过激活NF-κB 通路,上调炎症细胞因子基因表达,刺激促炎细胞因子包括TNF-α 的分泌,从而抑制胰岛素信号通路,诱导胰岛素抵抗,最后导致T2DM 的发生发展[24]。
本研究对近20 年间现代处方文献的检索和挖掘,筛选出治疗气阴两虚型T2DM 的核心药对黄芪-地黄。通过网络药理学分析得到黄芪-地黄16 个活性成分,活性成分相关靶点555 个。T2DM 靶点4 458个,交集靶点310 个。并通过分子对接验证核心成分与靶点之间存在较强的对接活性。GO 富集中得到BP 4 952条,MF 717条,CC 387 条。KEGG 富集得到通路289条,主要涉及AGE-RAGE 通路、IL-17 信号通路、TNF 信号通路等。提示黄芪-地黄可通过多成分、多通路、多靶点对气阴两虚型T2DM进行干预。
综上,通过大量数据挖掘得到中药治疗T2DM气阴两虚证型的主要药物和方剂,并对挖掘结果中的核心药物进行网络药理学分析和靶向的研究,揭示药物的作用机制和多种调节途径。研究结果能够为临床中医药治疗气阴两虚型T2DM 提供参考,并为科研提供思路和实验依据,提高药物试验的成功率。

