滋阴明目丸干预视网膜色素变性小鼠效应及机制研究
曾梅艳 ,熊萌, ,仇婧玥, ,喻昶, ,欧晨 ,宋厚盼, ,彭清华, , ,秦裕辉,
1.湖南中医药大学中医学院,湖南 长沙 410208;
2.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410208;
3.湖南中医药大学中医药防治眼耳鼻咽喉疾病湖南省重点实验室,湖南 长沙 410208
视网膜色素变性(retinitis pigmentosa,RP)是一类具有高度遗传异质性的视网膜变性疾病。视杆细胞受损是导致RP的主要原因,患者大多表现为视力逐渐下降或视野缩窄、夜盲,通常为双眼患病且眼底表现对称。流行病学调查显示,全球约有150万RP患者,西方国家发病率为1/4 000~1/3 000,我国发病率约为1/3 500[1]。现代医学尚缺乏有效治愈或延缓RP进展的方法。
穆勒细胞是哺乳动物视网膜最主要的神经胶质细胞,约占视网膜细胞总量的90%,因其在胚胎发育过程中与视网膜神经元有共同的干细胞来源,因此与视网膜神经细胞具有密切联系[2]。穆勒细胞在维持视网膜正常结构和功能中发挥重要作用,其过度胶质激活可引发视网膜兴奋性毒性损伤,破坏视网膜内环境离子平衡,从而加速视网膜损伤,最终形成胶质瘢痕,抑制视网膜神经再生功能,加速RP进程[3]。抑制穆勒细胞胶质化是防治RP的重要手段。
RP属中医学“高风雀目”“高风内障”“阴风障”范畴。临床实践表明,中医药治疗RP在提高患者视力与增加视野方面具有较好疗效和潜在优势,同时对缓解患者不稳定情绪和提高生活质量具有积极意义[4]。滋阴明目丸是湖南中医药大学李传课教授根据临床经验研制,前期研究发现,该方能提高RP患者暗适应B波振幅,降低视网膜黄斑中心凹厚度[5]。本研究探讨滋阴明目丸对RP模型小鼠的干预效应及对穆勒细胞胶质化的影响,为滋阴明目丸临床治疗RP等眼底病提供实验依据。
1 材料与方法
1.1 动物
4周龄SPF级C57BL/6J小鼠12只,4周龄SPF级rd10小鼠48只,雌雄各半,湖南斯莱克景达实验动物有限公司提供,使用许可证号SYXK(湘)2018-0004,实验动物质量合格证号1107271911002785。饲养于温度23~25 ℃、湿度50%~55%环境,12 h/12 h明暗循环,自由摄食饮水。本研究经湖南中医药大学实验动物中心伦理委员会批准(LLBH-202107210001)。
1.2 药物及制备
滋阴明目丸(熟地黄、山药、枸杞子、黄精、三七、川芎、当归、丹参、菟丝子、牛膝、石菖蒲等17味中药组成),湖南中医药大学第一附属医院提供,批号20211213。将药丸置于研钵中研成粉末,以沸水溶解,搅拌均匀,制成浓度0.25 g/mL药液。乐盯软胶囊,广州市范乐医药科技有限公司,0.5 g/粒,批号ABJ90400701。以市售花生油溶解,配制成0.008 g/mL药液备用。复方托吡卡胺滴眼液,批号MP2228,参天制药(中国)有限公司。
1.3 主要试剂与仪器
SteadyPure 通用型RNA 提取试剂盒(批号A3A2084)、Evo M-MLV反转录试剂(批号A3A2044),艾科瑞生物有限公司;Pierceable Foil Heat Seal(批号1814040)、DG8 Cartridges for Droplet Generator(批号1000122527)、微滴生成油(批号64442314),美国Bio-Rad公司;苏木素染液(批号CR2112051)、分化液(批号CR2112181)、返蓝液(批号CR2112174)、伊红染液(批号CR2202010)、 DAPI (批号CR2203098)、抗荧光淬灭封片剂(批号CR2202016)、Cy3标记山羊抗小鼠二抗(批号CR2205060),武汉赛维尔生物科技有限公司;中性树胶(批号20211201),国药集团化学试剂有限公司;胶质纤维酸性蛋白(GFAP)一抗(批号AI07253146),北京博奥森生物技术有限公司。
Dante包埋机,意大利DIAPATH公司;YT-12K全自动组织脱水机,湖北耀楚医疗器械科技有限公司;Galileo石蜡切片机,意大利DIAPATH公司;DMi8倒置荧光显微镜,德国Leica公司;BA410E正置光学显微镜,厦门麦克奥迪医疗诊断系统有限公司;nonmyd 7非散瞳眼底照相机,日本KOWA公司;MicronⅣ造影光学相干断层扫描一体机,美国Phoenix Research Labs公司;Ganzfeld视网膜电图仪,美国Phoenix Research Labs公司;QX200TM数字PCR仪,美国Bio-Rad公司。
1.4 分组及给药
将12 只C57BL/6J 小鼠作为正常对照组,48 只rd10小鼠随机分为模型组、乐盯组和滋阴明目丸低、高剂量组,每组12只。乐盯组予乐盯药液0.15 g/kg灌胃,滋阴明目丸低、高剂量组分别予滋阴明目丸药液4.50、9.00 g/kg灌胃,正常对照组和模型组予等体积生理盐水灌胃,每日1次,连续30 d。
1.5 HE染色观察视网膜组织病理变化
给药结束后,每组随机取6只小鼠,腹腔注射1%戊巴比妥钠4 mL/kg麻醉小鼠,75%乙醇消毒眼睑周围,摘取双眼眼球,FAS眼球固定液固定,常规石蜡包埋,切片。依次将切片放入二甲苯、无水乙醇、75%乙醇、自来水中脱蜡至水。将切片放入苏木素染液中染色5 min,水洗返蓝,置于伊红染液中染色5 min,无水乙醇、二甲苯透明,中性树胶封片,显微镜下采集图像,观察视网膜组织病理改变。
1.6 视网膜电图检测视网膜功能
各组剩余6只小鼠腹腔注射1%戊巴比妥钠麻醉小鼠,置于37 ℃恒温台,复方托吡卡胺滴眼液散瞳,采用视网膜电图仪检测小鼠视网膜功能。将参比电极接于两耳间皮下,地电极接于尾部,金属电极接于右眼角膜中央。记录8.0×104cd/m2(持续时间1 ms)光强度刺激下的视网膜电图反应波形,每组测6个反应波形,计算A波振幅和B波振幅。
1.7 眼底光学相干断层扫描检测
小鼠散瞳后以2.5%羟丙基甲基纤维素将角膜湿润,采用MicronⅣ造影光学相干断层扫描一体机对视网膜进行检测。调节恒温台高度,使镜头与角膜接触,获取眼底图像并对全视网膜进行扫描,分别于距视神经乳头(ONH)150、300、450 μm处测量视网膜全层厚度。
1.8 数字PCR检测
眼科显微镜下钝性分离视网膜,使用RNA提取试剂盒提取视网膜组织总RNA,用反转录试剂盒将RNA反转录为cDNA。数字PCR 反应体系:cDNA 1 μL、Supermix 10 μL、引物1 μL、DNase-free water 8 μL。采用QX200TM数字PCR仪微滴生成器制备反应微滴。反应条件:95 ℃、10 min,94 ℃、30 s,60 ℃、45 s,68 ℃、45 s,共45 个循环;98 ℃、10 min,4 ℃、10 min。于微滴分析器中测定每个微滴FAM荧光信号,计算GFAP mRNA表达量[6]。GFAP引物序列(5'~3'):(上游)CAACGTTAAGCTAGCCCTGGACAT,(下游)CTCACCATCCCGCATCTCCACAGT,产物长度124 bp。
1.9 免疫荧光检测
将眼球组织石蜡切片依次放入二甲苯、梯度乙醇、蒸馏水中脱蜡至水,采用EDTA抗原修复缓冲液于微波炉中对切片进行抗原修复。以免疫组化笔在视网膜组织划圈后加入自发荧光淬灭剂,胎牛血清封闭30 min。加入GFAP一抗(1∶200),4 ℃孵育过夜,PBS漂洗后加入Cy3标记山羊抗小鼠二抗(1∶500),室温避光孵育1 h。滴加DAPI染液,室温避光孵育10 min,抗荧光淬灭封片剂封片,荧光显微镜下观察并拍照。每组采集6张图像,采用Image-Pro Plus 6.0软件分析荧光强度[7]。
1.10 统计学方法
采用SPSS22.0 统计软件进行分析。计量资料以±s表示,先进行方差齐性检验,多组间比较采用方差分析,方差齐组间两两比较用LSD 法,方差不齐用Dunnett's T3法。P<0.05表示差异有统计学意义。
2 结果
2.1 滋阴明目丸对模型小鼠视网膜病理改变的影响
正常对照组小鼠视网膜组织形态正常,内核层和外核层染色均匀,细胞形态规则、排列紧密,视锥细胞和视杆细胞层排列整齐,分界清楚;模型组小鼠视网膜明显损伤,视锥、视杆细胞层,外核层,外丛状层厚度显著变薄甚至消失;滋阴明目丸低、高剂量组小鼠视网膜损伤明显改善,可见明显的视锥、视杆细胞层,外核层和外丛状层。见图1。
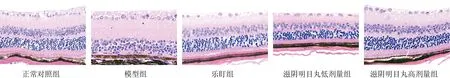
图1 各组小鼠视网膜组织形态(HE染色,×400)
与正常对照组比较,模型组小鼠视网膜外核层厚度和外核层层数明显减少(P<0.01);与模型组比较,乐盯组和滋阴明目丸低、高剂量组小鼠视网膜外核层厚度和外核层层数明显增加(P<0.01)。见表1。
表1 各组小鼠视网膜外核层层数和厚度比较(±s)
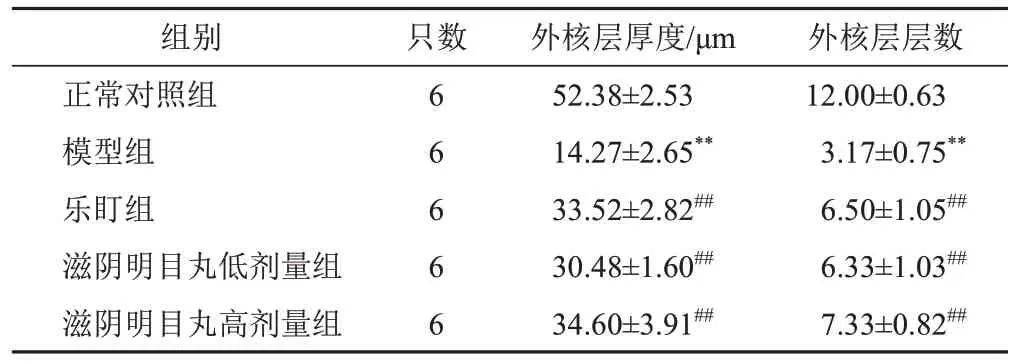
表1 各组小鼠视网膜外核层层数和厚度比较(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
外核层层数12.00±0.63 3.17±0.75**6.50±1.05##6.33±1.03##7.33±0.82##组别正常对照组模型组乐盯组滋阴明目丸低剂量组滋阴明目丸高剂量组只数6 6 6 6 6外核层厚度/μm 52.38±2.53 14.27±2.65**33.52±2.82##30.48±1.60##34.60±3.91##
2.2 滋阴明目丸对模型小鼠视网膜功能的影响
与正常对照组比较,模型组小鼠视网膜A波振幅、B波振幅明显减小(P<0.01);与模型组比较,乐盯组和滋阴明目丸低、高剂量组小鼠视网膜A波振幅、B波振幅明显增加(P<0.01)。见图2、表2。
表2 各组小鼠视网膜A波振幅和B波振幅比较(±s,μV)
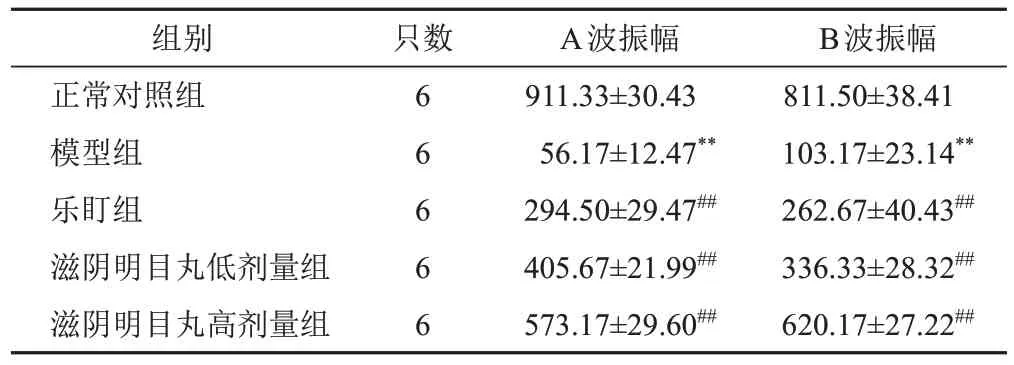
表2 各组小鼠视网膜A波振幅和B波振幅比较(±s,μV)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
B波振幅811.50±38.41 103.17±23.14**262.67±40.43##336.33±28.32##620.17±27.22##组别正常对照组模型组乐盯组滋阴明目丸低剂量组滋阴明目丸高剂量组只数6 6 6 6 6 A波振幅911.33±30.43 56.17±12.47**294.50±29.47##405.67±21.99##573.17±29.60##
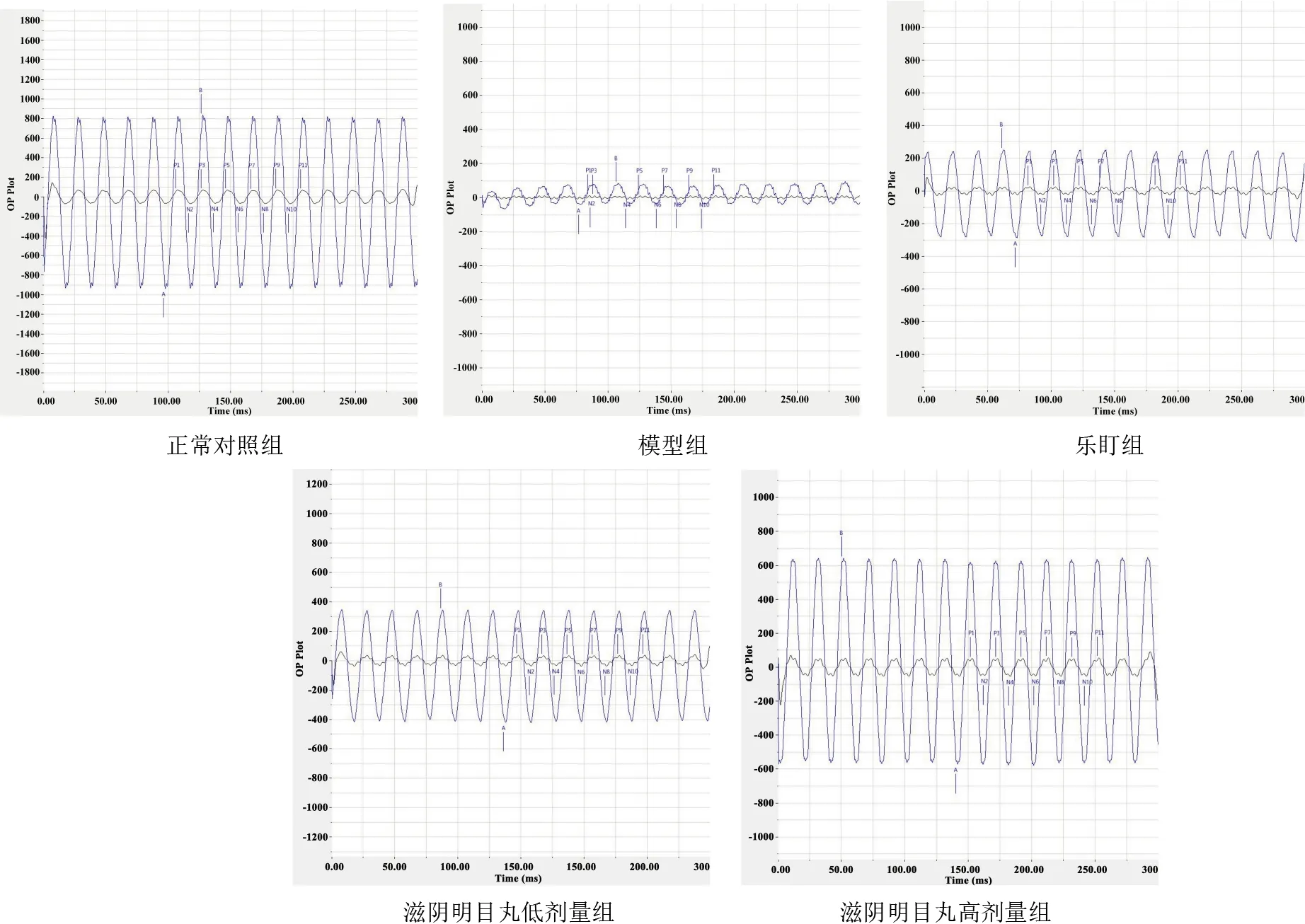
图2 各组小鼠视网膜电图
2.3 滋阴明目丸对模型小鼠视网膜厚度的影响
与正常对照组比较,模型组小鼠视网膜在3个测量点的厚度均明显减少(P<0.01);与模型组比较,乐盯组和滋阴明目丸高剂量组小鼠视网膜在3个测量点的厚度均明显增加(P<0.01)。见图3、表3。
表3 各组小鼠视网膜厚度比较(±s,μm)
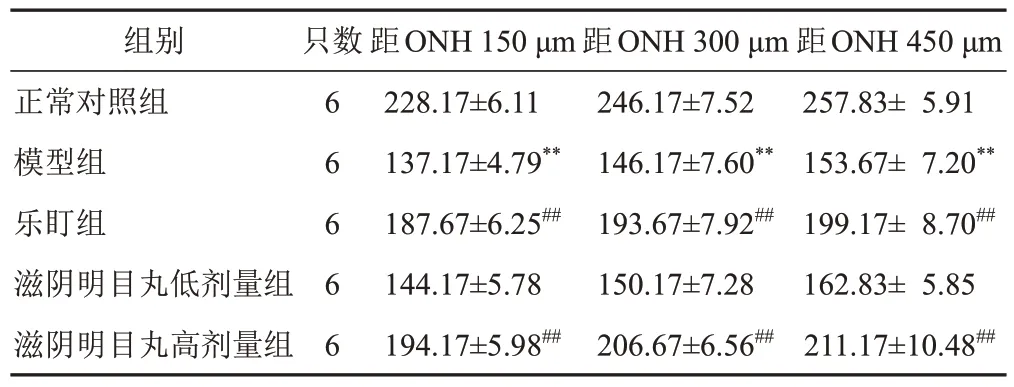
表3 各组小鼠视网膜厚度比较(±s,μm)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
组别正常对照组模型组乐盯组滋阴明目丸低剂量组滋阴明目丸高剂量组距ONH 450 μm 257.83± 5.91 153.67± 7.20**199.17± 8.70##162.83± 5.85 211.17±10.48##只数6 6 6 6 6距ONH 150 μm 228.17±6.11 137.17±4.79**187.67±6.25##144.17±5.78 194.17±5.98##距ONH 300 μm 246.17±7.52 146.17±7.60**193.67±7.92##150.17±7.28 206.67±6.56##
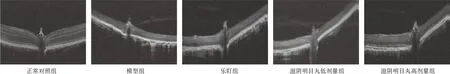
图3 各组小鼠视网膜光学相干断层扫描
2.4 滋阴明目丸对模型小鼠视网膜胶质纤维酸性蛋白mRNA表达的影响
GFAP是视网膜穆勒细胞胶质化的标志蛋白。与正常对照组比较,模型组小鼠视网膜GFAP mRNA平均拷贝数和总拷贝数均明显增加(P<0.01);与模型组比较,乐盯组和滋阴明目丸低、高剂量组小鼠视网膜GFAP mRNA平均拷贝数和总拷贝数均明显降低(P<0.01)。见表4。
表4 各组小鼠视网膜GFAP mRNA表达比较(±s)
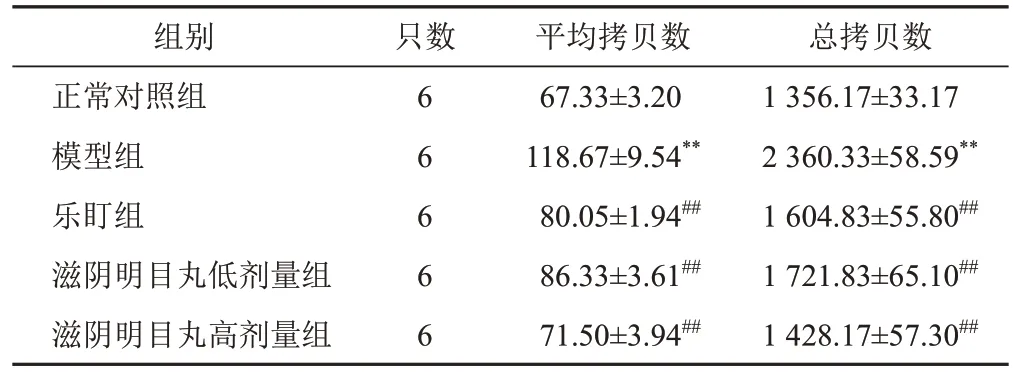
表4 各组小鼠视网膜GFAP mRNA表达比较(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
只数总拷贝数1 356.17±33.17 2 360.33±58.59**1 604.83±55.80##1 721.83±65.10##1 428.17±57.30##组别正常对照组模型组乐盯组滋阴明目丸低剂量组滋阴明目丸高剂量组6 6 6 6 6平均拷贝数67.33±3.20 118.67±9.54**80.05±1.94##86.33±3.61##71.50±3.94##
2.5 滋阴明目丸对模型小鼠视网膜胶质纤维酸性蛋白表达的影响
与正常对照组比较,模型组小鼠视网膜GFAP蛋白表达明显升高(P<0.01);与模型组比较,乐盯组和滋阴明目丸低、高剂量组小鼠视网膜GFAP蛋白表达明显降低(P<0.01)。见图4、表5。
表5 各组小鼠视网膜GFAP蛋白表达比较(±s)

表5 各组小鼠视网膜GFAP蛋白表达比较(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
平均荧光强度4.87±1.06 23.26±3.41**6.32±0.82##8.61±1.21##6.20±0.94##组别正常对照组模型组乐盯组滋阴明目丸低剂量组滋阴明目丸高剂量组只数6 6 6 6 6

图4 各组小鼠视网膜GFAP蛋白表达(免疫荧光染色)
3 讨论
RP是一种以视杆细胞和视锥细胞受累为主的遗传性进行性视网膜疾病,分为综合征型和非综合征型两大类:前者发病过程可累及其他器官,导致功能障碍;后者发病部位主要在眼部,约占RP病例总数的80%[8]。尽管基因治疗、干细胞治疗、视网膜假体等新型治疗手段已应用于RP治疗,但这些方法对不同患者疗效差异较大,且存在价格昂贵、不良反应大等问题[9]。
先天禀赋不足、后天失养是导致RP的基本原因。先天不足多责之于肾脏虚劳,元阳匮乏。后天失养与脾胃亏虚、气血不足、精血不能濡养目睛有关,病程日久,脉络阻闭,神光衰微,视野缩窄、视力减退。RP核心病机为虚中夹瘀,以虚为本,络脉瘀阻为标,补虚活血、通络明目是RP的关键治法。滋阴明目丸具有补虚滋阴、活血明目功效。课题组前期拆方研究发现,方中枸杞子、丹参配伍可抑制rd10小鼠视网膜细胞凋亡,维持视网膜正常结构,从而保护视功能[10]。
rd10小鼠为RP最常用的动物模型,该品系小鼠出生后17 d视网膜全层及外核层厚度均与正常小鼠接近,此后视网膜开始变性,相较于其他RP动物模型,rd10小鼠视网膜变性开始的时间推后、变性速度减缓,能准确地模拟RP发病过程[11]。本研究HE染色结果表明,rd10小鼠视网膜出现明显损伤,外核层显著变薄,予滋阴明目丸治疗后,视网膜组织损伤得到明显改善,外核层层数和厚度均显著增加。视网膜电图是检测视网膜功能的常用方法,视网膜电图A波可反映视杆细胞和视锥细胞的功能,主要用于评价视网膜能否正常接收光信号;B波可反映视网膜内穆勒细胞和双极细胞功能,主要用于评价光信号能否传递到大脑[12]。本研究结果显示,模型组小鼠视网膜功能明显减弱,表现为A波振幅和B波振幅均显著减少。经滋阴明目丸治疗后,模型小鼠A波振幅和B波振幅均显著增加,提示滋阴明目丸能提高RP模型小鼠视网膜功能。
光学相干断层扫描可对活体内部形态进行非侵入、无损伤、无接触的检测,获取组织内部结构的横断面图像,广泛应用于各专科领域,其中眼科疾病的诊疗方面应用最为成功[13]。本研究采用该技术检测滋阴明目丸对RP模型小鼠的作用效果,结果显示,与正常对照组比较,模型组小鼠视网膜全层厚度显著降低。给予高剂量滋阴明目丸治疗后,在距离ONH 150、300、450 μm 3个测量点,小鼠视网膜全层厚度均显著增加。
穆勒细胞是一类广泛存在于视网膜中的放射状胶质细胞,与其他视网膜神经细胞具有共同的祖细胞。穆勒细胞的主要功能为支撑视网膜,为视网膜血管和神经元提供代谢支持[14]。研究表明,穆勒细胞具有视网膜前体细胞属性,可自我更新并分化成视网膜特异的神经元,如视锥细胞和视杆细胞。因此,抑制穆勒细胞胶质化、促进其分化是治疗RP 的重要途径[15]。GFAP可特异性表达于视网膜穆勒细胞,当穆勒细胞受损时,伴随细胞胶质化的发生,GFAP在穆勒细胞大量合成与堆积。采用数字PCR和免疫荧光法从分子水平检测滋阴明目丸治疗RP的作用机制,结果显示,模型组小鼠视网膜GFAP mRNA 和蛋白表达均显著上调,提示模型组小鼠视网膜穆勒细胞发生胶质化。给予滋阴明目丸治疗后,小鼠视网膜GFAP mRNA和蛋白表达均显著下调,提示滋阴明目丸能抑制穆勒细胞胶质化。
综上所述,滋阴明目丸可修复RP小鼠视网膜组织损伤,增加视网膜外核层和视网膜全层厚度,提升视网膜A波和B波振幅,改善视网膜功能,其分子机制与下调视网膜GFAP mRNA和蛋白表达、抑制视网膜穆勒细胞胶质化有关。

