补肾活血复方对心肌梗死后心力衰竭大鼠心室重构及心肌和结肠组织AQP4表达的影响
许瑞 ,张艳 ,何佳 ,尹文浩 ,邹文聪 ,刘娴贤 ,何晓腾
1.辽宁中医药大学研究生学院,辽宁 沈阳 110847;
2.辽宁中医药大学附属医院,辽宁 沈阳 110032;
3.辽宁中医药大学博士后流动站,辽宁 沈阳 110847
心力衰竭是各种心血管疾病的终末阶段。根据《2020中国心力衰竭医疗质量控制报告》,我国35岁以上居民心力衰竭患病率为1.3%,与2000年相比患病人数增加近500万,严重影响我国居民健康[1]。急性心肌梗死常合并心力衰竭,主要表现为急性心肌细胞坏死后心脏结构和/或功能异常导致心输出量降低及肺循环或体循环瘀血等一系列临床综合征[2]。研究发现,心肌细胞膜表面水通道蛋白(AQP)4的异常表达与心力衰竭时水液代谢紊乱密切相关,影响心脏组织水肿及心肌梗死后心功能不全或慢性心力衰竭的进展[3-4]。心力衰竭时会发生严重的肠道细菌移位和水液代谢紊乱、液体超载[5-6],而结肠组织表面AQP4异常表达会导致结肠对水分的吸收和分泌紊乱[7]。由此推测,心力衰竭后结肠水液代谢失调与AQP4维持水的转运功能障碍密切相关。课题组前期研究表明,AQP2参与肾脏水液代谢,应用补肾活血方可明显下调心力衰竭大鼠AQP2表达、缓解利尿剂抵抗、减少水肿,起到治疗心力衰竭作用[8]。补肾活血复方由辽宁中医药大学附属医院张艳教授团队结合多年临床经验在该院院内制剂参草通脉颗粒基础上化裁而成。研究显示,参草通脉颗粒可提高慢性心力衰竭患者生活质量[9],解决部分患者利尿剂抵抗的问题,缓解尿少、大便异常症状,改善心功能,延缓心力衰竭进展[10]。本研究基于“肾藏精主水”理论,聚焦心、肠之间水液代谢关系,探析补肾活血复方治疗心肌梗死后心力衰竭的作用机制。
1 材料与方法
1.1 动物
健康雄性SD大鼠60只,13周龄,体质量(230±10)g,辽宁长生生物技术有限公司提供,动物许可证号SCXK(辽)2015-0001。于辽宁中医药大学实验动物中心分笼饲养,通风良好,每日光照12 h,温度25 ℃、湿度50%,自由摄食饮水。普通饲料由辽宁中医药大学实验动物中心提供。本实验经辽宁中医药大学伦理委员会审批(21000092019038)。
1.2 药物
补肾活血复方由菟丝子20 g、龟甲胶15 g、黄精20 g、黄芪40 g、丹参30 g、人参10 g、红花15 g、益母草20 g、三七5 g组成,饮片由辽宁中医药大学附属医院药剂中心提供,由本课题组制成原药材浓度为1.575 g/mL煎液。托伐普坦片,15 mg/片,浙江大冢制药有限公司,批号211107S,用蒸馏水配制成浓度为0.135 mg/mL溶液。
1.3 主要试剂与仪器
N 端脑钠肽前体(NT-proBNP)ELISA 试剂盒(上海酶联生物公司,货号ml003242-C),AQP4抗体(英国Abcam公司,货号ab259318),β-actin抗体(美国Affinity Biosciences公司,货号AF7018),蛋白裂解液(上海碧云天生物技术有限公司,货号P0013B),蛋白酶抑制剂(上海碧云天生物技术有限公司,货号P1050),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,货号P0010),ECL显色液(上海天能科技有限公司,货号180-501),HRP-羊抗兔IgG(艾美捷科技有限公司,货号A12004-1),10%PAGE凝胶制备试剂盒(上海雅酶生物医药技术有限公司,货号03648300)。小动物心电图机(湖南鼠行生物科技有限公司,型号RM6240B/RM6280C/RM-62160C),小动物呼吸机(成都泰盟科技有限公司,型号HX-300),彩色多普勒超声诊断仪(美国通用电气公司,型号Vivid 7 Dimension),多功能酶标仪(美国Thermo公司,型号Multiskan MK3),组织包埋机、石蜡切片机(德国Leica公司,型号ASP6025/RM2235),显微摄像系统(日本OLYMPUS 公司,型号DP73),电泳仪(美国Bio-Rad公司,型号JY300C)。
1.4 造模、分组及给药
60只大鼠适应性喂养1周后,用随机数字表法分为空白组15只和实验组45只。空白组不予处理。实验组禁食不禁水12 h,腹腔注射3%戊巴比妥钠50 mg/kg麻醉,固定于手术台,气管插管,连接小动物呼吸机,设置呼吸频率80~100次/min、呼吸比2∶1、潮气量6~8 mL,接通心电图。待大鼠呼吸平稳后,于胸骨左缘第3~4肋间备皮,暴露皮肤,碘伏消毒,手术刀切开后钝性分离胸部肌肉,镊子分离胸膜,扩胸器撑开胸腔,充分暴露心脏,挤压右侧胸腔并托举心脏,钝性分离心包膜,于左冠状动脉前降支距分叉3~4 mm处用缝合线结扎。闭合胸腔,手术线逐层缝合各层组织,术后心电图显示肢体导联ST段抬高≥0.1 mV(见图1),提示急性心肌梗死造模成功[11]。待大鼠呼吸恢复正常,撤去呼吸机和气管导管,连续5 d腹腔注射青霉素6万单位避免伤口感染。存活大鼠正常饮食1周后饲料减半,且每日力竭式游泳1次(持续游泳至肢体无明显摆动及头部完全没入水中3 s以上),持续28 d。大鼠行心脏彩超检测左心室射血分数(EF)≤50%表明心力衰竭造模成功[11]。将最终造模成功的28只大鼠随机分为模型组10只、托伐普坦组9只和补肾活血组9只。按人与大鼠等效剂量换算,托伐普坦组灌胃托伐普坦溶液1.35 mg/kg,补肾活血组灌胃补肾活血复方煎液15.75 g/kg[8,12],3 mL/次,空白组和模型组灌胃等体积蒸馏水,连续4周。
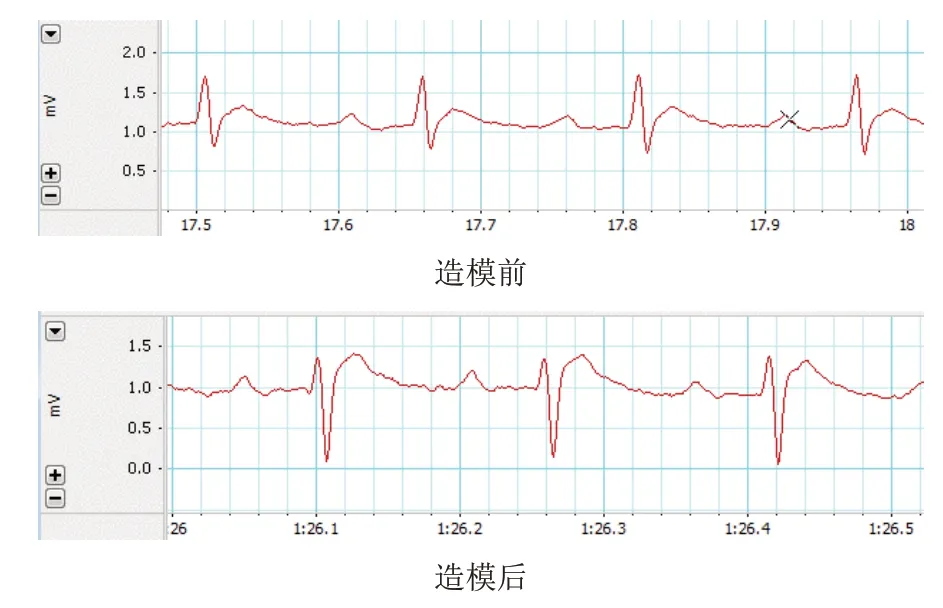
图1 大鼠造模前后心电图
1.5 指标检测
1.5.1 大鼠体征观察实验过程中观察大鼠毛色、精神、活动、饮食、二便、体质量以及有无喘促症状等。
1.5.2 左心室结构与功能检测
干预结束后,腹腔注射3%戊巴比妥钠麻醉大鼠,固定于操作台,心前区脱毛膏脱毛备皮,探头涂抹耦合剂贴于大鼠心前区,应用心脏彩超检测左心室结构[收缩末内径(ESD)、舒张末内径(EDD)]与功能[EF、短轴缩短率(FS)]。
1.5.3 血清N端脑钠肽前体含量测定
腹腔注射3%戊巴比妥钠麻醉大鼠,腹主动脉取血,3 000 r/min离心5 min,分离血清,ELISA测定血清NT-proBNP含量,严格按试剂盒说明书操作,酶标仪波长450 nm 处测定各孔OD 值,计算NT-proBNP含量。
1.5.4 心肌和结肠组织形态观察
干预结束后,腹腔注射3%戊巴比妥钠麻醉大鼠,沿正中线打开腹腔,刺破横隔膜,取出心脏和结肠,用生理盐水冲洗,剪取左心室心肌组织与结肠组织,于4%多聚甲醛溶液中固定,石蜡包埋,切片,每组随机选取4张切片进行HE染色,光镜下观察心肌和结肠组织形态。
1.5.5 心肌和结肠组织蛋白检测
将心肌和结肠组织用超声破碎机匀浆,4 ℃、12 000 r/min离心15 min,分离上清液,BCA蛋白浓度测定试剂盒检测蛋白浓度,电泳槽加Marker及心肌和结肠组织蛋白样品,浓缩胶电压80 V,分离胶电压120 V,电泳1.5 h。PVDF膜浸入甲醇活化5~10 min,将蛋白转印至PVDF 膜,用5%脱脂奶粉封闭2 h。TBST洗膜5 min,重复2次,内参蛋白(β-actin)及目的蛋白(AQP4)一抗以1∶1 000稀释,PVDF膜置于孵育盒中,4 ℃孵育过夜。次日TBST洗膜10 min,重复3次,二抗以1∶10 000稀释,将膜放入孵育盒中,室温孵育2 h。TBST洗膜10 min,重复3次,显色剂曝光成像,用Image J 1.8.0分析条带灰度值,计算AQP4相对表达量(AQP4灰度值/β-actin灰度值)。
1.6 统计学方法
采用SPSS21.0 统计软件进行分析,GraphPad Prism 8.0.1软件作图。计量资料符合正态分布用±s表示,多组间比较方差齐采用方差分析,方差不齐采用秩和检验,两两比较采用Tukey法。P<0.05表示差异有统计学意义。
2 结果
2.1 补肾活血复方对模型大鼠体征的影响
给药过程中,因灌胃不当、严重并发症等原因大鼠共死亡6只,最终空白组11只、模型组8只、托伐普坦组和补肾活血组各9只。
空白组大鼠毛色光泽,精神佳,反应灵敏,活泼好动,饮食、二便正常,体质量逐渐增加;模型组大鼠毛色黯淡、脱毛严重,爪、尾部呈紫色,精神颓废,身体慵懒,活动量小,纳差,尿少,大便秘结,体质量减轻,部分有呼吸急促、喘促及哮鸣音表现;托伐普坦组和补肾活血组大鼠毛色光泽逐渐恢复,精神良好,活动、饮食、二便及体质量均有改善,无喘促等症状。
2.2 补肾活血复方对模型大鼠左心室结构与功能的影响
与空白组比较,模型组大鼠左心室ESD、EDD明显增加,EF和FS明显减小(P<0.05);与模型组比较,托伐普坦组与补肾活血组大鼠左心室ESD、EDD明显减小,EF、FS明显增加(P<0.05);与托伐普坦组比较,补肾活血组大鼠左心室ESD、EDD、EF、FS差异无统计学意义(P>0.05)。见表1、图2。
表1 各组大鼠左心室结构与功能指标比较(±s)
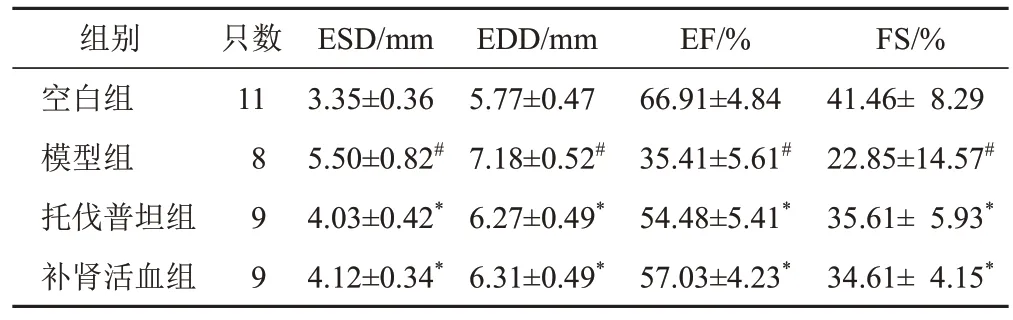
表1 各组大鼠左心室结构与功能指标比较(±s)
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05
组别空白组模型组托伐普坦组补肾活血组FS/%41.46± 8.29 22.85±14.57#35.61± 5.93*34.61± 4.15*只数11 8 9 9 ESD/mm 3.35±0.36 5.50±0.82#4.03±0.42*4.12±0.34*EDD/mm 5.77±0.47 7.18±0.52#6.27±0.49*6.31±0.49*EF/%66.91±4.84 35.41±5.61#54.48±5.41*57.03±4.23*
图2 各组大鼠心脏彩超
2.3 补肾活血复方对模型大鼠血清N 端脑钠肽前体含量的影响
与空白组比较,模型组大鼠血清NT-proBNP含量明显增加(P<0.05);与模型组比较,托伐普坦组和补肾活血组大鼠血清NT-proBNP 含量明显减少(P<0.05)。见表2。
表2 各组大鼠血清NT-proBNP含量比较(±s,pg/mL)
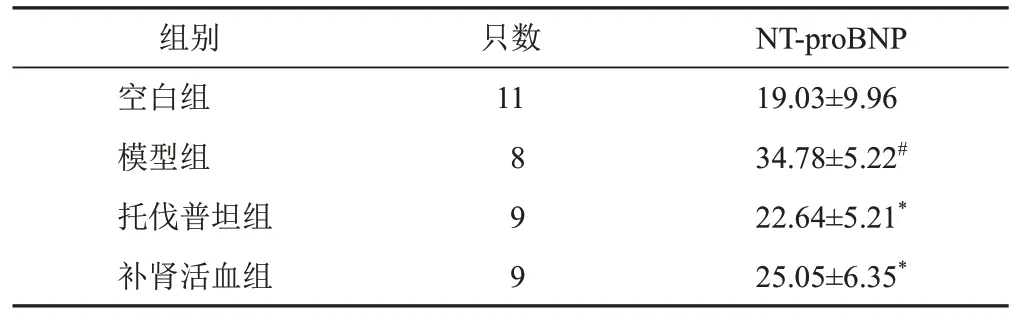
表2 各组大鼠血清NT-proBNP含量比较(±s,pg/mL)
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05
NT-proBNP 19.03±9.96 34.78±5.22#22.64±5.21*25.05±6.35*组别空白组模型组托伐普坦组补肾活血组只数11 8 9 9
2.4 补肾活血复方对模型大鼠心肌和结肠组织形态的影响
空白组大鼠心肌结构形态完整,心肌纤维排列有序,细胞核无固缩、溶解,肌原纤维无断裂、损伤;模型组大鼠梗死区心肌细胞坏死,周围存活心肌出现心肌细胞代偿性肥大、心肌间质成分增加、心肌纤维化甚至瘢痕组织形成;托伐普坦组和补肾活血组大鼠心肌纤维排列较整齐,部分心肌纤维断裂、坏死,细胞核位于细胞边缘,极少细胞核固缩、碎裂,较模型组显著改善。见图3。

图3 各组大鼠心肌和结肠组织形态(HE染色,×200)
空白组大鼠结肠黏膜完整,上皮排列有序,杯状细胞丰富,无淋巴细胞浸润;模型组大鼠结肠黏膜上皮排列紊乱,杯状细胞较少,大量淋巴细胞浸润;托伐普坦组和补肾活血组大鼠结肠黏膜上皮相对完整、排列较整齐,杯状细胞较多,偶见少量淋巴细胞浸润,较模型组显著改善。见图3。
2.5 补肾活血复方对模型大鼠心肌和结肠组织水通道蛋白4表达的影响
与空白组比较,模型组大鼠心肌组织AQP4蛋白表达明显升高(P<0.05),结肠组织AQP4蛋白表达明显降低(P<0.05);与模型组比较,托伐普坦组和补肾活血组大鼠心肌组织AQP4 蛋白表达明显降低(P<0.05),结肠组织AQP4蛋白表达明显升高(P<0.05);与托伐普坦组比较,补肾活血组大鼠心肌和结肠组织AQP4蛋白表达明显升高(P<0.05)。见图4、表3。
表3 各组大鼠心肌和结肠组织AQP4蛋白表达比较(±s)
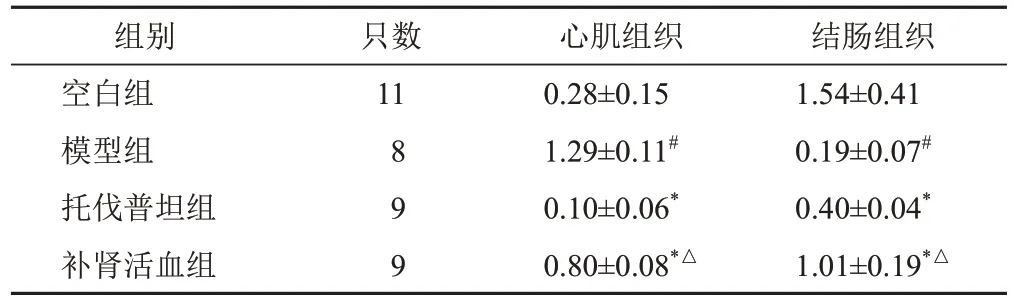
表3 各组大鼠心肌和结肠组织AQP4蛋白表达比较(±s)
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05;与托伐普坦组比较,△P<0.05
结肠组织1.54±0.41 0.19±0.07#0.40±0.04*1.01±0.19*△组别空白组模型组托伐普坦组补肾活血组只数11 8 9 9心肌组织0.28±0.15 1.29±0.11#0.10±0.06*0.80±0.08*△

图4 各组大鼠心肌和结肠组织AQP4蛋白免疫印迹
3 讨论
慢性心力衰竭病情较重且病程长,其相应的实验模型难度较大。虽然心肌缺血性心力衰竭造模操作较为复杂,死亡率略高,但成模时间短,且模拟了心肌梗死后心功能下降、心室重构,最终发展为心力衰竭的过程。冠状动脉结扎法是急性心肌缺血模型的常用方法[13]。因此,本实验慢性心力衰竭造模采用心肌缺血性心力衰竭,通过结扎大鼠左冠状动脉造成心肌梗死,再配合力竭式游泳、饥饿造成慢性心力衰竭[14],此法更贴近临床。
心肌梗死后心力衰竭动物模型制备可通过心电图检测、心脏结构与心功能检测、NT-proBNP检测及心肌病理形态观察等判断模型是否成功。本研究对比大鼠左冠状动脉前降支结扎前后心电图,结扎后ST段抬高,提示结扎成功,引起急性心肌梗死。超声心动图可无创检测心脏结构和心功能,本实验发现,模型组大鼠左心室增大,心功能明显下降,左心室EF 为35.41%,明显低于空白组,符合心力衰竭判定标准。NT-proBNP主要由心室肌细胞合成与分泌,反映心室容量负荷与压力变化。心肌梗死后心力衰竭时左心室增大,心室肌细胞合成并分泌大量NT-proBNP入血,因此其含量变化与心力衰竭诊断及指导用药密切相关[15],也可用于评估心力衰竭预后[16]。本实验模型组大鼠血清NT-proBNP含量明显高于空白组,说明心肌梗死后心室肌发生一系列形态结构重构。HE染色显示模型组大鼠梗死区心肌细胞坏死,周围存活心肌出现心肌细胞代偿性肥大、心肌间质成分增加、心肌纤维化甚至瘢痕组织形成等变化,使心室发生不可逆重构,进而发展为心力衰竭。
中医药治疗慢性心力衰竭效果显著,但中药方-证的辩证关系及其作用机制尚不明确。因此,采用动物模型论证中医药理论是促进中医药发展和实现中医药现代化的有效举措[17-18]。中医学认为,慢性心力衰竭基本病机以心肾阳气亏虚为本,血瘀、痰饮、水毒为标。本研究参考气虚血瘀型动物模型[19]和心力衰竭动物模型[11,14]的制备,结合气虚血瘀型心力衰竭乏力、喘促发病特点,建立大鼠气虚血瘀型心力衰竭动物模型,结果显示,模型组大鼠爪、尾部呈紫色,精神颓废,身体慵懒,纳差,尿少,大便秘结,体质量减少,呼吸急促,表明建立的心力衰竭大鼠模型符合气虚血瘀证证候特点。
补肾活血复方以“肾藏精主水”理论为指导组方:菟丝子补肝肾、固精,黄精补气养阴、益肾健脾,丹参活血祛瘀、益心通经,三者补肾活血,共为君药;龟甲胶滋阴潜阳、益肾健骨,增强菟丝子和黄精补肾之功,红花与三七活血不留瘀,助丹参活血祛瘀,共为臣药;人参、黄芪补元气、补心肾,人参还可生津止渴,黄芪利尿消肿,二者为佐药;益母草破瘀通脉、利水消肿,为使药。治本虚宜补肾益心,除标实宜活血利水,以上诸药共奏此功效。托伐普坦是血管升压素V2受体拮抗剂,属新型排水利尿剂,可调节水钠代谢,用于治疗顽固性难治性心力衰竭,尤其适用于合并利尿剂抵抗和水电解质紊乱患者,故本研究将其作为阳性对照药物[20]。本实验对模型大鼠用药4周后,补肾活血组大鼠毛色光泽逐渐恢复,精神良好,活动量、饮食、体质量均有改善,无喘促等症状,说明补肾活血复方可改善大鼠心力衰竭体征。且补肾活血组大鼠血清NT-proBNP含量减少,左心室ESD、EDD明显减小,EF、FS明显增加,说明补肾活血复方具有改善心室结构及心功能作用。HE染色显示,补肾活血组较模型组显著改善,大鼠心肌纤维排列较整齐,部分心肌纤维断裂、坏死,细胞核位于细胞边缘,极少细胞核固缩、碎裂,说明补肾活血复方可抑制心室重构,改善心肌结构,与托伐普坦组疗效相当。
从现代医学角度分析,心肌梗死后心排出量降低,反射性激活神经-内分泌系统,促进心室重构,引发心力衰竭,此时胃肠黏膜缺血缺氧造成胃肠道屏障损伤,肠道水液代谢紊乱、液体潴留,肠道吸收分泌功能受损,加重心力衰竭进程[21]。因此,胃肠道既是心力衰竭过程中易损伤的靶器官,又是诱发病情进展的始动器官[22]。研究显示,AQP4表达异常影响心肌梗死或心力衰竭大鼠心脏和结肠组织水液代谢平衡[23]。AQP是一组跨细胞膜转运的水通道蛋白,广泛存在于心脏及肠道组织,其中AQP4主要存在于结肠上皮细胞基底外侧膜[24]和心肌细胞膜[25]。在急性心肌梗死状态,细胞内钠盐含量升高,渗透压增加,细胞膜AQP4表达升高,水钠潴留于细胞内,细胞肿胀,心肌水肿,急性期引发心力衰竭,慢性期发生心肌纤维化[4]。当结肠发生炎症和损伤时,AQP4表达显著降低,水液代谢紊乱[26]。本研究结果显示,模型组大鼠结肠黏膜上皮排列紊乱,杯状细胞较少,大量淋巴细胞浸润,心肌组织AQP4表达上调,结肠组织AQP4表达下调;应用托伐普坦和补肾活血复方干预后,大鼠结肠黏膜上皮完整且排列整齐,杯状细胞增多,偶见少量淋巴细胞,心肌组织AQP4表达下调,结肠组织AQP4表达上调,说明补肾活血复方可能通过调控AQP4表达,调节心肌及结肠水液代谢。
综上所述,补肾活血复方可能通过调节心肌和结肠组织AQP4蛋白表达改善心肌梗死后心力衰竭大鼠心室重构及心功能,其具体分子机制有待进一步探究。

