四物汤对糖尿病小鼠学习记忆能力的影响
朱梦姚 ,袁海阳 ,王祎 ,郭自贺 ,贡岳松,
1.南京中医药大学药学院,江苏 南京 210023; 2.江苏鹏鹞药业新药创新中心,江苏 宜兴 214205
糖尿病主要特征为高血糖,认知功能障碍是其常见的神经系统并发症之一,常见记忆力减退、认知功能障碍等症状,因此被认为是阿尔茨海默病(AD)的危险因素之一[1]。高血糖能改变成年大鼠海马区的能量代谢,改变幼鼠海马区乳酸动态平衡和谷氨酸/谷氨酰胺循环,使树突结构异常,从而引起长期认知缺陷[2]。
四物汤是补血养血的经典方剂,最早见于《仙授理伤续断秘方》。该方由熟地黄、当归、白芍和川芎组成,具有补血而不滞血、行血而不伤血的特点。中医学认为,血是神志活动的重要物质基础,是认知、学习记忆的重要载体。血脉充盈、血行有度是学习记忆的生理基础;血虚、血瘀导致的血不养神是学习记忆损伤的基本病机[3]。临床研究显示,四物汤结合中医辨证治疗老年糖尿病具有良好疗效[4]。药理研究表明,四物汤能改善缺铁性贫血幼鼠学习记忆能力[5],提高血管性痴呆大鼠空间学习记忆能力[6]。此外,四物汤及组方中药的有效成分具有雌激素样、抗氧化、抗凋亡和改善脑损伤等多种药理作用[7]。但关于四物汤对糖代谢异常引起的学习记忆损伤是否有改善作用尚不明确。因此,本实验通过尾静脉注射链脲佐菌素(STZ)建立糖尿病小鼠模型,观察四物汤对糖尿病小鼠学习记忆能力的影响,探讨其改善学习记忆损伤的机制,为治疗糖尿病认知功能障碍提供实验依据。
1 实验材料
1.1 动物
SPF级雄性ICR小鼠55只,28~34日龄,浙江维通利华实验动物技术有限公司提供,动物许可证号SCXK(浙)2019-0001。饲养于温度20~22 ℃、相对湿度50%~55%环境,自由摄食饮水,昼夜交替12 h。本实验经南京中医药大学实验动物伦理委员会审批(202206A071)。
1.2 药物与试剂
熟地黄、当归、白芍、川芎饮片,南京同仁堂有限公司提供,经南京中医药大学吴启南教授鉴定,符合2020年版《中华人民共和国药典》规定。STZ(货号V900890),美国Sigma公司;脑源性神经营养因子(BDNF)ELISA试剂盒(货号ZC-38512),上海茁彩;PBS(货号G4202)、HE染色液(货号G1005)、尼氏染液(货号G1036),武汉赛维尔生物;PMSF(货号ST506)、BCA蛋白浓度测定试剂盒(货号P0010),上海碧云天;脱脂奶粉(货号1172GR500),德国BioFroxx;RIPA裂解液(货号FD009)、蛋白酶磷酸酶抑制剂(货号FD1002)、GAPDH 抗体(货号FD0063),杭州弗德生物;PSD95抗体(货号3409S)、NR1抗体(货号5704S),美国CST公司;Shank3抗体(货号sc-377470),美国Santa Cruz公司;NR2B抗体(货号21920-1-AP),美国Proteintech;HRP标记山羊抗兔IgG(货号BL003A)、HRP标记山羊抗小鼠IgG(货号BL001A),安徽Biosharp。
1.3 仪器
GA-3型血糖仪及配套血糖试纸(三诺生物传感股份有限公司),Infinite 200 Pro酶标仪(美国TECAN公司),Ⅸ73型倒置荧光显微镜(日本Olympus公司),Morris水迷宫视频分析系统(安徽正华生物仪器设备有限公司),Microfuge 20R 型微量冷冻高速离心机(美国Beckman Coulter公司),Bisafer900-92超声波细胞粉碎仪(美国赛飞公司),EPS300 电泳仪、5200 Multi凝胶成像系统(上海天能科技有限公司)。
2 实验方法
2.1 药物制备
熟地黄、当归、白芍、川芎按15∶10∶10∶6比例混合,共150 g,加水浸泡30 min,用5 倍量水煎煮2 次,第1 次武火20 min、文火40 min,第2 次武火20 min,文火20 min,合并2次煎液,离心,收集上清液,浓缩至约300 mL,置于-20 ℃冰箱保存备用。
2.2 分组、造模及给药
小鼠适应性饲养1周后,随机分为空白对照组13只及模型组、四物汤低剂量组和四物汤高剂量组各14只。称取一定量STZ粉末置于EP管中,用预冷的0.1 mol/L柠檬酸钠缓冲液(pH 4.5)溶解,避光配制STZ溶液(现用现配)。除空白对照组外,其余各组采用单次尾静脉注射STZ 180 mg/kg造模。观察小鼠食量、尿量及饮水情况,造模后3、5 d检测小鼠空腹血糖,以空腹血糖≥11.1 mmol/L且出现多食、多饮、多尿小鼠为糖尿病小鼠[8]。小鼠成模率97.6%(41/42),每组随机选取12只,于造模成功后开始给药,按《太平惠民和剂局方》记载用量(每剂9 g)的2、4倍等效剂量,四物汤低、高剂量组分别予2.5、5 g/kg四物汤药液灌胃,灌胃体积10 mL/kg,空白对照组和模型组灌胃等量蒸馏水,连续40 d。给药结束后,模型组1只小鼠死亡、1只状态较差,因此最终每组统一保留10只小鼠。
2.3 体质量、血糖和糖耐量检测
分别于给药第7、21、35、40日检测小鼠体质量和血糖水平,给药第40日进行糖耐量实验。各组小鼠禁食6 h后,灌胃葡萄糖2 g/kg,体积0.1 mL/kg,尾尖采血检测并记录灌胃葡萄糖0、0.5、1、2 h的血糖,计算曲线下面积(AUC)。AUC=(0 h血糖+0.5 h血糖)×0.5÷2+(0.5 h血糖+1 h血糖)×0.5÷2+(1 h血糖+2 h血糖)÷2。
2.4 水迷宫实验
Morris水迷宫实验共5 d,前4 d为训练期,第5日为实验期。前4 d每只小鼠从4个象限各学习1次,每次1 min,1 min内小鼠若找到水下平台则进行下一只,若未找到平台,则引导小鼠找到平台,并停留10 s。第5日,将小鼠随机从某一象限放入水中,记录小鼠1 min内找到平台所需的时间,即为逃避潜伏期。
2.5 取材
水迷宫实验结束后,小鼠腹腔注射3%戊巴比妥钠麻醉,暴露心脏,预冷PBS进行心脏灌注,至小鼠脏器膨大、颜色变浅,冰上快速分离海马组织,一部分放入冻存管内,-80 ℃冰箱保存,另一部分放入4%多聚甲醛固定液固定,4 ℃冰箱保存。
2.6 海马组织脑源性神经营养因子含量检测
取海马组织,称重后将组织剪碎,按1∶9(W/V)加入PBS,超声细胞粉碎仪破碎1 min(360 W,工作2 s、间歇3 s),匀浆液4 ℃、5 000×g离心10 min,收集上清液。按ELISA试剂盒说明书步骤检测海马组织BDNF含量。
2.7 海马神经元病理染色
海马组织固定24 h以上,常规脱水、透明、包埋、切片,按照以下步骤进行HE染色和尼氏染色。HE染色:脱蜡、苏木素染色、分化、返蓝、伊红染色、透明、分化;尼氏染色:脱蜡、尼氏染色、分化、终止分化、烤干、封片。染色结束后,将载玻片置于倒置显微镜下观察海马区神经元形态,并拍照记录。
2.8 Western blot检测突触相关蛋白表达
取海马组织置于EP管中,将组织剪碎,加入RIPA裂解液100 μL(含1 mmol/L PMSF),按1∶100加入蛋白酶磷酸酶抑制剂混匀,超声细胞粉碎仪破碎1 min,4 ℃、12 000×g离心15 min,收集上清液,BCA法测定蛋白浓度。制胶,上样(25 μg),电泳,转膜,封闭,加 入 一 抗(GAPDH 1∶8 000、PSD95 1∶4 000、Shank3 1∶1 000、NR1 1∶2 000、NR2B 1∶3 000),4 ℃孵育过夜,洗膜,加入二抗,孵育1 h,曝光,显影。以GAPDH为内参,计算目的蛋白相对灰度值。
3 统计学方法
采用GraphPad Prism 8.0.1统计软件进行分析。计量资料以±s表示,组间比较采用t检验,多组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 四物汤对模型小鼠体质量、血糖和糖耐量的影响
给药前及给药过程中,模型组和四物汤低、高剂量组小鼠体质量差异无统计学意义(P>0.05)。给药第21日和35日,与空白对照组比较,模型组小鼠血糖明显升高(P<0.001);与模型组比较,四物汤高剂量组小鼠血糖明显下降(P<0.001)。随着给药时间延长,四物汤低剂量组小鼠血糖有下降趋势,给药第35日和40日明显降低(P<0.001,P<0.05)。与空白对照组比较,模型组小鼠血糖AUC明显升高(P<0.001);与模型组比较,四物汤低剂量组小鼠血糖AUC明显降低(P<0.05)。见图1。

图1 各组小鼠体质量、血糖和血糖AUC比较(±s,每组10只)
4.2 四物汤对模型小鼠逃避潜伏期的影响
Morris水迷宫结果显示,与空白对照组比较,第3日开始模型组小鼠逃避潜伏期明显延长(P<0.05);与模型组比较,第4日开始四物汤低、高剂量组小鼠逃避潜伏期明显缩短(P<0.05)。见图2。
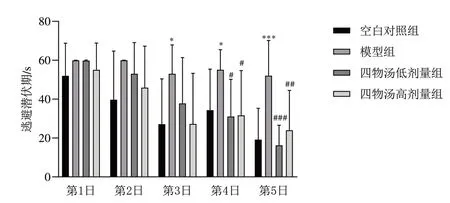
图2 各组小鼠Morris水迷宫实验逃避潜伏期比较(±s,每组10只)
4.3 四物汤对模型小鼠海马组织脑源性神经营养因子含量的影响
与空白对照组比较,模型组小鼠海马组织BDNF含量有降低趋势,但差异无计学意义(P>0.05);与模型组比较,四物汤低、高剂量组BDNF含量有升高趋势,但差异无统计学意义(P>0.05)。见图3。
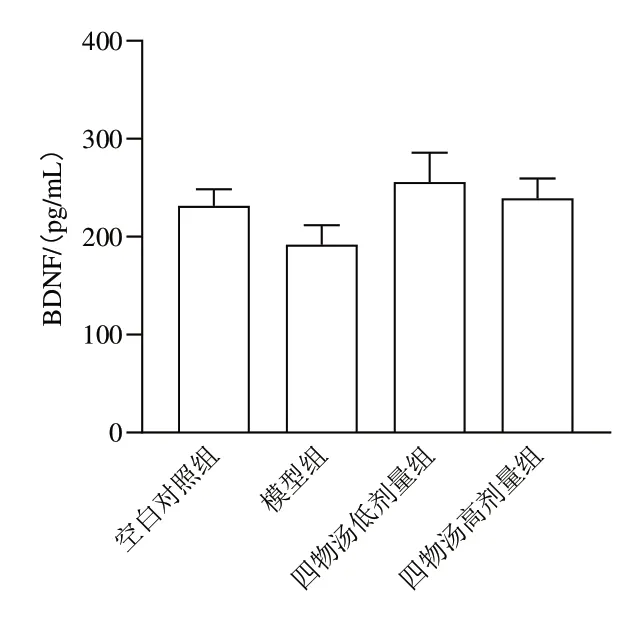
图3 各组小鼠海马组织BDNF含量比较(±s,每组5只)
4.4 四物汤对模型小鼠海马神经元病理形态的影响
空白对照组小鼠海马CA1区神经元细胞核淡染,细胞饱满、排列紧密,尼氏体大且数量多,染色清晰;模型组小鼠海马CA1区神经元出现明显核固缩,细胞核深染,细胞排列散乱,细胞间隙增大,区域间界限模糊,尼氏体小且数量少,染色模糊;四物汤低、高剂量组小鼠海马CA1区可见细胞排列紧密,细胞核着色浅,尼氏体数量显著增多。见图4。
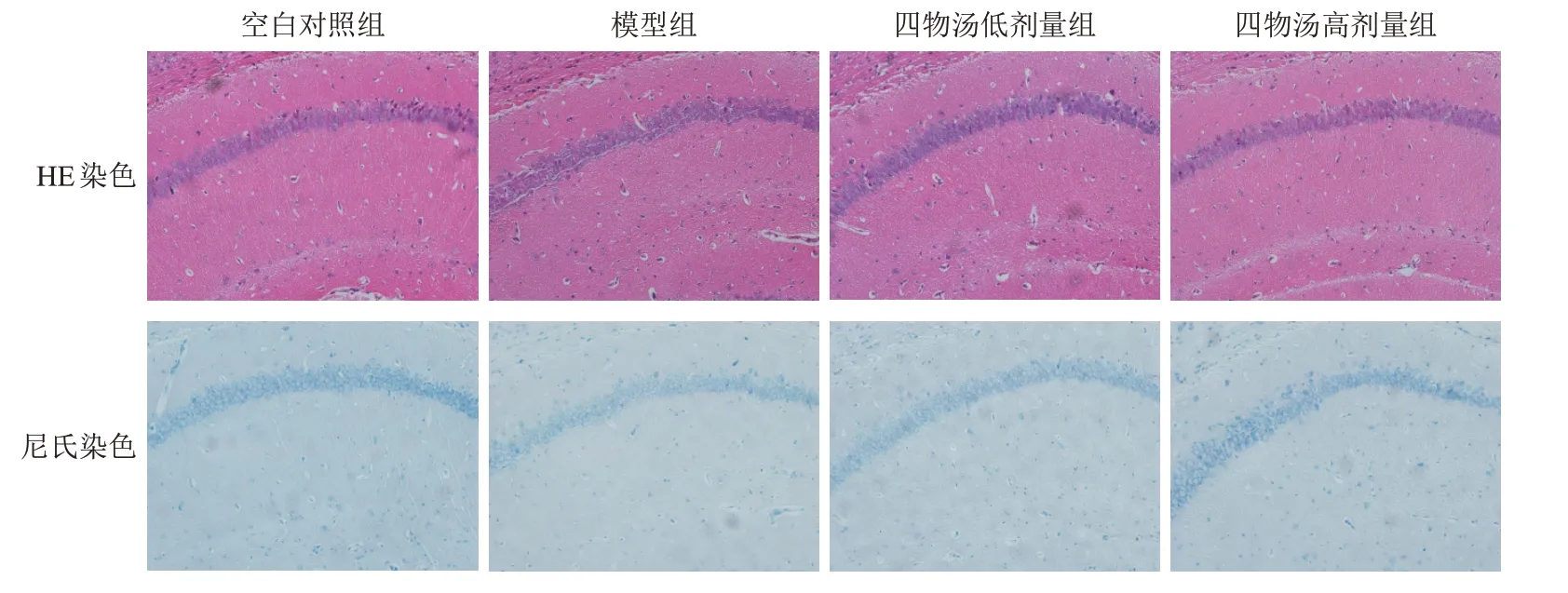
图4 各组小鼠海马CA1区神经元形态(×200)
4.5 四物汤对模型小鼠海马组织突触相关蛋白表达的影响
与空白对照组比较,模型组小鼠海马组织突触相关蛋白PSD95、Shank3、NR1和NR2B表达明显降低,差异有统计学意义(P<0.01,P<0.001)。与模型组比较,四物汤低剂量组NR1和NR2B蛋白表达明显升高(P<0.01,P<0.05),四物汤高剂量组Shank3、NR1和NR2B蛋白表达明显升高(P<0.05,P<0.01),PSD95蛋白表达有升高趋势,但差异无统计学意义(P>0.05)。见图5、表1。
表1 各组小鼠海马组织PSD95、Shank3、NR1和NR2B蛋白表达比较(±s)
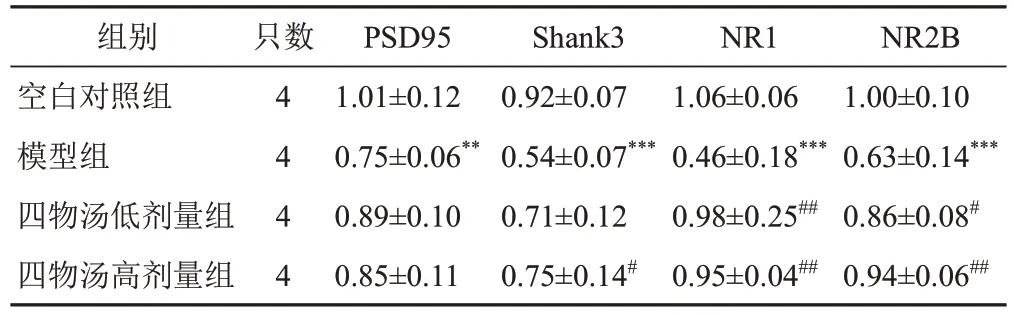
表1 各组小鼠海马组织PSD95、Shank3、NR1和NR2B蛋白表达比较(±s)
注:与空白对照组比较,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01
组别空白对照组模型组四物汤低剂量组四物汤高剂量组NR2B 1.00±0.10 0.63±0.14***0.86±0.08#0.94±0.06##只数4 4 4 4 PSD95 1.01±0.12 0.75±0.06**0.89±0.10 0.85±0.11 Shank3 0.92±0.07 0.54±0.07***0.71±0.12 0.75±0.14#NR1 1.06±0.06 0.46±0.18***0.98±0.25##0.95±0.04##
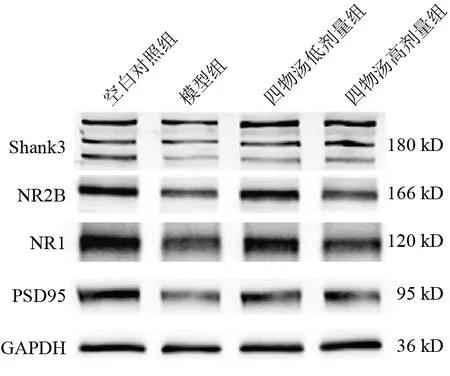
图5 各组小鼠海马组织PSD95、Shank3、NR1和NR2B蛋白免疫印迹
5 讨论
认知功能障碍属中医学“痴呆”“健忘”范畴,其病位在脑,与五脏关系密切,病机以髓减脑消、五脏气血阴阳虚损为本,痰浊血瘀阻塞脑窍为标[9]。人的神志活动以气血为物质基础,血的正常运行和充盈是心主神志的重要条件,是学习记忆的生理基础[3,10]。此外,五脏正常的功能活动是维持学习记忆的重要条件,而血是连接五脏与学习记忆的内在桥梁[3]。四物汤作为补血养血的经典方剂,对其补血、调经作用的研究较多,对其神经保护作用的研究相对较少。糖尿病属中医学“消渴”范畴,呈气血亏虚、阴阳失调、脏腑虚衰且夹瘀等特点。糖尿病患者认知功能障碍的风险增加,因此本研究探究四物汤对糖尿病小鼠学习记忆损伤的改善作用。
STZ被广泛用于诱导糖尿病动物模型,作为一种葡萄糖类似物,STZ通过葡萄糖转运体2进入β细胞,并在细胞内蓄积[11]。STZ通过DNA甲基化、活性氧和活性氮产生、氧化应激和DNA损伤等机制导致β细胞死亡,从而导致高血糖和胰岛素合成及释放减少[12]。腹腔注射STZ 可使小鼠出现持续的高血糖、记忆缺陷[13-14]、p-tau水平升高和神经炎症,以及海马区胰岛素信号异常[14]。本实验发现,模型组小鼠体质量下降,血糖升高,Morris水迷宫实验的逃避潜伏期明显延长,海马组织突触相关蛋白PSD95 和Shank3 水平明显下降,与已有文献结果[13]一致,说明模型组小鼠存在外周糖代谢异常引起的学习记忆障碍。四物汤干预可使其血糖降低,逃避潜伏期明显缩短,Shank3蛋白表达升高,其中四物汤高剂量组差异有统计学意义。
Morris水迷宫实验是评价空间学习最常用的行为任务,广泛用于评估啮齿动物的学习记忆水平,该实验中的学习过程涉及海马和相关区域的结构和功能完整性[15]。海马结构与神经元可塑性、髓鞘形成和神经元间连接相关,海马体积与轻度认知障碍和AD存在一定联系[16]。海马CA1、CA3和DG区对海马结构完整性和信号传导具有重要作用[17-18]。HE染色使细胞核内成分呈蓝紫色,使细胞质和细胞外基质成分呈红色;尼氏染色能较好地显示尼氏体的状态,后者可作为神经元功能的标志。海马病理染色结果显示,模型组小鼠海马CA1区神经元核固缩,细胞排列散乱,细胞间隙增大,尼氏体染色模糊,说明模型组小鼠海马区存在神经元结构和功能异常。四物汤干预可改善神经元损伤,可见细胞核浅染,细胞结构完整、排列紧密,尼氏体染色加深。
BDNF是研究最广泛的神经营养因子之一,是中枢神经系统功能和结构可塑性的关键因子。成熟的BDNF(mBDNF)与高亲和力酪氨酸激酶B(TrkB)受体结合,调节多种功能,如神经元可塑性与凋亡、树突生长和突触可塑性等[19]。BNDF通过调节海马突触前神经递质释放和增强突触后神经递质的敏感性来调节突触信号传递,进而诱导突触可塑性的长时程增强[20]。本实验发现,模型组小鼠海马组织BDNF含量降低,但差异无统计学意义。考虑到STZ的生物半衰期较短,不同实验动物对STZ的敏感性不同,且给药方式、剂量都会影响STZ的造模效果,可能由于本实验造模方法不足以引起海马区BDNF水平显著下降,双侧海马注射STZ 即能引起小鼠海马和前额叶皮层BDNF含量显著下降[21]。此外,四物汤未能显著提高海马组织BDNF含量,可能原因是模型组BDNF未能显著下降,四物汤提高BDNF水平受机体稳态调控,BDNF满足机体所需即可,从而使模型组与四物汤组之间差异无统计学意义。鉴于已有研究显示,四物汤具有提高BDNF水平作用[5],且BDNF对神经功能有重要调节作用,因此考虑在其他学习记忆障碍相关模型中研究四物汤对BDNF及其上下游信号通路的调节。
突触结构是神经元之间信息交流的基础,其完整性和可塑性是神经系统稳态的前提,且突触可塑性是学习和记忆的潜在分子机制。突触可塑性依赖于谷氨酸受体在突触后致密区的正常整合,谷氨酸受体包括N-甲基-D-天冬氨酸受体(NMDAR)、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPAR)和代谢型谷氨酸受体(mGluR)等[22]。PSD95和Shank蛋白是突触后致密区的重要支架蛋白,其中Shank 蛋白家族包括Shank1、Shank2和Shank3。Shank蛋白通过交联突触后致密区的Homer和PSD95复合物,调节mGluR和NMDAR信号通路,进而参与和调节突触后信号传导[23-24]。突触NMDAR信号不足会损害神经元细胞的存活,而过度刺激谷氨酸能信号传导会导致非兴奋性毒性,使神经细胞受损或死亡,因此NMDAR信号传导必须保持在适当水平[25]。功能性NMDAR的形成需要NR1和至少1个NR2亚基结合,其中前额叶皮层的NR2B亚基对突触长时程增强和情景记忆形成至关重要[26]。在AD患者大脑额叶皮质突触体和突触后致密区中,NR1 和Shank3蛋白水平显著下降,这些蛋白的病理变化可能直接或间接影响树突棘和突触的功能[27]。本研究发现,四物汤可以提高糖尿病小鼠海马组织Shank3、NR1和NR2B 蛋白表达,但未能显著提高PSD95 蛋白表达,说明四物汤可以恢复NMDAR信号传导、上调突触后致密区Shank3蛋白水平,恢复突触稳态,进而提高小鼠学习记忆功能。
综上,四物汤可降低尾静脉注射STZ诱导的糖尿病小鼠血糖能力,改善海马神经损伤,进而提高小鼠学习记忆水平,其机制与改善神经元结构和功能异常,上调海马组织BDNF 含量及突触相关蛋白PSD95、Shank3、NR1和NR2B表达有关。本实验从神经元和突触结构方面研究四物汤对糖代谢异常引起的学习记忆障碍的改善作用,可为四物汤在AD相关的认知功能障碍中的应用提供实验依据。四物汤对BDNF及其上下游信号通路的调节作用有待进一步研究。

