FoxO转录因子在皮肤创伤修复及瘢痕演变中的作用
孔艳丽,皮龙泉,李莲花,李初颖,金美彤,罗银利,金哲虎
皮肤创伤修复及瘢痕演变是一个高度整合及重叠的过程,依赖于多种细胞、细胞外基质(extracellular matrix, ECM)及生长因子在炎症、血管生成、再上皮化和组织重塑中的相互作用[1]。正常皮肤创伤后血管会立即收缩并凝集血小板,经脱颗粒形成纤维蛋白凝块进行止血[2]。炎症阶段,中性粒细胞最先到达损伤部位,释放白细胞介素-6(interleukin, IL-6)、IL-1β和肿瘤坏死因子-α(tumor necrosis factor, TNF-α)等炎症介质,促进白细胞渗出并增强吞噬作用[3]。创伤部位新生微血管内皮细胞和成纤维细胞侵入凝块,使其收缩形成肉芽组织[4]。角质形成细胞的不断迁移、增殖和分化会覆盖创伤部位启动再上皮化[5]。重塑阶段,炎性巨噬细胞表型(M1型巨噬细胞)转变为抗炎巨噬细胞表型(M2型巨噬细胞),释放蛋白酶并吞噬多余ECM[6]。成纤维细胞转化为α-平滑肌肌动蛋白(α-SMA),增殖并导致ECM沉积[7]。这些修复过程与创伤后瘢痕形成密切相关,见图1。
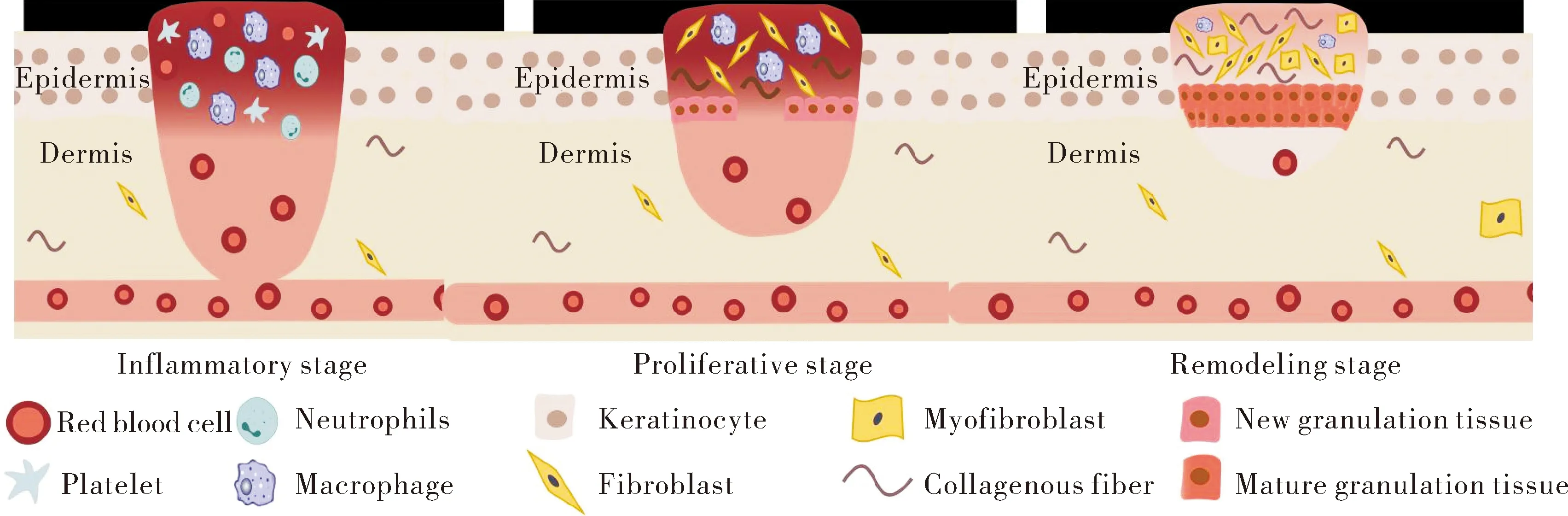
图1 创作修复演进模式图Fig.1 Pattern diagram of evolution during wound healing
叉头框(forkhead box, Fox)转录因子广泛存在于从酵母类到哺乳类的真核生物中,目前研究最深入的是FoxO亚家族[8],因此,本文结合FoxO转录因子的一般生物学特性,着重归纳总结FoxO转录因子在皮肤创伤修复及瘢痕演变中的最新进展。
1 FoxO生物学特性
FoxO是一类具有翼状螺旋结构的转录因子家族,由4个功能结构域组成:①高度保守的DNA结合域(DNA binding domain, DBD);②核输出信号(nuclear output signal, NES);③核定位信号(nuclear localization signal, NLS);④反式激活结构域(trans activated domain, TAD)[9]。目前已发现哺乳动物的4个FoxO基因(FoxO1、FoxO3a、FoxO4和FoxO6)由不同的基因编码,通过调节靶基因的表达,调控下游转录因子的活性[10],研究[11]表明,其在细胞增殖、凋亡、迁移和氧化应激等过程发挥重要作用。FoxO转录因子受翻译后修饰(post-translational modification, PTM) (即磷酸化、乙酰化和甲基化等)的严格调控,通过改变核定位和DNA结合能力决定细胞命运[12]。
现有研究[13]表明,磷酸肌醇3-激酶(phospho-inositide 3-kinase, PI3K)/蛋白激酶B(AKT)/FoxO/哺乳动物雷帕霉素靶蛋白(mTOR)信号通络是控制细胞生长、增殖和新陈代谢的中枢环节。已知细胞周期G1/S转换的负调控因子(p27KIP1/p21WAF1/p130)被FoxO上调,细胞周期蛋白(Cyclin D1/D2)等正调控因子被FoxO抑制[14]。提高增生性瘢痕中CyclinD1的表达量或与细胞周期依赖蛋白激酶(CDK4/6)结合形成复合物,可促进细胞周期和细胞增殖[15]。活性氧(reactive oxygen species, ROS)在创伤修复过程中也发挥着至关重要的作用,氧化还原信号和氧化应激的增强可调控多种信号通路和转录因子的表达,如FoxO、蛋白激酶C(PKC)、c-Jun氨基末端激酶(c-Jun N-terminal kinases, JNK)、p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、核因子κB(nuclear factor-κB, NF-κB)等[16]。其中FoxO3a通过MAPK和JNK修饰凋亡配体促进细胞凋亡[17]。研究[18]表明,ROS中的过氧化氢(H2O2)和超氧化物歧化酶(O2-)能激活FoxO3a,导致成纤维细胞凋亡,是创伤修复的重要调控因子。
2 FoxO与皮肤固有细胞
2.1FoxO对角质形成细胞的作用 角质形成细胞作为再上皮化的效应细胞,通过迁移、增殖和分化的方式恢复表皮形态[19],而细胞增殖是PI3K/AKT信号通路的效应之一,Zhang等[20]研究发现,PI3K/AKT/FoxO信号可以通过磷酸化和抑制FoxO促进细胞存活。进化上保守的胰岛素/胰岛素样生长因子-1(insulin-like growth factor 1, IGF-1)信号通路通过PI3K/AKT诱导FoxO亚型磷酸化,使其从细胞核移位到细胞质,抑制FoxO靶基因的转录,调控细胞增殖和迁移[21]。Kakanj等[22]研究表明,FoxO低表达会促进由胰岛素受体信号传导降低造成的创面的修复。FoxO1特异性缺失会干扰皮肤创面中的角质形成细胞迁移、血管生成和结缔组织再生[23]。
2.2FoxO对成纤维细胞的作用 肉芽组织中成纤维细胞的过度增殖,使组织异常挛缩与纤维化,导致瘢痕形成[24]。研究[25]表明,FoxO1和FoxO3a对多种纤维化效应细胞的激活和凋亡均有调节作用。转化生长因子-β1(transforming growth factor-β1, TGF-β1)通过激活SMAD3、ERK1/2和AKT降低FoxO3a的活性,沉默FoxO3a减弱了TGF-β1调控的心脏成纤维细胞(cardiac fibroblasts, CFs)向心脏肌成纤维细胞(cardiac myo fibrobhsts, CMFs)的转化[26]。此外,Yang等[27]研究表明,PI3K/AKT/FoxO信号传导明显促进了肥厚性瘢痕(hypertrophic scar, HS)的纤维化进展,基因测序显示己酮可可碱(一种黄嘌呤衍生的抗氧化剂)通过该信号通路激活p27KIP1影响HS形成。
3 FoxO与皮肤创伤修复
3.1FoxO与炎症期 炎症阶段释放趋化因子诱导中性粒细胞、巨噬细胞和淋巴细胞等先后进入创伤部位[28]。Lang等[29]研究表明,microRNA-149通过减轻炎症反应,促进伤口无瘢痕愈合。Morris等[30]研究表明,FoxO3a有助于调节免疫系统,其抗炎作用会抑制炎症因子(IL-2/6)的产生。创面浸润的中性粒细胞和巨噬细胞高度表达FoxO1[31],创面细菌可通过诱导Toll样受体2(Toll-like receptors, TLR2)和TLR4改变中性粒细胞中FoxO1的核定位,上调TLR2和TLR4可使FoxO1过表达,并使炎性细胞因子(IL-1和TNF-α)释放增加[32]。β-连环蛋白(β-catenin)和FoxO1是AKT信号多样化的两种关键因素,FoxO1在Ser256残基处的磷酸化诱导其在感染期间的核输出,进而激活AKT,而Wnt通路以AKT依赖性方式独立调节β-catenin,使其以GSK-3β依赖性方式抑制炎症[33],另有研究[34]表明,AKT调节的FoxO能通过上调过氧化氢酶和锰超氧化物歧化酶(Mn superoxide dismutase, MnSOD)编码基因的表达,抑制细胞内ROS水平,改善与衰老相关的进行性肾损伤中的炎症反应。
3.2FoxO与增生期
3.2.1血管再生 血管再生为创伤部位提供新鲜血液,FoxO1、FoxO3和FoxO4三重基因敲除的小鼠,可通过调节血管内皮细胞的形态和血管稳态介质(SPRY2和PBX1)的表达调控血管再生[35]。已知,表皮生长因子(epidermal growth factor, EGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)和血小板衍生生长因子(platelet-derived growth factor, PDGF)是创伤修复过程中的关键趋化因子[36]。Jeon等[37]研究表明,特异性缺失FoxO1的角质形成细胞可降低创伤部位VEGF的表达,并导致血管生成减少,再上皮化和肉芽组织形成受损。沉默信息调节因子1(sirtuin 1, SIRT1)可使FoxO1去乙酰化,而SIRT1缺失的内皮细胞由于FoxO1活性的改变,会表现为异常的血管再生[38]。
3.2.2再上皮化 成功再上皮化依赖于角质形成细胞的增殖和迁移[39]。Miao等[40]研究表明,FoxO1可通过调节抗氧化基因如谷胱甘肽过氧化物酶2(glutathione peroxidase, GPX-2)保护角质形成细胞免受氧化应激的伤害,此外,FoxO1可通过修复GADD45α提高对氧化应激的抵抗力,促进伤口再上皮化[32]。为了确定FoxO1在高血糖条件下的差异性,Zhang等[41]对糖尿病小鼠进行了mRNA分析,证实FoxO1可以上调趋化因子配体20(C-C chemokine ligand 20, CCL20)、丝氨酸蛋白酶抑制剂家族成员B2(serine proteinase inhibitor B2, Serpin B2)和IL-36γ等基因,进而抑制角质形成细胞迁移,导致再上皮化减少,愈合延迟。
3.3FoxO与重塑期 皮肤创伤修复逐渐瘢痕化,与成纤维细胞的过度增殖和ECM的过度沉积密切相关[42]。修复过程中的胶原蛋白主要由成纤维细胞合成并修饰其形态[43]。通过表观遗传学筛选出与瘢痕相关的调控网络发现,调控CCNB1参与FoxO及p53信号通路和细胞周期等过程可探索瘢痕演变的发展机制[44-45]。TGF-β/Smad信号通路的持续激活是瘢痕形成的关键之一[46],而FoxO被TGF-β以非Smad依赖性途径激活,促使CFs向CMFs转化[47]。已有研究[48]表明,通过抑制β-catenin与T细胞因子(T cell factor, TCF)的结合可抑制TGF-β促纤维化作用。Jeon等[49]研究表明,局部应用FoxO1抑制剂可增加胶原重塑、血管再生和肌成纤维细胞的增殖,明显改善了2型糖尿病迷你猪模型中结缔组织的愈合。
4 总结与展望
皮肤创伤与修复过程为瘢痕形成机制的研究提供了良好背景,FoxO作为创伤修复过程中重要的转录因子,通过调控多个转录靶点协调炎症因子、血管再生、再上皮化和组织重塑等过程,直接影响瘢痕的发生与消退,故调控FoxO转录因子可能成为促进创伤修复和预防瘢痕演变的潜在靶点,为未来瘢痕的防治提供新思路新方法。

