A型塞内卡病毒VP2蛋白单抗制备及阻断ELISA方法的建立
田占云,崔 川,李明珠,白若曼,安满鑫,袁万哲,李丽敏
(河北农业大学 动物医学院,河北 保定 071000)
A型塞内卡病毒(Senecavirus A,SVA)又称塞内卡谷病毒(Seneca Valley virus,SVV)[1],是塞内卡病毒(Seneca Valley virus,SVV)属中的唯一成员[2]。SVA是一种单股正链RNA病毒,最初被认为是一种细胞培养基污染物,从被胎牛血清或猪胰蛋白酶污染的PER.C6细胞系中分离获得[3]。该病毒主要感染猪,尤其是新生仔猪[4]。2002年在美国首次发现该病毒,2007年加拿大报道了首例SVA阳性病例[5],2015年是SVA流行病学转折点,巴西多个省暴发SVA疫情[6-8],随后,中国、泰国[9]、哥伦比亚[10]等多个国家出现SVA疫情,给养猪业造成巨大的经济损失。2015年3月我国广东[11]首次暴发SVA,之后河南省[12]、福建省[13]、山东省[14]、四川省[15]等地相继暴发该病,SVA疫情的防控变得至关重要。该病的临床症状与口蹄疫、特发性水疱病不容易区分,给诊断造成了一定难度,因此需要借助实验室相关检测技术进行确定。
酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)因其良好的敏感性、特异性、重复性和稳定性以及快捷、自动化程度高的优势,被广泛应用于临床大批样本的检测。相比间接ELISA, 阻断ELISA有特异性强、稳定性好、准确性高等优点,非常适用于SVA抗体临床检测。抗体介导的体液免疫能有效清除血清中的病原,在抵御感染中发挥着关键性作用。猪只感染SVA后5 d左右体内就会出现中和抗体,到感染后第7天中和抗体水平达到峰值,随着中和抗体水平的增加能有效缓解病毒引起的临床症状,降低血清和组织内病毒滴度,并减少病毒的排放和传播[16-18]。VP2抗原可能比VP1和VP3具有更强的免疫原性,MAGGIOLI等[19]证实VP2蛋白作为4种结构蛋白中氨基酸数目最多的蛋白具有SVA的主要中和表位,VP2蛋白产生的中和抗体在宿主控制SVA病毒血症中发挥着关键作用。而且值得注意的是,针对VP2的特异性IgG抗体一直到感染后的第5周还能被检测到,这相对于VP1、VP3蛋白是无法比拟的优势。DVORAK等[20]证明VP2在ELISA 试验上表现出较高的亲和力,对阳性样品与阴性样品的鉴别能力更强。无论是在机体抵抗SVA感染研究,还是临床疾病诊断和疫苗研发中,VP2都是不可忽略的关键性靶点[21]。
本研究制备SVA VP2单克隆抗体,以单克隆抗体为基础建立检测SVA特异性抗体的阻断ELISA方法,为SVA监测和防控提供技术支撑。
1 材料与方法
1.1 细胞及重组蛋白pET32a(+)-SVA VP2、BHK-21细胞由本实验室保存;SP2/0骨髓瘤细胞由河北农业大学传染病实验室提供。
1.2 主要试剂Montanide IMS 251C VG佐剂为SEPPIC公司产品;辣根过氧化物酶标记的山羊抗鼠IgG、DAB显色液购于北京中杉金桥生物技术有限公司;HAT选择培养基、HT 选择培养基购于Sigma公司;1640培养基、DMEM培养基、胎牛血清购自Gibco公司;TMB显色液购自北京索莱宝科技有限公司;临床猪血清由河北农业大学动物医学院卫检实验室提供。
1.3 McAb的制备及特性鉴定用重组SVA VP2蛋白[21]免疫6~8周龄的BALB/c小鼠,通过颈背部多点皮下注射200 μL(50 μg)抗原,14 d后,以相同剂量,通过相同免疫途径进行第2次免疫,二免后14 d进行第3次免疫,腹腔注射同等剂量VP2蛋白,融合前3 d,直接腹腔注射100 μg VP2蛋白。将获得的免疫脾细胞与SP2/0细胞融合,利用选择性培养基筛选阳性细胞,并对其进行亚克隆。经过多轮亚克隆筛选出稳定分泌抗体的杂交瘤细胞株,采用体内诱生腹水法制备SVA VP2蛋白的单克隆抗体,并对单克隆抗体的效价、亚型以及免疫反应性进行鉴定。
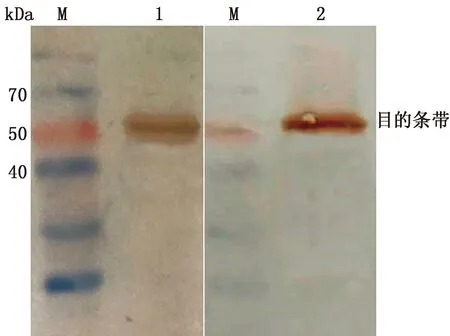
1.4 McAb酶标及质量检测使用戊二醛交联改良二步法对单克隆抗体进行过氧化物酶标记。对制备的酶标抗体进行质量检测,包括酶量、IgG 含量、酶与IgG物质的量的比值及结合率的测定。酶量(g/L)=D403 nm×0.42;IgG量(g/L)=(D280 nm-D403 nm×0.42)×0.94×0.62。辣根过氧化物酶和IgG的相对分子质量分别为40 000和160 000,根据相对分子质量换算摩尔质量并计算酶与IgG物质的量的比值。酶结合率=结合物中的酶量/标记时加入的酶量×100%。
1.5 阻断ELISA反应条件的优化通过棋盘法确定重组VP2蛋白包被质量浓度和McAb的使用浓度。使用直接ELISA法:将纯化好的重组VP2蛋白分别稀释为1.5,2,3,4,6,8,12 mg/L,包被酶标板,每孔100 μL,4℃包被12 h;PBST洗3次,每次3 min,拍干;按照200 μL/孔加含5%胎牛血清的PBST于37℃封闭1 h;同上洗涤,将酶标抗体按400,800,1 600,3 200,6 400,12 800倍比稀释后按100 μL/孔加入酶标板中,37℃温育1 h;按照100 μL/孔加入单组份TMB显色液,37℃避光反应10 min;之后每孔加入100 μL 2 mol/L H2SO4终止显色,读取D450 nm值。取D450 nm值为1左右的可作为抗原包被质量浓度和酶标抗体稀释倍数的最佳组合。
使用以上确定的最佳条件,分别用5%胎牛血清、5%脱脂奶粉、1% BSA和2% BSA进行封闭,取阳性血清和阴性血清,按照1∶1,1∶2,1∶4,1∶8的稀释度稀释后检测,显色时间设置为5,10,15 min,比较阴阳性血清抑制率,确定最佳反应条件。
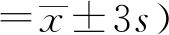
1.7 阻断ELISA特异性及敏感性试验使用优化后的阻断ELISA方法检测猪流行性腹泻病毒(PEDV)、猪繁殖与呼吸障碍综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、SVA抗体阳性猪血清,判定其是否与其他病毒发生交叉反应。
将SVA阳性血清做1∶10,1∶20,1∶40,1∶80,1∶160,1∶320,1∶640倍比稀释,用建立的阻断ELISA方法检测,确定能检测出高于临界值的血清最高稀释度,然后测血清最高稀释倍数中总蛋白含量,判断其敏感性。
1.8 阻断ELISA重复性试验批内重复试验:用同一批次蛋白包被的酶标板按照建立的阻断ELISA条件对10份猪血清样品重复3次检测,测定D450 nm值,并计算抑制率。
批间重复试验:用3个批次蛋白包被的酶标板按照建立的阻断ELISA条件对10份猪血清样品进行检测,测定D450 nm值,并计算抑制率。
1.9 临床血清样品的检测利用建立的阻断ELISA方法和间接免疫荧光(IFA)方法同时对91份临床血清样品进行检测,计算阳性率和阴性率的符合率,评价本研究所建立方法的效果。使用建立的阻断ELISA方法对河北省部分地区372份猪血清样品进行检测,并分析SVA的流行情况。
2 结果
2.1 McAb的鉴定将制备的2株杂交瘤细胞培养上清和相应的腹水进行稀释,如图1所示,应用间接ELISA方法测得 1E9、2D4 两株杂交瘤细胞培养上清效价分别为1∶1 280,1∶5 120。1E9、2D4 腹水效价分别为1∶1 000×56和1∶1 000×55。
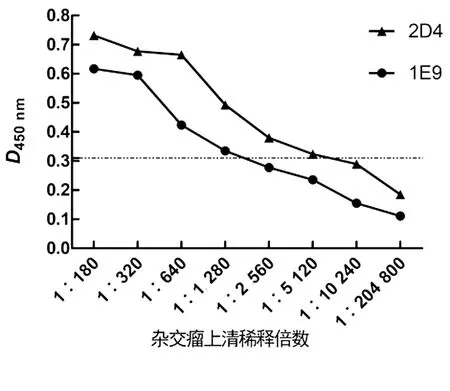
图1 2株单抗杂交瘤上清效价检测结果
2株杂交瘤细胞的培养上清分别与抗IgG1、IgG2a、IgG2b、IgG3、IgA、IgM抗体进行反应,结果如图2所示,2株抗体均与抗IgG1 抗体发生反应,表明1E9、2D4杂交瘤细胞分泌的抗体均为IgG1类。
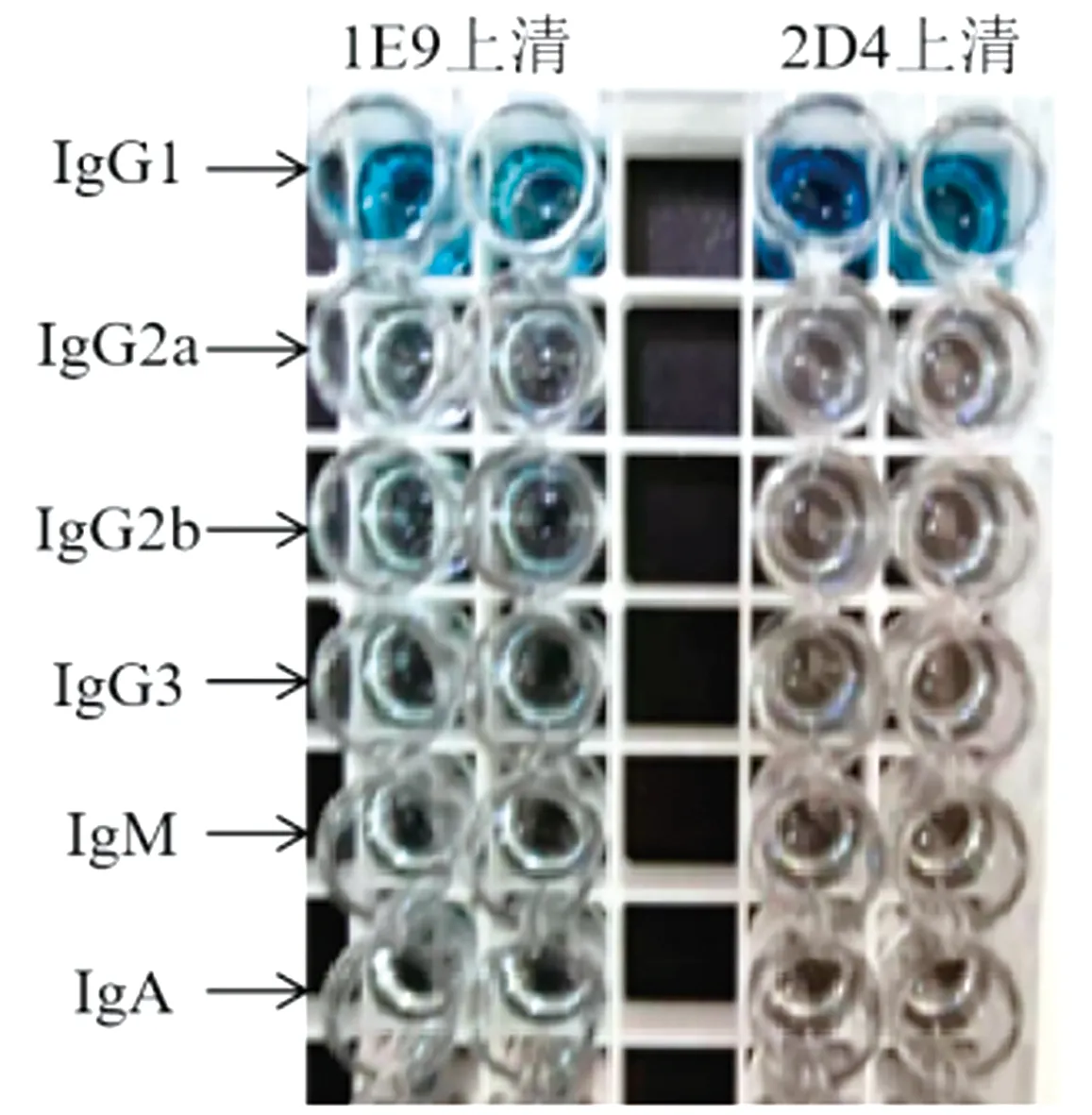
图2 单抗亚类类型鉴定
分别将单抗1E9、2D4与SVA VP2蛋白反应,Western blot结果如图3所示,在50 kDa处出现清晰的特异性条带,说明2株单克隆抗体均能够与VP2蛋白发生特异结合。
M.Blue Plus蛋白Marker;1.1E9;2.2D4
2.2 酶标二抗质量检测将纯化后的2D4单抗进行过氧化物酶标记,酶标后产物测得D280 nm为4.529,D403 nm为2.15,酶结合量为0.84 g/L,酶/IgG物质的量的比为1.57,酶结合率约8.4%。如图4,根据与酶标抗体的各项指标参数比较,综合评判此次酶标抗体质量较好,可以用于 ELISA试验。

图4 酶标抗体结果评价
2.3 阻断ELISA反应条件的优化通过棋盘法使用直接ELISA检测,结果如表1所示,在使用4 mg/L 的包被质量浓度,酶标单抗稀释3 200倍时D450 nm值为1左右,所以以此组合作为ELISA方法中的反应条件。
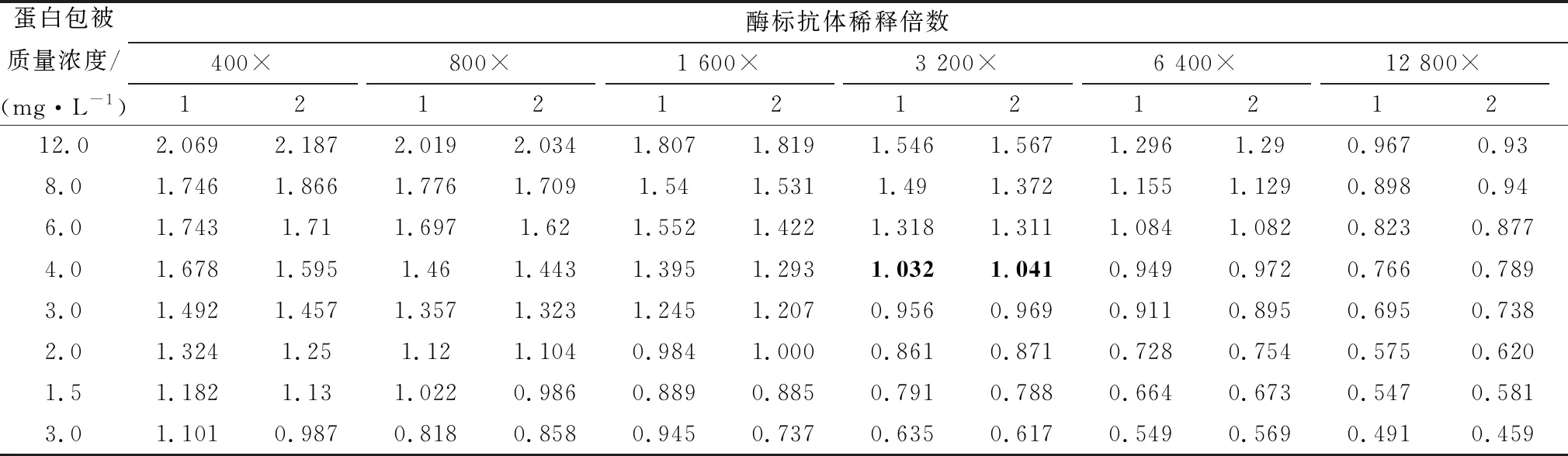
表1 抗原包被质量浓度和酶标抗体稀释倍数方阵与结果 D450 nm值
根据已确定的VP2蛋白和酶标单抗的最佳工作浓度,按ELISA程序先后只改变血清稀释倍数、封闭液、显色时间中的1个条件,通过比较最大抑制率,结果如表2,得到血清的最佳稀释倍数1∶4,1% BSA封闭效果最佳、TMB避光显色10 min效果最好。
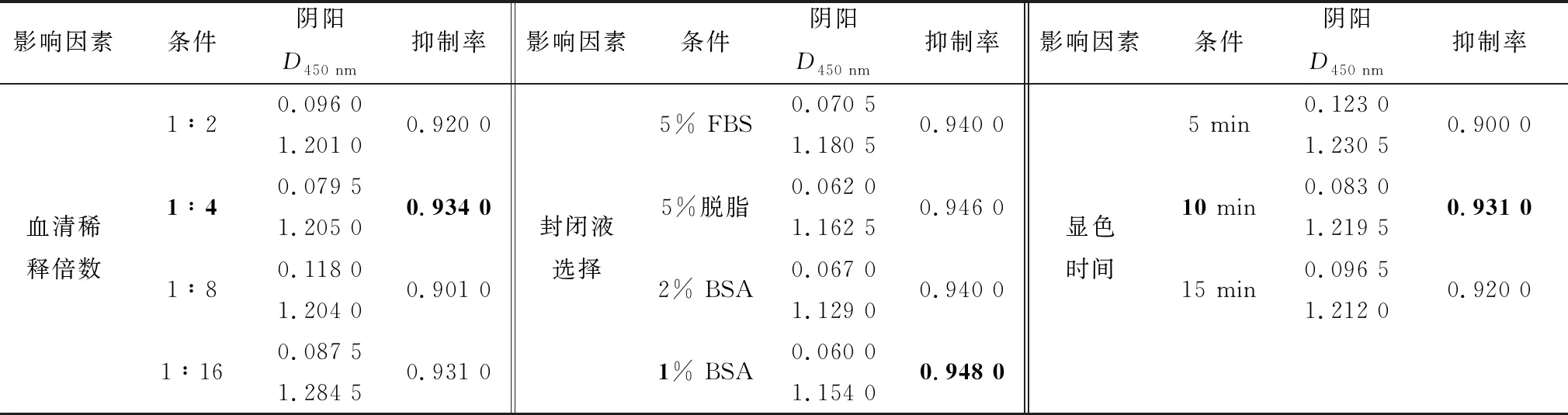
表2 阻断ELISA条件优化结果

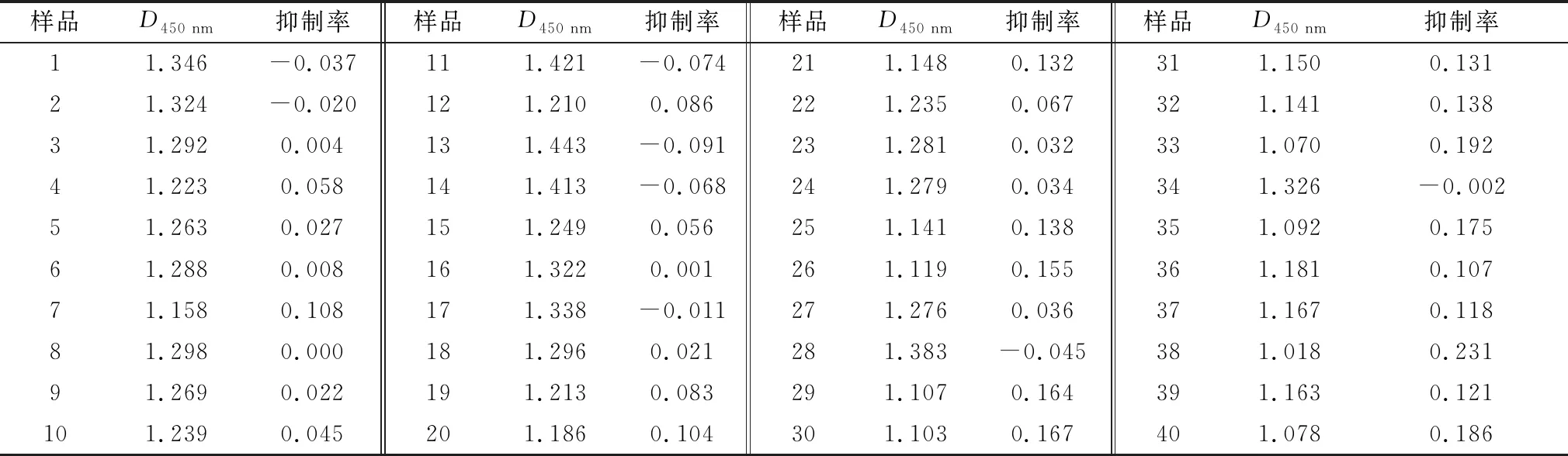
表3 阻断ELISA检测40份阴性血清结果
2.5 特异性及灵敏性检测如图5显示,用建立的阻断ELISA方法检测 PEDV、PRV、PRRSV抗体阳性血清,抑制率均<30%,表明建立的阻断ELISA方法与其他病毒血清不发生交叉反应,具有良好的特异性。
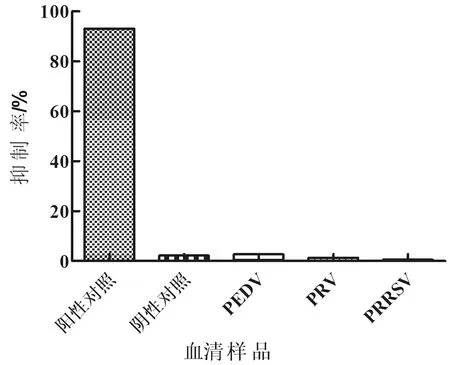
图5 SVA阻断ELISA特异性试验
取已知蛋白浓度SVA抗体阳性血清和阴性血清做倍比稀释,进行灵敏性检测。当1∶160倍稀释时(此稀释倍数下血清中总蛋白质量浓度为0.03 g/L)抑制率<30%,表明建立的阻断ELISA方法最低可以检测到3 μg血清蛋白,灵敏度较高。
2.6 重复性检测使用10个血清样品重复检测3次,再分别包被3个批次蛋白检测3次,如表4,5显示,批内、批间重复试验变异系数均控制在6%以内,符合要求,表明该方法稳定性良好。
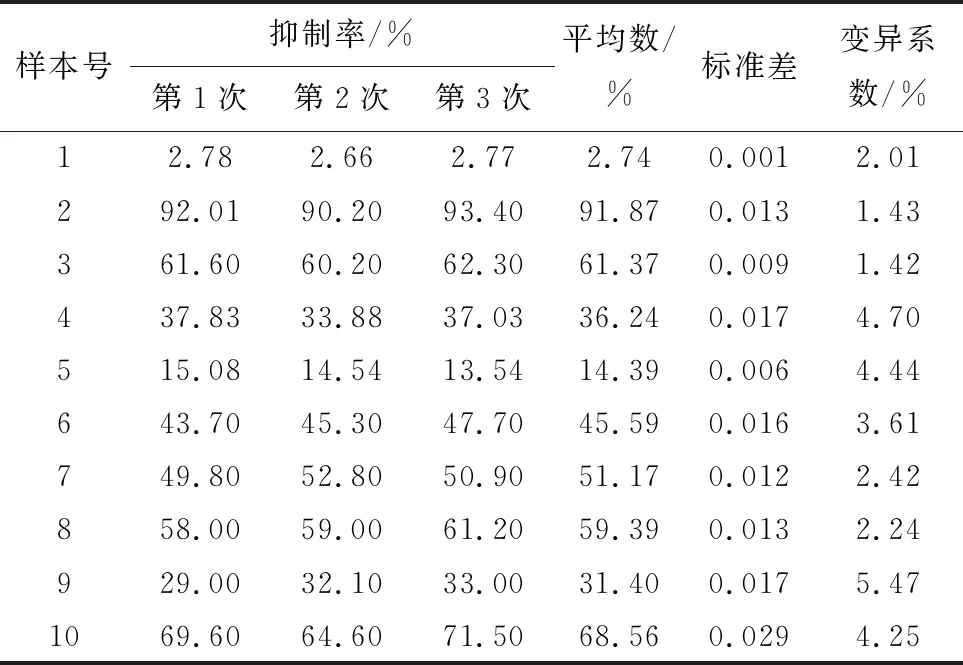
表4 10份血清批内重复结果
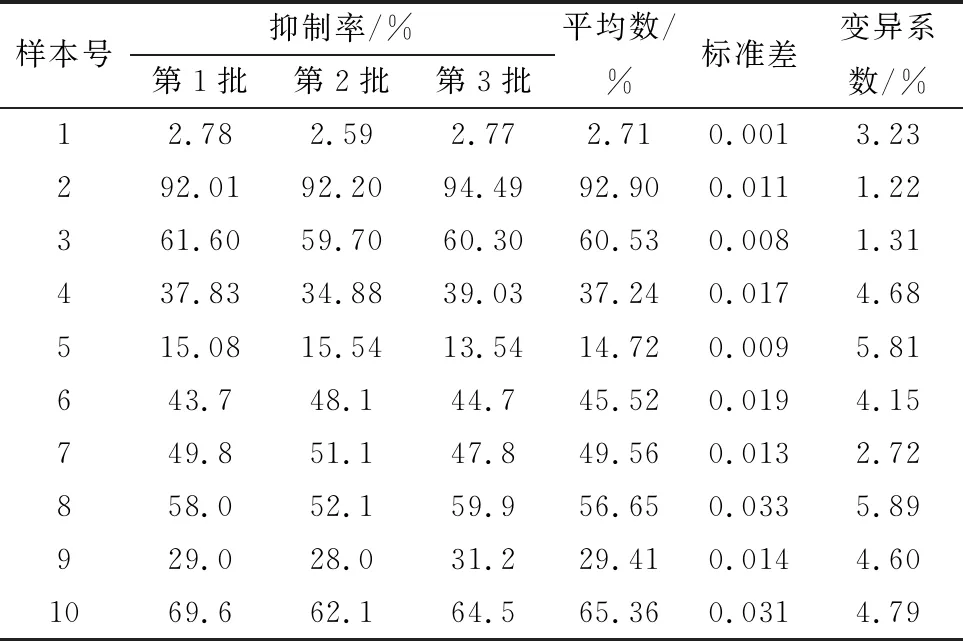
表5 10份血清批间重复结果
2.7 临床血清样品的符合率检测及应用对91份猪血清进行检测,IFA共检测出8份阳性样品,阻断ELISA检测出10份阳性样品,经计算,阳性检出率分别为8.8%(8/91)和11.0%(10/91),阳性符合率为80% (8/10),阴性符合率为97.6% (81/83),总符合率为97.8% (89/91),表明阻断ELISA方法的检测效果较好。
共检测了河北部分地区的372份样品,阳性率为7.8%(29/372),如图6其中保定地区阳性率最高可达16.4%(12/73),邯郸地区14.1%(11/78),沧州地区5.9%(4/68),石家庄地区4.2%(1/24),张家口地区3.0%(1/33),承德地区1.4%(1/71),在邢台(0/15)、衡水地区(0/10)未有阳性检出。在春夏两季发病率比较高,分别为10.9%(6/55)和8.3%(19/227),秋冬两季的检出率分别为5.4%(4/7)和0.0%(0/16)。
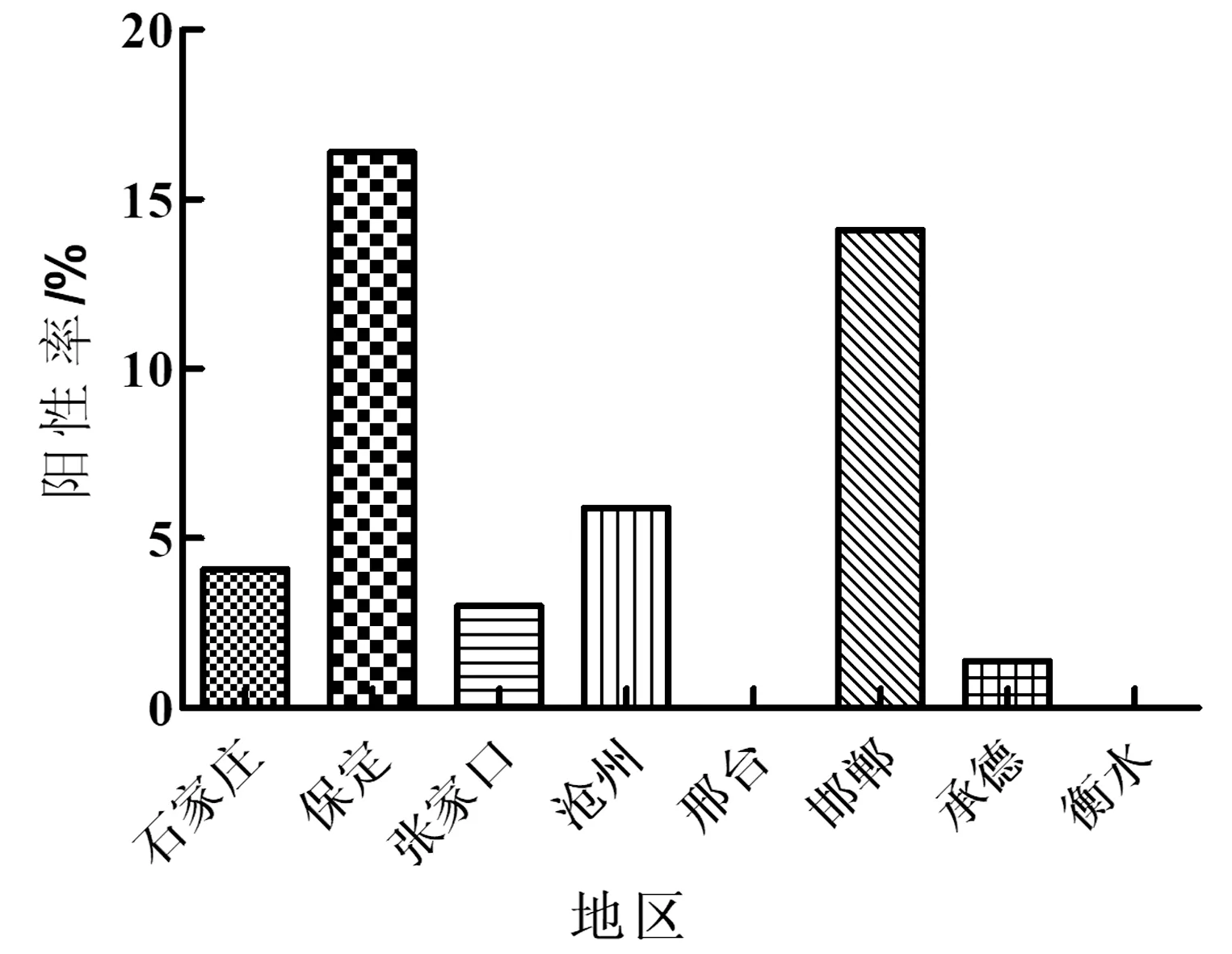
图6 河北部分地区SVA抗体阳性率
3 讨论
目前已建立了多种诊断SVA感染的方法,如聚合酶链式反应(PCR)[24-26]、反转录环介导等温扩增(RT-LAMP)[27-28]、病毒分离培养、病毒中和试验(VNT)[23,29]、间接免疫荧光试验(IFA)[30]、ELISA[23,31]等。有两种主要的诊断方法:竞争ELISA法[32]和各种RT-PCR法[33-40],其中一些方法已被用于临床检测[23,33]。YANG等[41]制备了SVA的单克隆抗体,并利用该抗体建立了竞争性ELISA方法,通过试验证实该方法与中和试验和间接免疫荧光检测结果具有较强的符合度,表明该检测方法适用于SVA血清学检测。目前,灭活病毒和单体蛋白是ELISA程序中检测血清抗体的常用包被抗原。然而,使用完整的病毒作为抗原会带来安全风险,而单体蛋白或多肽的免疫原性相对较差。因此,选择一种既安全又具有高度免疫原性的重组蛋白作为诊断抗原,对新诊断技术的发展至关重要。本研究中使用的包被抗原为原核表达的可溶性VP2,相对于包涵体蛋白在空间结构上更接近于天然蛋白。孙培培等[42]利用VP2单克隆抗体建立了检测SVA的阻断ELISA方法,但其与VNT试验的符合率较低。本研究所建立的阻断ELISA方法与间接ELISA方法的总符合率为97.8%。申珊等[38]建立的检测SVA阻断ELISA方法,与VNT试验检测的符合率为96%,有较高的准确性,但操作过程需加血清样品、单克隆抗体、酶标二抗3个步骤,操作较为繁琐,而本研究将单克隆抗体与酶标记结合,减少了酶标二抗加入这一步骤,在操作上比申珊等[43]建立的方法更为简洁、方便。
阻断ELISA检测方法的优劣与酶标抗体的质量有密切的关系,本试验使用戊二醛作为交联剂与过氧化物酶进行交联,制备酶标抗体,该方法能将过氧化物酶与抗体通过五碳桥的方式进行连接,酶标产物结合稳固且效率较高。本次制备的HRP酶标抗体在酶量、酶结合率、酶标记率等指标上都表现良好,可适用于ELISA和Western blot。在阻断ELISA方法建立过程中分步优化了各种影响因素,且从结果上分析,这些因素对结果的影响不大。河北部分地区的血清样品的检测结果显示,SVA在河北省的分布较广,SVA 很可能在河北省内传播时间较长,需切实加强检疫监管,做好疫情的处置,开展回溯性研究和主动监测等工作刻不容缓。

