蔗糖-6-乙酸酯氯化过程热力学及动力学研究
曹钟亚,孙伟振,许志美,赵 玲,2
(1.华东理工大学化学工程联合国家重点实验室, 上海 200237;2.新疆大学化工学院,乌鲁木齐 830046)
三氯蔗糖(TGS)[1]是目前最具竞争力的人工甜味剂,具有高甜度(蔗糖的600~800 倍)、非营养性、稳定性好等优良性能[2-4]。蔗糖上有8 个羟基,它们的氯代活性依次为6>6’>4>1’>2>3>3’>4’[5]。单基团保护法[6]是目前工业上合成TGS 使用最广泛的方法,即首先选择性酰化以保护6 号位羟基生成蔗糖-6-乙酸酯(S-6-A),继而氯化取代6’、4、1’位上的羟基生成三氯蔗糖-6-乙酸酯(TGS-6-A),最后脱保护基生成TGS[2],其中S-6-A 氯化反应制备TGS-6-A 是TGS生产工艺的关键步骤,该过程需选择性地对6’、4、1’这3 个位置的羟基进行氯化取代,不充分氯代或过度氯代都会使目标产物的收率下降,产生多种氯代副产物,增加后续分离难度[7]。因此氯化试剂的选择以及氯化反应过程的研究对合成TGS 尤为重要。
近年来,国内外对于氯化试剂的研究较多,其中最有竞争力的是Vilsmeier 试剂[8-13]。Vilsmeier 试剂可由SOCl2、PCl3、COCl2等试剂与N,N-二甲基甲酰胺(DMF)反应制得,利用其空间位阻效应可高选择性地氯化取代S-6-A 中6’、4、1’位上的羟基,成为TGS生产工艺中首选的氯化试剂。冷一欣等[12]将SOCl2与DMF 制备的Vilsmeier 试剂滴加至S-6-A 的DMF溶液中,逐步升温完成氯化取代。该方法选择性高,反应过程较为稳定,但缺点是合成的Vilsmeier试剂在工业生产过程中不易保存,遇水激烈反应。Navia等[13]在低温下直接将COCl2滴加至S-6-A 的DMF溶液中,在生成Vilsmeier 试剂过程中同时与S-6-A反应,继而升温氯化取代。该方法简化了实验步骤,但是COCl2剧毒,不利于工业化生产。本文结合上述文献的各自优势,采用“一锅法”在低温下将S-6-A的DMF 溶液滴加至SOCl2与溶剂的混合溶液中,随后升温完成氯代反应。该法避免使用剧毒试剂,使用Vilsmeier 试剂在溶液中边合成边反应,既简化了合成步骤,又提高了安全性。
目前工业上生产TGS 仍以间歇工艺为主,存在操作过程复杂,产能不足,氯代过程不稳定等一系列工程问题。稳定的连续化生产已经成为TGS 生产工艺发展的迫切需求。热力学分析和动力学研究是反应过程开发的重要依据[14-16],通过热力学分析可以判断反应是否可以发生以及反应在理论上可进行的程度[17-19];动力学分析研究外界条件对反应速率的影响,以获得反应影响因素的关键信息,对反应器的设计、开发以及优化有着重要的意义[20-24]。但是,关于氯化反应过程的热力学数据以及动力学参数鲜有相关报道,连续化氯代反应器的设计缺乏重要数据。
基于此,本文采用Benson 基团贡献法估算了S-6-A 氯化反应体系中各物质热力学数据,计算了温度对反应焓变、熵变、Gibbs 自由能变和平衡常数的影响,同时通过间歇实验研究了372~389 K 范围内氯化过程的反应动力学规律。基于反应机理建立了氯化连串反应动力学模型,并通过实验测定和数据回归获得了相应的动力学参数,为TGS 氯化反应器设计及连续化工艺生产提供重要的信息支持。
1 热力学计算方法
S-6-A 的氯化总反应方程式和TGS-6-A 的水解反应方程式分别如式(1)和式(2)所示:
在氯化以及水解反应体系中,由于S-6-A、TGS-6-A、TGS 的热力学数据尚未见公开报道,因此采用基团贡献法对上述3 种物质的热力学数据进行估算。SOCl2、SO2、HCl、H2O、CH3COOH 的基础热力学数据可以直接从物性手册中查阅[25-27]。
1.1 理想气体标准摩尔生成焓、标准摩尔熵和摩尔定压热容
其中,ni代表i基团的数目;各为相应的i基团贡献值;σ 为总对称数,η 为光学异构体数。通过对各物质分子结构的分析可知 S-6-A、TGS-6-A、TGS 的 σ 分别为3、3、1,η 均取1。采用Benson 法分别计算得到S-6-A、TGS-6-A、TGS中各组分的热力学基团贡献值,如表1 所示。通过估算得到各物质的热力学数据,如表2 所示。
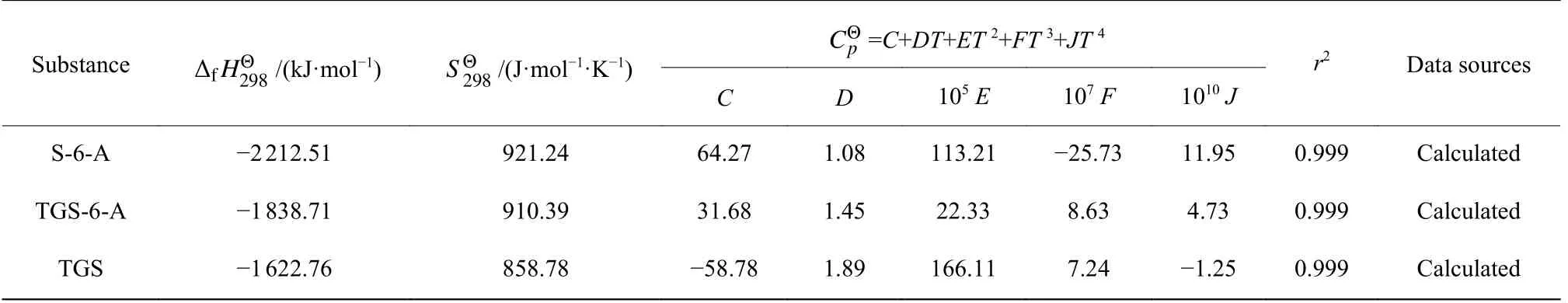
表2 各物质的热力学数据估算结果Table 2 Estimates of thermodynamic data for each substance
1.2 汽化潜热
式中,ΔVHb为正常沸点Tb下物质的汽化潜热;Tc为临界温度,Tr=T/Tc,Tbr=Tb/Tc;n一般取 0.38[30]。ΔVHb、Tb、Tc的计算公式分别如式(7)~(9)所示,其中分别为基团i对蒸发焓的基团贡献值,ΔTbi和 ΔTci分别表示基团i沸点和临界温度的基团贡献值。各物质 ΔVHb、Tb、Tc、ΔVHT的计算结果如表3 所示。
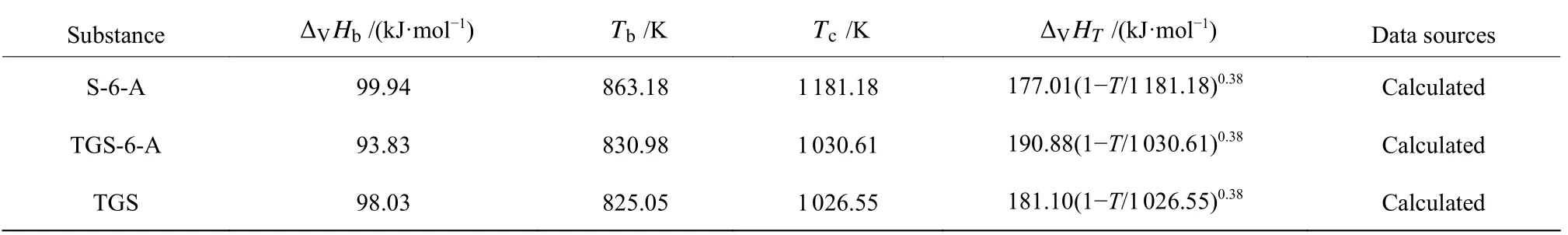
表3 各物质的 ΔVHb ,Tb ,Tc 和 ΔVHT 值Table 3 ΔVHb , Tb , Tc and ΔVHT of each substance
通过上述方法估算水解反应体系中产物乙酸的各项热力学数据,并与文献值[25]进行对比,结果如表4所示。可以看到,计算值与文献值最大相对偏差为5.15%,说明本文采用Benson 法估算的各物质热力学数据是可靠的。
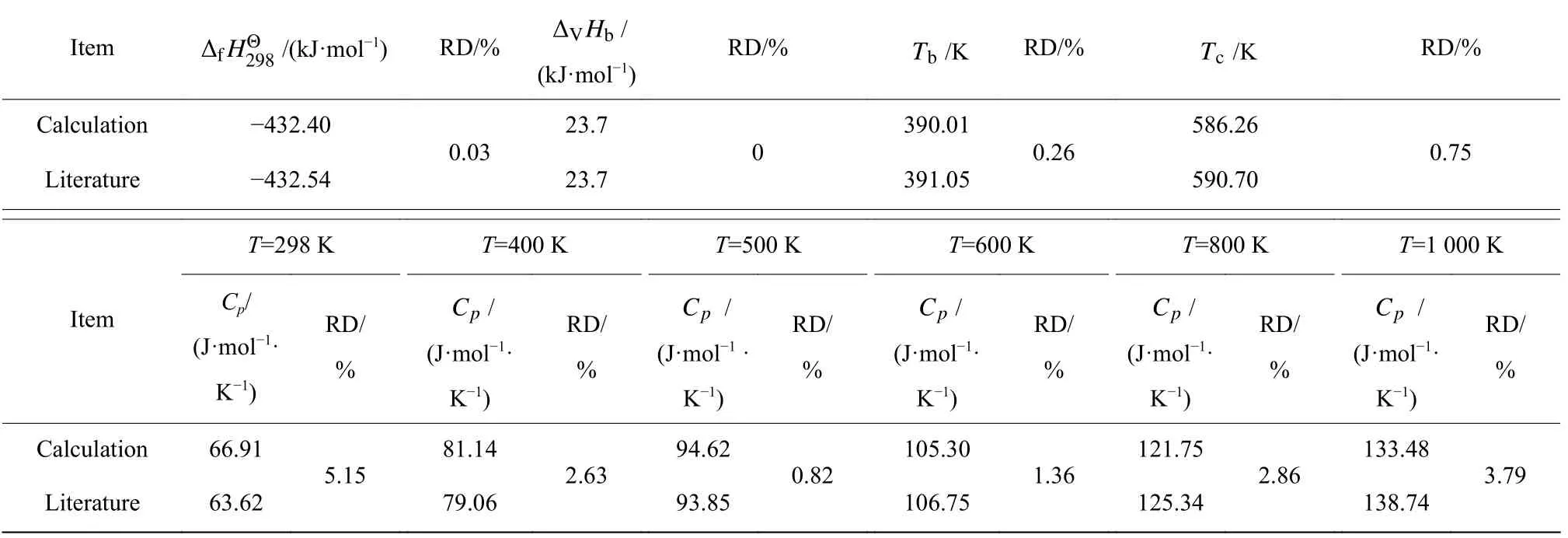
表4 乙酸热力学数据的计算值和文献值[25]的对比Table 4 Comparison of calculation value and literature value[25] of acetic acid
1.3 液态标准摩尔生成焓和标准摩尔熵
1.4 不同温度下的热力学参数
2 实验部分
2.1 试剂
S-6-A 溶于DMF 溶液,化学纯,山东康宝生化科技公司提供;TGS-6-A,分析纯,山东康宝生化科技公司提供;氯化亚砜,分析纯,上海阿拉丁生化科技股份有限公司;1,1,2-三氯乙烷,分析纯,上海泰坦科技股份有限公司;氨水,质量分数25%~28%,北京伊诺凯科技有限公司;盐酸,质量分数8%,上海颖汉化工科技有限公司;甲醇,色谱纯,上海麦克林生化科技有限公司;超纯水,自制。
2.2 实验装置
实验装置如图1 所示。向四口烧瓶内加入一定量的SOCl2以及溶剂1,1,2-三氯乙烷,开启搅拌,于低温恒温槽中降温至0 ℃左右。随后滴加溶有DMF的S-6-A 溶液,在不超过5 ℃下反应1 h。转移至油浴锅中并升温至各指定温度,采用循环水式真空泵控制反应瓶内微负压,并连接二级尾气吸收装置。在达到反应温度后每间隔一段时间取样,并将样品置于低温恒温槽中淬灭反应,经适当处理后进行液相色谱分析。
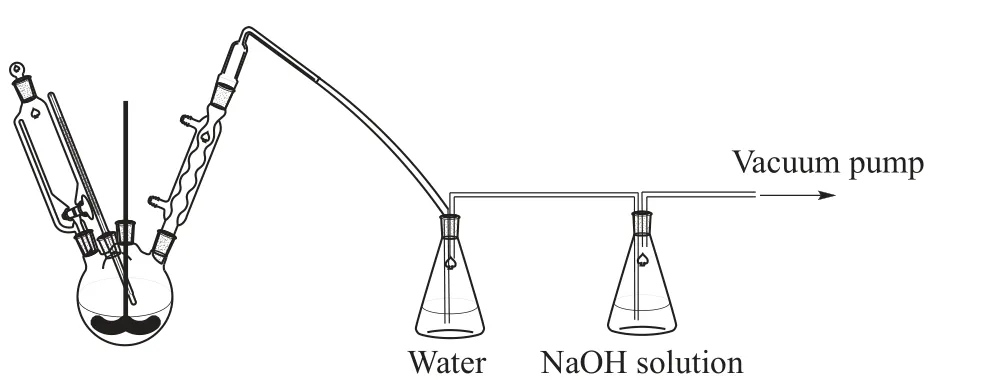
图1 氯化反应装置Fig.1 Experimental setup of chlorination reaction
2.3 分析方法
采用Waters 公司的高效液相色谱仪(HPLC),包括自动进样器、两元泵、真空脱气机、柱温箱以及检测器,外标法定量分析。色谱条件:检测器为Waters 2414示差折光检测器;色谱柱型号为Ultimate AQ~C18;流动相为甲醇与水(体积比45∶55),流速1.0 mL/min,进样量20 μL ;分析时间30 min;柱温箱与检测器温度均为37 ℃;灵敏度设置为16。
3 结果与讨论
3.1 温度对热力学参数的影响
根据式(12)~式(15)进行计算,可以得到不同温度下氯化反应以及水解反应的热力学参数,分别如表5 和表6 所示。
由表6 可以看到,在298 ~388 K 温度范围内,该反应的均大于零,平衡常数从2.45 增加到5.44,说明该反应为吸热的可逆反应,升高温度有助于平衡向正反应移动。为了验证上述热力学计算结果的可靠性,进行了TGS-6-A 水解反应实验,将一定量的TGS-6-A 溶于体积比为1∶1 的甲醇和水混合溶液中,加入w=8%的盐酸溶液作为催化剂,在封闭反应体系中分别探究温度为308 K 以及338 K 下的平衡常数实验值,结果表明平衡常数实验值分别为1.63、2.25。由表6 可知,在该条件下平衡常数计算值分别为2.63、3.36。可以看出,平衡常数实验值与计算值比较接近,表明本文采用基团贡献法进行热力学计算是可靠的。
3.2 动力学模型与参数拟合
根据冷一欣等[31]提出的氯化机理,每个羟基活性的不同导致取代所需的能量不同,即随着温度的升高,氯代反应依次发生,生成一氯、二氯、三氯代物的最适宜温度分别约为343、363、383 K。实验中观察到,当温度升至348 K 时,料液颜色从澄清淡黄色瞬间变成浑浊乳黄色,并放出大量的气体,表明此过程发生了一氯代反应,且较短时间内即可完成反应。然而,现有的分析检测手段以及后处理方式难以实现对一氯代反应产物及时有效的定量分析,因此,以一氯蔗糖-6-乙酸酯为初始反应物,采用面积归一法系统地研究不同温度下各氯代产物的摩尔分数随时间的变化。
当反应温度低于372 K 时,目标产物TGS-6-A 的生成速率较慢,收率较低。而溶剂1,1,2-三氯乙烷的沸点为387 K,当反应温度高于389 K时溶剂挥发较快,导致料液呈现不均匀黏稠状,并且温度过高容易造成料液碳化。综合两方面因素,将动力学考察温度范围设定为372~389 K。整个氯化取代过程可简化为一氯蔗糖-6-乙酸酯(A)依次生成二氯蔗糖-6-乙酸酯(B)、目标产物TGS-6-A(P)以及副产物四氯蔗糖-6-乙酸酯(S),基于以上分析提出了如下氯化连串反应过程,如图2 所示。
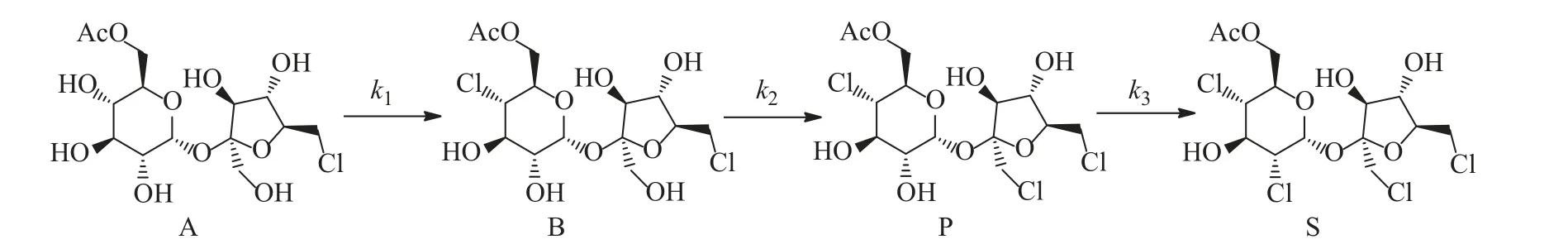
图2 氯化连串反应过程Fig.2 Chlorination series reaction process
根据图2 的反应过程,假设S-6-A 氯化反应为一级连串反应,即k1、k2、k3所对应的反应级数均为1,其动力学模型如式(16)~式(19)所示:
采用均相反应模型、单因素控制变量法,仅研究温度对反应速率常数k的影响,采用MATLAB 中的lsqnonlin 函数,以测量值与计算值的残差平方和S(式(20))最小化为优化目标,结合式(16)~式(19)搜索得到各条件下最优的反应速率常数k1、k2、k3。
不同温度下氯化反应各主要组分摩尔分数拟合图如图3 所示。由MATLAB 拟合得到不同温度下的各反应速率常数k以及置信度为95%时对应的置信区间,如表7 所示,可以看到k1、k2的置信区间比相应的反应速率常数均小1 个数量级,这表明对于主反应的拟合模型参数是可靠的。k3的置信区间相对于k1、k2来说稍大,其原因可能是对氯化过程副产物的简化处理所导致[16]。因为实际反应中,在所考察温度范围内副产物除了四氯酯外还有五氯酯,而且随着反应时间的延长,反应温度的升高均会导致少量物料发生碳化。
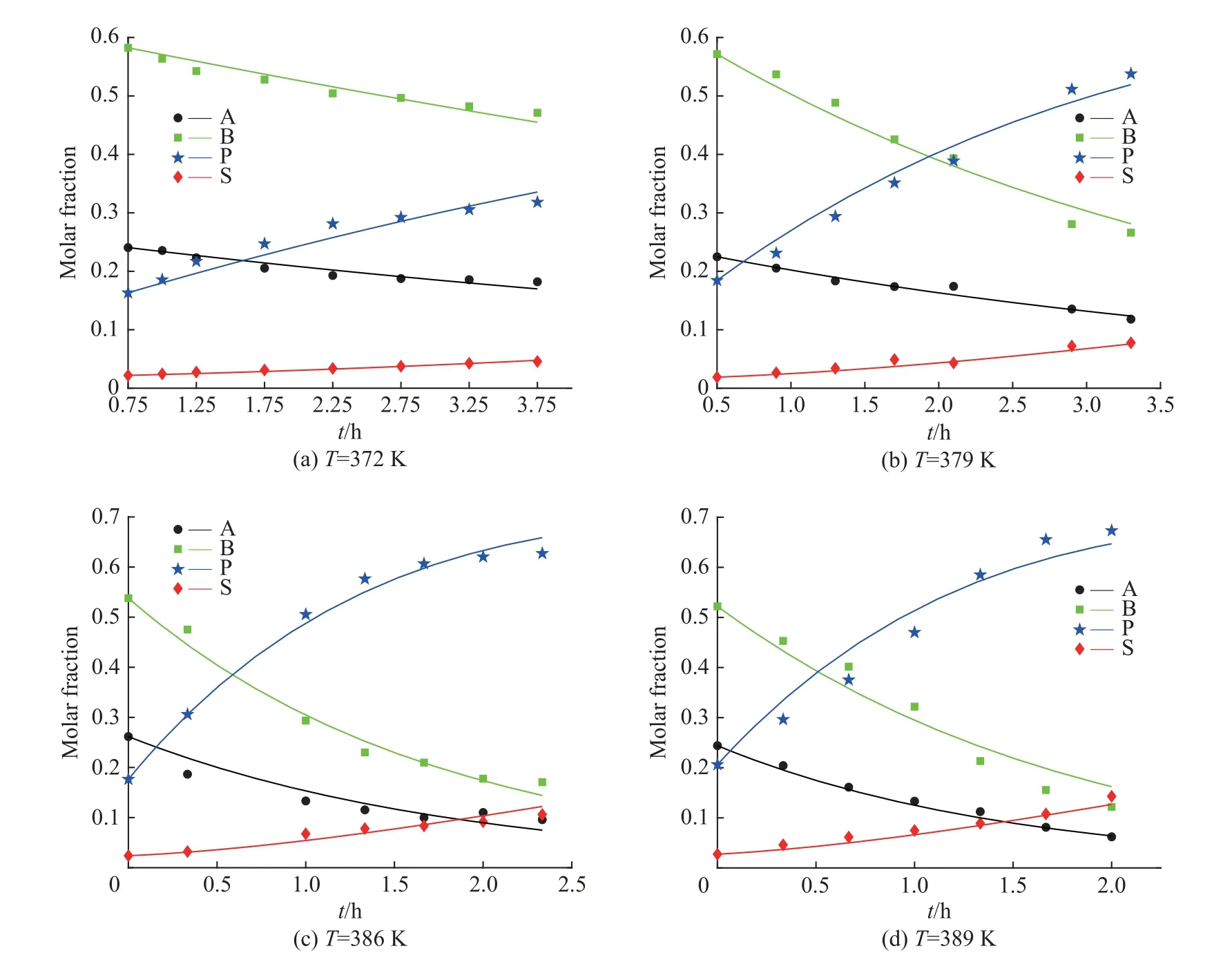
图3 不同温度下氯化反应各组分摩尔分数拟合图(其中点表示实验值,线为模型计算值)Fig.3 Molar fraction curves of components in chlorination reaction under different temperatures (Symbols reprent experimental data; Lines reprent calculated values by kinetic model)
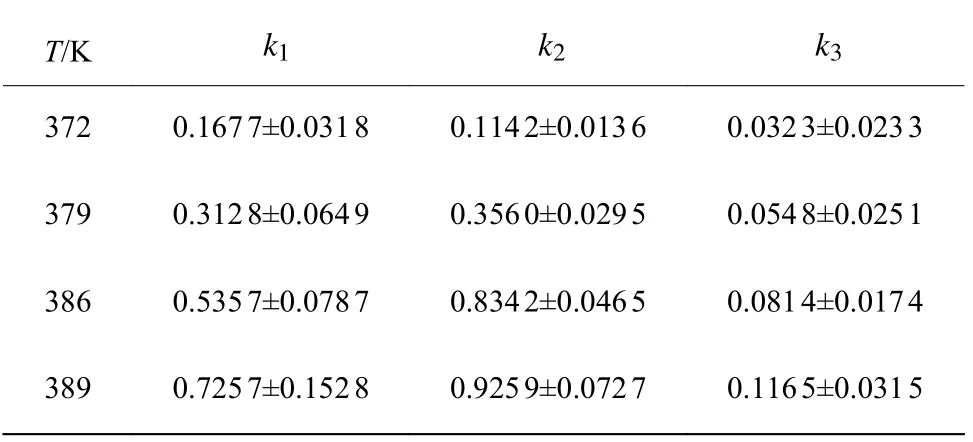
表7 反应速率常数拟合值和置信度为95%时对应的置信区间Table 7 Estimated reaction rate constants and corresponding confidence intervals with the confidence level of 95%
3.3 动力学参数分析
不同温度下各组分摩尔分数的实验值和动力学模型计算值的比较如图4 所示。从图中可以看出不同温度下氯化反应各组分实验值和计算值的点在对角线两侧分布较为均匀,说明以上述实验点为基础拟合得到的反应速率常数是可靠的,可进一步利用Arrhenius 方程计算反应活化能以及指前因子。
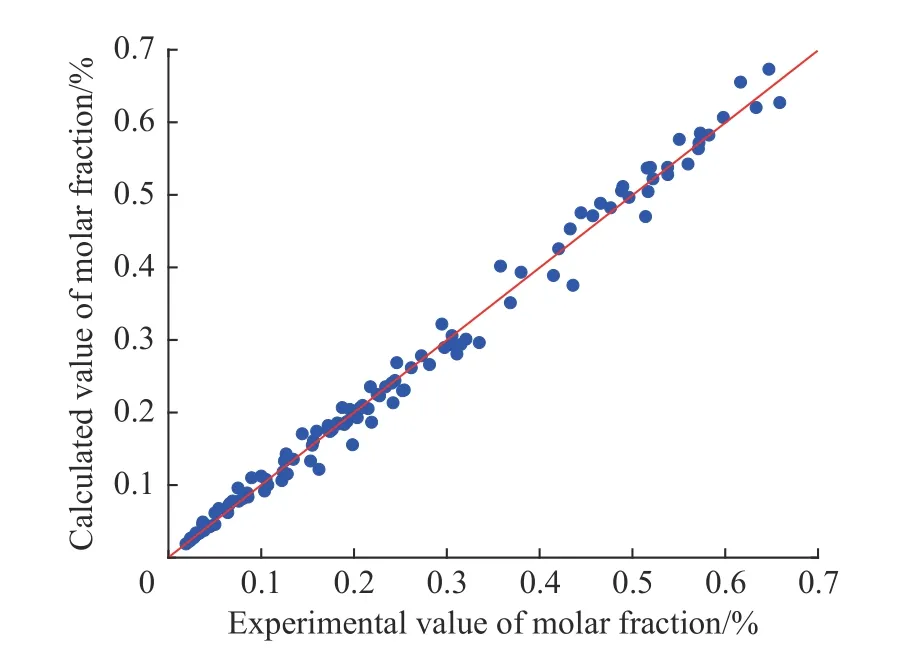
图4 不同温度下氯化反应各组分摩尔分数的实验值和计算值比较Fig.4 Comparison between experimental and calculated molar fraction of components in chlorination reaction under different temperatures
用Arrhenius 方程拟合表7 中不同温度下的反应速率常数k,以 1/T为横坐标,lnk为纵坐标,拟合结果如图5 所示,相关系数r2≥ 0.980,说明假设该氯化串连过程均为拟一级反应是合理的,也进一步说明建立的动力学模型是准确的。
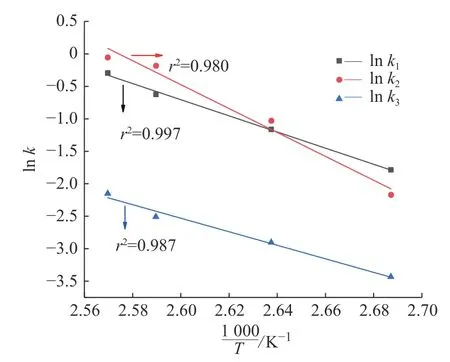
图5 Arrhenius 方程拟合图Fig.5 Fitting plot of Arrhenius equation
通过Arrhenius 方程拟合得到各反应的指前因子k0以及活化能Ea,如表8 所示。可以看到在所研究温度范围内依次生成二氯蔗糖-6-乙酸酯和TGS-6-A 的主反应活化能分别为103.87、153.87 kJ/mol;生成四氯蔗糖-6-乙酸酯副反应的活化能为87.09 kJ/mol,低于主反应活化能。说明主反应受温度的影响更大,升高温度并且缩短反应时间能有效提高目标产物TGS-6-A 的收率。
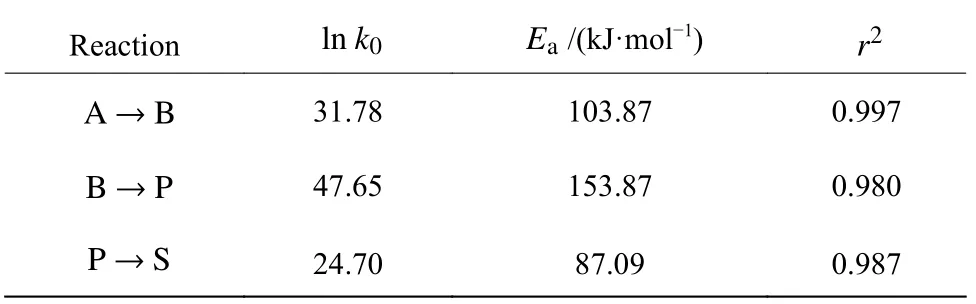
表8 Arrhenius 拟合所得各反应过程的指前因子和活化能Table 8 Pre-factor and activation energy for each reaction fitted by Arrhenius equation
3.4 反应时间对目标产物TGS-6-A 收率的影响
由动力学分析可知,升高温度并缩短反应时间有利于提高目标产物的收率,但由于溶剂1,1,2-三氯乙烷在常压下的沸点为387 K,实验过程中因溶剂回流影响使得继续升高温度存在困难,因此采用单因素控制变量法,维持其他条件相同,仅研究反应温度为389 K 时反应时间对目标产物TGS-6-A 收率的影响,实验结果如图6 所示。从图中可以看到在该温度下最佳反应时间为2.0 h,收率为64.15%,与动力学模型计算值较为接近。
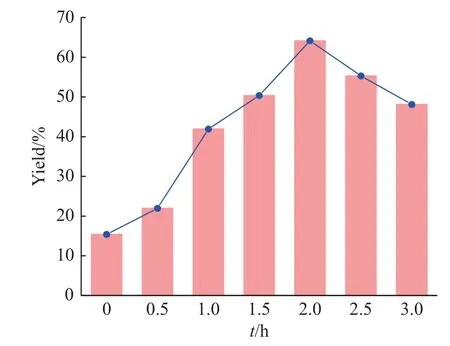
图6 反应时间对TGS-6-A 收率的影响Fig.6 Effect of reaction time on the yield of TGS-6-A
4 结 论
(1)通过基团贡献法估算了S-6-A 氯化反应体系中各物质基础热力学数据,获得了不同温度下的和KΘ,结果表明在所研究温度范围内该反应为放热且不可逆反应。采用相同的方法计算了产物TGS-6-A 水解反应体系,获得了不同温度下的平衡常数计算值,通过平衡常数实验值与计算值的对比验证了热力学计算结果的可靠性。
(2)建立了S-6-A 制备TGS-6-A 氯化连串反应动力学模型,通过实验测定及数据回归获得了372~389 K 下的各动力学参数;依次生成二氯蔗糖-6-乙酸酯和TGS-6-A 的主反应活化能分别为103.87、153.87 kJ/mol,生成四氯蔗糖-6-乙酸酯的副反应活化能为87.09 kJ/mol,表明升高温度并且严格控制反应时间有助于提高目标产物TGS-6-A 的收率,但选择高温度的同时需要注意料液的碳化情况。
符号说明:

