低温贮藏对沂蒙山小冬桃果实采后品质的影响
孙赏 张心梦 王后超 张星 朱文莉 张文娜 刘振宁 徐蒙 戴圣杰


摘要:【目的】探索低温贮藏对“沂蒙山小冬桃”果实品质的影响。【方法】分别研究了其在室温(25℃)和低温(1℃)贮藏条件下果实质地、色泽、部分营养物质和抗氧化物质含量的变化情况。【结果】与对照组(室温贮藏)相比,低温贮藏果实的失水率、出汁率、可溶性固形物含量、过氧化物酶活性及可溶性蛋白含量显著降低;果实硬度、叶绿素、维生素C、可滴定酸的含量显著提高;果实细胞排列更加紧密、饱满,果肉结构完整性更好。“沂蒙山小冬桃”低温贮藏能显著推迟果实的后熟,延长贮藏期。【结论】研究明确了“沂蒙山小冬桃”果实在室温和低温贮藏过程中果实采后生理变化规律,为指导冬桃果实贮藏保鲜以及品质调控研究提供参考依据。
关键词:低温贮藏;沂蒙山小冬桃;冬桃果实;采后品质
桃(Prunuspersica)为原产于我国的核果类果实,属于蔷薇科,李属。桃果实芳香诱人、风味甜香、营养丰富,深受广大消费者喜爱。此外,桃果实富含维生素C、类胡萝卜素、膳食纤维和可溶性蛋白质等营养物质,具有益气养血、预防便秘等功效。
我国桃树品种繁多、成熟期早晚不一,按照成熟时间可分为早熟、中熟和晚熟品种,从5月份持续到11月份。目前,我国桃树品种主要以早熟和中熟为主,易出现熟期集中、销售压力大的问题。因此,扩大晚熟和极晚熟品种面积,适当发展油桃、黄肉桃和制汁等加工专用品种将是我国未来桃树育种的发展方向[1-2]。山东地区冬桃果实成熟期一般在10月中旬到11月中下旬,主要为晚熟和极晚熟桃品种。此时正值水果淡季,可以有效弥补消费者对于新鲜水果的需求。其口感甜脆,肉质鲜嫩,深受广大消费者喜爱。目前冬桃在临沂地区栽培已具一定规模,为临沂地区主要农产品之一。据统计,截至2021年仅郯城县李庄镇已发展冬桃约1200亩,亩均效益达到1万多元。
桃果实属于典型的呼吸跃变型果实,果实采后进入后熟和衰老过程,出现明显的呼吸和乙烯释放高峰,导致果实品质和耐贮性下降[3]。低温贮藏可以有效抑制果实乙烯释放,延长贮藏期、减少果实腐烂劣变,为采后贮藏的主要方式[4]。但桃果实在不当的低温中贮藏易发生冷害,引起果实果肉褐变、木质化或絮状化,风味变淡甚至丧失[5]。
桃果实为冷敏性果实,不同品种桃果实对低温敏感性不同[6]。然而桃果实采后贮藏保鲜相关研究多见于水蜜桃品种(成熟期集中在6-9月),在冬桃品种(晚熟和极晚熟品种)中的研究较少[7-9],该研究以冬桃品种“沂蒙山小冬桃”为研究材料,通过研究其采后贮藏的生理变化规律,探寻适宜冬桃的贮藏方法。本研究将对冬桃果实的提质增效具有重要意义,也将为冬桃果实的采后贮藏保鲜提供參考依据。
1 材料与方法
1.1 试验材料
以晚熟硬肉型桃品种“沂蒙山小冬桃”(以下简称冬桃)为试材,取成熟度为8-9成的果实。
1.2 样品处理
实验处理步骤参照Raffo等[10]。冬桃果实采集自郯城县李庄镇,选择无病虫害、无机械损伤、大小均匀、成熟度一致的果实运送至实验室进行处理。果实均分成两组,分别放置于1℃ 冰柜和室温(25℃)条件下贮藏,并于贮藏的0、3、6、9、12、15、20、25、30、35 天(d)进行相关指标测定。每个处理选取9个桃果实(分成三组)先用于果实横径、纵径、硬度、可溶性固形物、可滴定酸、组织切片和失重率的指标测定,剩余果肉(含果皮)样品切碎后在液氮中快速冷冻保存于-80℃用于维生素C、可溶性蛋白质、叶绿素、类胡萝卜素和过氧化物酶活性等指标的测定。
1.3 测定项目
果实横、纵径利用游标卡尺进行测量,并以纵径/横径来计算果形指数,利用天平称取单果质量,果实失重率(%)=(处理前质量-测定时质量)/处理前质量×100%。果实硬度利用GY-1型大量程水果硬度计测定。可溶性固形物含量利用WYT-80型手持折光仪进行测定。可滴定酸含量参照Ohkawa等[11]的方法利用氢氧化钠进行滴定。维生素C含量参照Uckiah等[12]的方法利用2,6-二氯靛酚滴定法进行滴定。可溶性蛋白质含量测定采用考马斯亮蓝染色法测定。叶绿素和类胡萝卜素含量参照Merzlyak等[13],利用95%乙醇浸提。花青素含量参照Merzlyak等[13]的方法利用HCl进行浸提测定,以OD530值为0.10时花色素浓度为1个单位。过氧化氢酶活性参照石鹏等[14]的方法进行测定。过氧化物酶活性、褐变指数和出汁率参考单体敏等[15]的方法进行测定。每个处理设3个重复,结果取平均值。
桃果肉组织切片步骤参照Dai等[16]。随机选取大小均匀、成熟度一致的3个冬桃果实,切取果实赤道部位的果皮,并利用FAA固定液固定,再经过一系列的脱水和浸蜡后进行包埋。利用石蜡切片机进行切片,厚度为8-10μm,利用铁矾-苏木精染法进行切片染色,随后在光学显微镜下观察果皮果肉显微结构。
1.4 数据分析
利用SPSS 16.0软件进行方差分析,并进行Duancan多重比较,P<0.05为差异显著,使用DPS计算在5%水平上的最小显著性差异,以LSD0.05表示;果实横径、纵径、果形指数和单果质量指标(表1)分析采用DPS软件中单因素试验统计分析Duncan新复极差法进行差异分析。
2 结果与分析
2.1 不同贮藏温度对冬桃果实形态指标的影响
如表1,在室温(25℃)条件下贮藏的冬桃果实在贮藏0d时,其横径为57.83mm,纵径为55.33mm,果形指数为0.96。贮藏3d的果实其横径为50.50mm,纵径为45.67mm,果形指数为0.91。随着贮藏时间的增加,果实的横、纵径逐渐缩小,到12d时,果实的横径变为38.67mm,纵径变为36.00mm;而果形指数为0.93,基本保持不变。
而在低温(1℃)条件下贮藏的冬桃果实在贮藏0d时,其横径为59.33mm,纵径为57.00mm,果形指数为0.96。贮藏3d的果实,其横径为57.33mm,纵径为54.67mm,果形指数为0.99。随着贮藏时间的增加,到12d时,果实的横径为52.00mm,纵径为50.00mm,果形指数为0.96。可以看出,低温条件下贮藏的冬桃果实,其横、纵径也在不断缩小,但是,与室温条件贮藏的冬桃果实相比,低温下贮藏的冬桃果实其横、纵径的缩小速度更加缓慢。
室温贮藏0d的冬桃果实单果质量为75.03g,随着贮藏时间的增加单果质量显著减小,从3d的65.93g,到6d 的47.71g,再到9d的36.16g,最终在12d时单果质量减小为26.14g。果实的失重率从3d的16.24%开始显著增加,到25d时达到79.72%,此后直到35d基本保持不變(图1)。
而在低温条件下贮藏0d时冬桃的单果质量76.12g,此后随着贮藏时间的增加单果质量也在减小,从贮藏3d在74.26g,到6d的73.24g,再到9d的71.88g,最终在12d时单果重减小到70.09g。从表1的数据中,可以看到低温贮藏的冬桃果实其单果质量尽管也在不断减小,但是与室温贮藏相比,1℃条件下单果质量的减小更加缓慢,果实的失重率也可以说明这一点。低温贮藏的冬桃果实,3d时果实失重率仅为1.07%,此后缓慢增加,到35d时为33.07%(见图1)。
以上可以看出,在室温条件下贮藏,冬桃果实损耗更快,更快失去商品价值;而低温贮藏能显著减缓冬桃果实的失重率、能更好地保持冬桃果实的形态,延长其货架期。
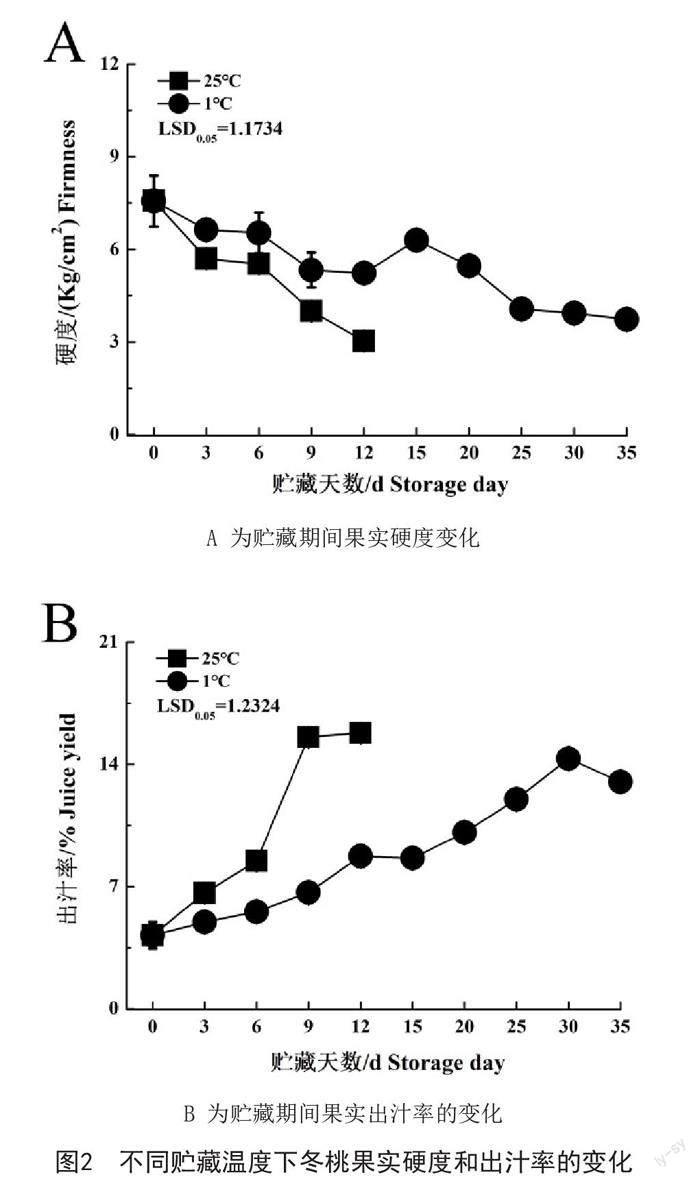
2.2 不同贮藏温度对冬桃果实硬度和出汁率的影响
如图2A所示,室温贮藏0d的冬桃果实硬度为7.90kg/cm2,随着贮藏时间的延长,果实硬度显著下降,到12d时果实硬度降低为3.03kg/cm2,而到了15d往后果实的硬度开始反弹,可能是因缩水严重导致,因此,15d后的果实已经失去商品价值。然而,低温条件下贮藏的冬桃果实从0d开始到35d果实硬度也是逐渐降低,但是明显看出,果实硬度的降低速度明显放缓,即果实软化的速率变慢。
如图2B所示,果实贮藏期间会进一步后熟,果实逐渐软化,出汁率亦会呈现出相应的变化。室温贮藏条件下冬桃果实的出汁率从0d的4.21%,到9d时增加至15.57%,到12d时基本保持不变,这与果实硬度的变化大体呈相反的趋势。而低温条件下贮藏的冬桃果实随着贮藏时间的延长,其出汁率亦逐渐增加,但是与室温贮藏相比,出汁率的增加显著放缓。
2.3 不同贮藏温度对冬桃果实显微结构的影响
A和B为贮藏0天;C和D为贮藏3天;E和F为贮藏6天;G和H为贮藏9天;I和J为贮藏12天的果肉组织切片;A、C、E、G和I低温贮藏;B、D、F、H和J为室温贮藏。A图标尺为200μm,其他标尺为50μm。
果实的硬度与果实细胞的形态、细胞间隙及细胞壁的结构有着密切的关系。取不同贮藏条件下的冬桃果实赤道部位的组织,进行显微学观察。结果显示,0d贮藏的冬桃果实,果肉细胞排列紧密、整齐,细胞壁清晰、厚实(图3A和3B)。贮藏3d,室温贮藏的冬桃果实细胞壁开始出现部分降解,果皮部位尤为显著(图3D);而低温贮藏的冬桃果实与0d贮藏的果实之间没有显著变化(图3C)。随着贮藏时间的延长,6d时室温贮藏的冬桃果实细胞壁进一步降解,细胞出现大量间隙(图3F),而低温下贮藏的果实变化不大(图3,E)。到9d室温贮藏的冬桃果实细胞间隙进一步扩大,细胞壁降解进一步加剧(图3H);而低温下贮藏的冬桃果实开始出现轻微的细胞壁降解(图3G)。到12d 时,由于果实失重严重,细胞之间排列出现拥挤,出现皱缩,细胞排列出现混乱,细胞形态难以分清(图3J)。这与前面果实横纵径的减小、果实失重率的增加等变化相对应。而低温条件下贮藏的冬桃果实细胞结构仅出现轻微的细胞壁降解(图3I)。
2.4 不同贮藏温度对冬桃果实着色的影响
冬桃果实贮藏期间,叶绿素和花青素的含量亦随着果实的后熟而发生着规律的变化。贮藏3d开始冬桃果实的叶绿素开始降低,此后随着贮藏时间的延长叶绿素的含量逐步降低。但是不同的是,室温贮藏的冬桃果实中叶绿素含量要显著低于低温条件贮藏的冬桃果实。到贮藏9d时,室温贮藏的冬桃果实的叶绿素含量为4.67mg/g,而低温贮藏的冬桃果实叶绿素含量为7.10mg/g(图4A)。到贮藏的12d,差距进一步扩大,室温贮藏的冬桃果实叶绿素含量为3.73mg/g,而低温贮藏的冬桃果实叶绿素含量为6.63mg/g(图4A)。从变化趋势上来看,与室温贮藏相比,低温条件下贮藏的冬桃果实叶绿素含量的降低速度显著放缓。
贮藏期间冬桃果实内花青素含量的变化则与叶绿素的变化趋势呈相反的关系。从贮藏的3d开始,室温贮藏的冬桃果实花青素含量为3.57mg/g,低温贮藏的冬桃果实花青素含量为2.83mg/g(图4B)。此后,随着贮藏时间的延长,两种贮藏条件的冬桃果实内花青素的含量皆缓慢增加。到贮藏12d时,室温贮藏的冬桃果实花青素含量为3.78mg/g,而低温贮藏的冬桃果实花青素含量仅为3.23mg/g(图4B)。从变化趋势上来看,与室温贮藏相比,低温贮藏的冬桃果实花青素含量的增加速度显著放缓。
2.5 不同贮藏温度对冬桃果实可溶性糖、酸及蛋白的影响
室温贮藏期间冬桃果实内可溶性固形物的含量逐渐增加,到贮藏9d时达到最大值24.40%,低温贮藏期间的冬桃果实可溶性固形物的含量也在逐渐增加。不同的是,低温贮藏的冬桃果实可溶性固形物的含量要显著低于室温贮藏的冬桃果实(图5A)。从变化趋势来看,与室温贮藏相比,低温贮藏的可溶性固形物的增加速度显著放缓。
可溶性蛋白含量的变化表现出与可溶性固形物含量相似的变化趋势。从贮藏3d开始,室温贮藏的冬桃果实可溶性蛋白含量开始增加,到9d时达到最大值0.30mg/g(图5B)。而低温贮藏的冬桃果实可溶性蛋白含量亦逐步增加,只不过从变化趋势上看,增加的速度显著放缓,到贮藏25d才达到最大值0.33mg/g(图5B)。
而贮藏期间可滴定酸含量则表现出与以上三者相反的变化趋势。在贮藏的3d,室温贮藏的冬桃果实内可滴定酸含量就显著降低,随着贮藏时间的延长,进一步降低(图5C)。低温贮藏的冬桃果实可滴定酸含量亦逐步降低,但是不同的是,其降低的速率显著放缓。
2.6 不同贮藏温度对冬桃果实抗氧化物质的影响
桃果实贮藏期间的抗氧化性,严重影响贮藏果实的品质,桃果实的褐变会造成果实腐烂。为此,我们调查了贮藏期间冬桃果实的褐变指数、维生素C含量、过氧化氢酶和过氧化物酶的活性。果实衰老及冷害均会出现果肉褐变現象,结果显示,室温贮藏的冬桃果实,在贮藏3d就迅速发生了果肉褐变,随着贮藏时间的延长,褐变进一步加剧。而低温贮藏的冬桃果实虽然也发生了褐变,但是从数据看,低温贮藏的冬桃果实褐变的发生显著减轻,该结果与对深州蜜桃和枇杷等果实中的研究一致(图6A)。
维生素C既是桃果实中重要的营养物质,又是一种有效的抗氧化物质,其含量可在一定程度上反映出桃果实所处环境的氧化程度。室温贮藏期间,维生素C的含量逐步降低,而低温贮藏的冬桃果实虽然维生素C的含量也在逐步降低,但是数据显示,其降低的速率显著放缓(图6B)。
过氧化氢酶和过氧化物酶是植物体内重要的两种保护酶,帮助植物缓解、抵抗不良的氧化环境。我们的结果显示,贮藏期间两种条件下的冬桃果实内过氧化氢酶的活性皆逐步降低,只是低温贮藏的冬桃果实过氧化氢酶活性的降低速度显著放缓(图6C)。
而过氧化物酶的活性则表现出不同的变化趋势,室温贮藏期间冬桃果实内过氧化物酶活性从0d开始逐步降低,到6d时达到最低值,之后逐步上升。低温贮藏的冬桃果实也表现出相似的变化趋势,从贮藏的0d开始逐步降低,到贮藏的6d达到最低值,之后逐步上升,到贮藏 20d达到最大值,之后缓慢降低(图6D)。
3 讨论
质地是决定果实品质的重要因素,与果实耐贮性密切相关。苹果、桃和梨等呼吸跃变型果实采后发生后熟软化现象,即出汁率逐渐升高、硬度逐渐下降等,采后低温贮藏可延缓该进程[17-19]。本研究发现相较于室温贮藏,低温贮藏的沂蒙冬桃果实也可延缓出汁率与果实硬度的降低,与上述结论基本一致。一般认为,果实采后软化主要原因是由于细胞壁中不溶性的原果胶降解为可溶性果胶、果胶酸等,使细胞壁变得松弛,细胞间隙增多。Zhu等[20]认为1-MCP处理可通过调控细胞壁物质粗纤维和果胶的降解从而延缓果实硬度的下降。此外,果实中不溶性淀粉降解为可溶性糖也被认为是果实采后软化的重要原因。Chen等[21]研究认为红阳猕猴桃采后果实软化与淀降的解密切相关。乙烯通过淀粉颗粒磷酸化从而加速淀粉降解和果实软化,1-MCP通过抑制葡聚糖聚合物脱支从而延缓果实软化。结合本研究中冬桃果肉组织切片和失水率的数据,我们推测低温贮藏通过推迟冬桃果肉细胞壁的降解进程从而延缓其采后软化。此外,低温环境也可降低果实呼吸和蒸腾速率,延缓细胞因失水皱缩引起的细胞间隙扩大。
果实色泽是水果的重要外观品质,是影响顾客选择的重要因素。桃果实色泽变化主要由叶绿素、花青素、类胡萝卜素等色素共同决定。桃果肉色泽变化的研究在多见于果实发育时期,采后贮藏时期的研究报道相对较少[22-24]。本研究结果表明,室温和低温贮藏条件下沂蒙小冬桃叶绿素含量持续降低,花青素含量持续升高,低温贮藏可延缓该变化。推测由于冬桃果实室温下发生快速的后熟软化,导致叶绿素含量降低、花青素含量升高,而低温贮藏可有效延缓果实后熟软化,其色泽变化也相应得到延缓。
果实在采后贮藏过程中可溶性糖、有机酸和可溶性蛋白等营养物质也发生明显变化。蔡冲等[25]研究发现枇杷果实采后常温贮藏期间可溶性糖和有机酸含量减少,低温贮藏可延缓可溶性糖和有机酸的降低。金微微等[26]研究发现软溶质蜜桃果实‘玉露在低温贮藏(8℃、5℃、0℃和LTC处理)30d后转货架2d,可溶性糖和有机酸含量均趋下降,其中5℃处理果实可溶性糖含量下降最多。本研究发现,室温贮藏的冬桃果实可溶性固形物含量在前9d迅速升高,之后开始下降。而低温贮藏条件下可溶性固形物含量缓慢持续升高。室温和低温采后贮藏过程中可滴定酸都持续下降,但低温贮藏可延缓该下降趋势。该变化与金微微等[26]的结论略有差异,推测可能由于冬桃果实的品种差异或成熟度差异导致。
低温可有效减缓果实采后营养物质的消耗,延长货架期。但是采后不适宜的低温导致桃果实易发生冷害[27]。有研究指出,褐变指数、维生素C含量、过氧化物酶(POD)和过氧化氢酶(CAT)活性与果实抗逆密切相关。POD与CAT二者之间可以相互配合,清除植物体内过剩的自由基,是植物在逆境条件下酶促防御系统的关键酶[28]。目前研究普遍认为多酚氧化酶(PPO)、POD在采后果实褐变中起关键性作用[29]。Pasquariello等[30]研究发现壳聚糖处理可通过抑制PPO和POD酶活性,防止果肉褐变,延长甜樱桃果实的贮藏时间。Zhang[31]研究发现壳聚糖和一氧化碳配合使用可明显抑制低温对PPO和POD酶活性的诱导,从而延缓桃果实褐变。本研究结果表明沂蒙山小冬桃在采后室温贮藏后第3天已经开始发生果肉褐变,而低温贮藏可明显延缓果实褐变。沂蒙山小冬桃褐变指数的变化与武倩[32]和蔡冲等[25]对采后深州蜜桃和枇杷的研究结果一致。采后低温贮藏的沂蒙冬桃果实中POD酶活性与褐变程度明显低于室温贮藏,表明POD酶可能参与采后沂蒙小冬桃褐变进程。果实采后室温贮藏过程中维生素C含量和CAT活性逐渐降低,1℃低温可延缓采后桃果实维生素C的分解和CAT活性的降低。
4 结论
本研究结果表明,与室温贮藏相比,1℃低温贮藏通过延缓采后桃果实的软化进程、营养物质的降解与果实褐变,较好地保持了果实品质。因此,1℃低温条件更适宜沂蒙山小冬桃采后贮藏,但是是否还有更加有效的贮藏方式仍待探究。
参考文献
[1] 王志刚,于彩云,马明兴,等.山东省桃产业的现状与对策建议[J].落叶果树,2015,47(2):16-18.
[2] 马骥.中国桃产业发展研究[M].北京:中国农业出版社,2012.
[3] RICHARDSON A C,BOLDINGH H L,MCATEE P A,et al. Fruit development of the diploid kiwifruit,Actinidia chinensis Hort16A[J]. BMC Plant Biology,2011,11(1):182.
[4] 王艳颖,胡文忠,刘程惠,等.低温贮藏引起果蔬冷害的研究进展[J].食品科技,2010,35(1):72-75+80.
[5] ZHOU H,SU M,YE Z,et al. Advances in the research into physiological and biochemical characteristics and chilling injury of peach fruits after harvest[J].Journal of Fruit Science,2017,34(9):1204-1212.
[6] 祝美云,党建磊,梁丽松,等.低温条件下不同品种桃果实的耐藏性差异研究[J].食品科学,2012,33(8):289-295.
[7] WANG Q,WEI Y Y,CHEN X Y,et al. Postharvest strategy combining maturity and storage temperature for 1‐mcp‐treated peach fruit[J].Journal of Food Processing and Preservation,2020,44(4):1-12.
[8] JIAO W X,SHU C,LI X X,et al. Preparation of a chitosan-chlorogenic acid conjugate and its application as edible coating in postharvest preservation of peach fruit[J].Postharvest Biology and Technology,2019,154:129-136.
[9] CAO S F,SHAO J R,SHI L Y,et al. Melatonin increases chilling tolerance in postharvest peach fruit by alleviating oxidative damage[J].Scientific Reports,2018,8(1):806.
[10] RAFFO A,NARDO N,TABILIO M R,et,al. Effects of cold storage on aroma compounds of white-and yellow-fleshed peaches[J].European Food Research and Technology,2008,226(6):1503-1512.
[11] OHKAWA W,KANAYAMA Y,CHIBA E,et al. Changes in sugar,titratableacidity,and ascorbic acid content during fruit development in sea buckthorn(Hippophae rhamnoides L.)[J].Journal of the Japanese Society for Horticultural Science,2009,78(3):288-293.
[12] UCKIAH A,GOBURDHUN D,RUGGOO A.Vitamin c content during processing and storage of pineapple[J].Nutrition & Food Science,2009,39(4):398-412.
[13] MERZLYAK M N,SOLOVCHENKO A E,GITELSON A A. Reflectance spectral features and non-destructive estimation of chlorophyll,carotenoid and anthocyanin content in apple fruit[J].Postharvest Biology & Technology,2003,27(2):197-211.
[14] 石鵬,王永,张大鹏.油棕果实发育及中果皮内含物含量和抗氧化酶活性的变化规律[J].南方农业学报,2021,52(4):1050-1057.
[15] 单体敏,金鹏,许佳,等.外源甜菜碱处理对冷藏桃果实冷害和品质的影响[J].园艺学报,2015,42(11):2244-2252.
[16] DAI S,KAI W,LIANG B,et al. The functional analysis of SlNCED1 in tomato pollen development[J].Cellular and Molecular Life Sciences,2018,75:3457-3472.
[17] NGOC T.N,MACNISH A J,ZAKHAROV F,et al. ‘bartlettpear fruit (Pyruscommunis L.)ripening regulation by low temperatures involves genes associated with jasmonic acid,cold response,and transcription factors[J].Plant Science,2017,260:8-18.
[18] WU D,CHEN M,SUN Q,et al. Postharvest performance of peach in cold storage is influenced by preharvest rain-shelter cultivation[J].Journal of Fruit Science,2016,33(1):96-105.
[19] JOHNSTON J W,HEWETT E W,BANKS N H,et al. Physical change in apple texture with fruit temperature:effects of cultivar and time in storage[J].Postharvest Biology & Technology,2001,23(1):13-21.
[20] ZHU X,SHEN L,FU D,et al. Effects of the combination treatment of 1-MCP and ethylene on the ripening of harvested banana fruit[J].Postharvest Biology and Technology,2015,107:23-32.
[21] CHEN J D,XU F,CHEN W,et al. Starch degradation and analysis of key-gene expression during postharvest kiwifruit softening[J].Journal of Nuclear Agricultural Sciences,2018,32(3):236-23.
[22] LIU N N. Effects of iaa and aba on the immature peach fruit development process[J].Horticultural Plant Journal,2019,5(4):145-154.
[23] 嚴娟,宋志忠,蔡志翔,等.3种果肉颜色桃原花青素积累[J].江苏农业学报,2018,34(003):651-656.
[24] LIU T,SONG S,YUAN Y B,et al. Improved peach peel color development by fruit bagging.Enhanced expression of anthocyanin biosynthetic and regulatory genes using white non-woven polypropylene as replacement for yellow paper[J].SciHortic(Amsterdam),2015,184:142-148.
[25] 蔡冲,龚明金,李鲜,等.枇杷果实采后质地的变化与调控[J].园艺学报,2006,33(004):731-736.
[26] 金微微,徐昌杰,李鲜,等.采后玉露桃果实冷害发生与ROP基因的表达调控[J].果树学报,2009,26(05):608-613.
[27] WANG K,YIN X R,ZHANG B,et al. Transcriptomic and metabolic analyses provide new insights into chilling injury in peach fruit[J].Plant,Cell&Environment,2017,40(8):1531-1551.
[28] YORDANOVA R Y,CHRISTOV K N,POPOVA L P.Antioxidative enzymes in barley plants subjected to soil flooding[J].Environmental and Experimental Botany,2004,51(2):93-101.
[29] LIN Y F,LIN H T,LIN Y X,et al. The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-induced pericarp browning of harvested longanfruit[J].Postharvest Biology & Technology,2016,111:53-61.
[30] PASQUARIELLO M S,PATRE D D,MASTROBUONI F,et al. Influence of postharvest chitosan treatment on enzymatic browning and antioxidant enzyme activity in sweet cherry fruit[J].Postharvest Biology & Technology,2015,109:45-56.
[31] ZHANG S Y.Combined treatment of carbon monoxide and chitosan reduced peach fruit browning and softening during cold storage[J].International Journal of Nutrition and Food Sciences,2015,4(4):477.
[32] 武倩.深州蜜桃采后衰老褐变的生理生化机制与调控[D].石家庄:河北师范大学,2016.
[33] XI W P,ZHANG B,LIANG L,et al. Postharvest temperature influences volatile lactone production via regulation of acyl-coa oxidases in peach fruit.[J].PlantCell Environ,2012,35(3):534-45.
[34] BENATI J,BARRETO C F,NAVROSKI R,et al. Effect of salicylic acid in post-harvest quality of ‘BRS kampai peaches submitted to different cold storage periods[J].Australian Journal of Crop Science,2021,15:196-200.
[35] ZHAO Y Y,SONG C C,BRUMMELL D A,et al. Jasmonic acid treatment alleviates chilling injury in peach fruit by promoting sugar and ethylene metabolism[J].Food Chem,2020,338:128005.

