通过定向内胚层的高效分化提高多能干细胞体外生成肝细胞样细胞的效率
闫煜聪,杨淑春,贾玉艳,黄 粤
中国医学科学院基础医学研究所 北京协和医学院基础学院 医学遗传学系医学分子生物学国家重点实验室,北京 100005
肝脏对维持机体内环境的稳态尤为重要[1]。肝脏相关的疾病也成为全球主要致死因素之一[2]。目前,肝移植是终末期肝病的唯一治疗手段[3]。然而,可供移植的肝脏数量紧缺,此外原代肝细胞在体外也难以大量扩增培养[4],所以仍需发掘新的肝细胞来源以及体外稳定培养肝细胞的方法来满足临床肝脏疾病治疗的需要。
多能干细胞(pluripotent stem cells, PSCs)包含胚胎干细胞(embryonic stem cells, ESCs)和诱导多能干细胞(induced pluripotent stem cells,iPSCs),在体外能无限扩增且具有分化形成所有类型成体细胞的潜能,包括肝细胞[5]。目前,科学家们根据体内肝脏发育规律,利用各类培养基和细胞因子使PSCs逐级经历定向内胚层、肝内胚层(hepatic endoderm, HE)、不成熟的肝细胞(immature hepatocyte, IH)和成熟肝细胞(mature hepatocyte, MH)4个阶段,成功构建了PSCs诱导分化形成肝细胞样细胞(hepatocyte-like cells, HLCs)的多种方法[6-8]。然而,不同分化方案中得到HLCs的效率不高,且HLCs的成熟度还未达到原代肝细胞的水平[9]。因此,仍需要对体外诱导形成HLCs的体系进行优化。
定向内胚层(definitive endoderm, DE)作为胚胎发育早期原肠胚形成的主要胚层之一,也是ESCs体外分化得到HLCs过程的中间状态。然而,在现有的诱导分化方法中,经常观察到:仅在培养基中添加激活素A(activin A),细胞在PSCs向DE诱导分化时会大量死亡,从而严重影响后续分化细胞的得率[10]。此外有研究指出,成纤维细胞因子2(fibroblast growth factor, FGF2)以及骨形态发生蛋白4(bone morphogenetic protein 4, BMP4)能抑制PSCs向DE分化过程中的细胞凋亡[11]。为了优化ESCs体外向HLCs定向分化的体系,本研究通过前期在培养基中添加FGF2和BMP4,提高了ESCs向HLCs定向分化早期细胞的存活率以及分化效率,最终显著提高了得到HLCs的效率,这将助力于肝脏相关的再生医学研究,推动肝脏疾病的临床治疗手段的开发。
1 材料与方法
1.1 材料
1.1.1 细胞:为了更好地示踪肝细胞的产生,本研究在人胚胎干细胞(ESCs)系H9(清华大学那洁教授惠赠)中敲入了由成熟肝细胞标志基因白蛋白(albumin,ALB)诱导表达的Venus荧光蛋白的肝细胞报告系统(中国科学院上海营养与健康研究所丁秋蓉研究员惠赠)[12],得到的细胞株命名为H9[ALB-Venus]。
1.1.2 试剂:Matrigel(Corning公司,356231);多能干细胞mTeSRTM1培养基、AccutaseTM、Cryostor CS10、ReLeSRTM培养基(Stem Cell公司);肝细胞培养基(hepatocyte culture medium without epidermal growth factor,hepatocyte culture medium)、内皮细胞培养基-2(endothelial cell growth medium-2,EGM-2)(Lonz公司);Advanced DMEM/F12(Thermo Fisher公司);ROCK抑制剂Y-27632(Selleck公司);RPMI 1640(Invitrogen公司);激活素A(activin A)、重组人肝细胞生长因子(recombi-nant human HGF)、FGF2、BMP4、B27添加剂、去除胰岛素(B27 supplement w/o insulin)、抑癌素M(oncostatin M,OSM)、地塞米松(dexamethas-one,Dex)(Peprotech公司);胎牛血清(Sigma-Aldrich公司)。
1.2 方法
1.2.1 H9[ALB-Venus]细胞的培养:将H9[ALB-Venus]细胞按照1.5×105个/孔的比例接种到基质胶包被的6孔板中,37 ℃、5% CO2培养,每天换液,5~6 d按照1∶20的比例传代。使用的培养基为mTeSR1,ROCK抑制剂为Y27632。
1.2.2 PSCs诱导形成HLCs的方法:依次经历DE、HE、IH及MH这4个阶段,具体如下:
1)人胚胎干细胞hESCs至DE分化阶段:将hESCs按照2.5×105个细胞/孔的比例接种到基质胶包被的12孔板中,A组(pre-optimization)方法为RPMI 1640+去除胰岛素的B27添加剂+100 ng/mL激活素A连续培养5 d。改进的B组(post-optimization)方法为RPMI 1640+去除胰岛素的B27添加剂+100 ng/mL激活素A+10 ng/mL BMP4+20 ng/mL FGF2,培养2 d;RPMI 1640(22400-089)+去除胰岛素的B27添加剂+100 ng/mL激活素A,培养3 d。
2)DE至HE阶段:RPMI 1640(22400-089)+ B27添加剂+10 ng/mL BMP4+20 ng/mL FGF2,低氧小室中培养5 d。
3)HE至IH阶段:肝细胞培养基和内皮细胞培养基 以1∶1的比例配置成HGM基础培养基,后加入 2.5% FBS、100 nmol/L Dex、20 ng/mL OSM、和10 ng/mL HGF。低氧小室中培养4 d。
4)IH至MH阶段:培养基和上一阶段完全相同,常氧孵箱中培养8~10 d。
1.2.3 RT-qPCR:在hESCs、DE、HE、IH、MH阶段分别收集细胞样本,提取各个阶段的总RNA并反转录为cDNA,用TB Green进行标志基因的RT-qPCR反应,引物序列见表1,ACTB为内参基因,OCT4为hESCs阶段的标志基因,SOXA2为DE阶段的标志基因,HNF4A和HNF1B为HE阶段标志基因,AFP和ALB为IH和MH阶段标志基因。

表1 RT-qPCR引物序列
1.2.4 Venus荧光示踪:本研究所使用的H9细胞中在ALB基因的终止密码子前插入了编码Venus荧光蛋白的序列,可利用Venus荧光示踪HLCs的产生,使用荧光显微镜观察Venus的表达,激发光波长为488 nm。
1.2.5 流式细胞测量术检测:收集MH阶段的细胞,使用DPBS(Dulbecco’s phosphate buffered saline)清洗后分装在离心管中,使用流式细胞仪进行Venus荧光信号的检测。
1.3 统计学分析

2 结果
2.1 优化的分化体系中不同阶段的细胞形态及基因表达
为了优化PSCs形成HLCs的分化体系,本研究制定了如图1的分化方法。结果表明,经过逐级诱导分化,2组细胞均逐渐由hESC转变为DE阶段的间质样、HE阶段的上皮样形态, 最终MH阶段的细胞表现为典型的原代肝细胞形态,呈明显的多边形。对实验MH阶段细胞群体的肝细胞标志基因的表达量进行检测发现, B组的ALB、AFP、CEBPA的表达随后,本研究对分化不同阶段细胞中标志基因的表达量进行了检测(图3)。观察到A、B 2组细胞均在相应阶段正确表达对应的标志基因。
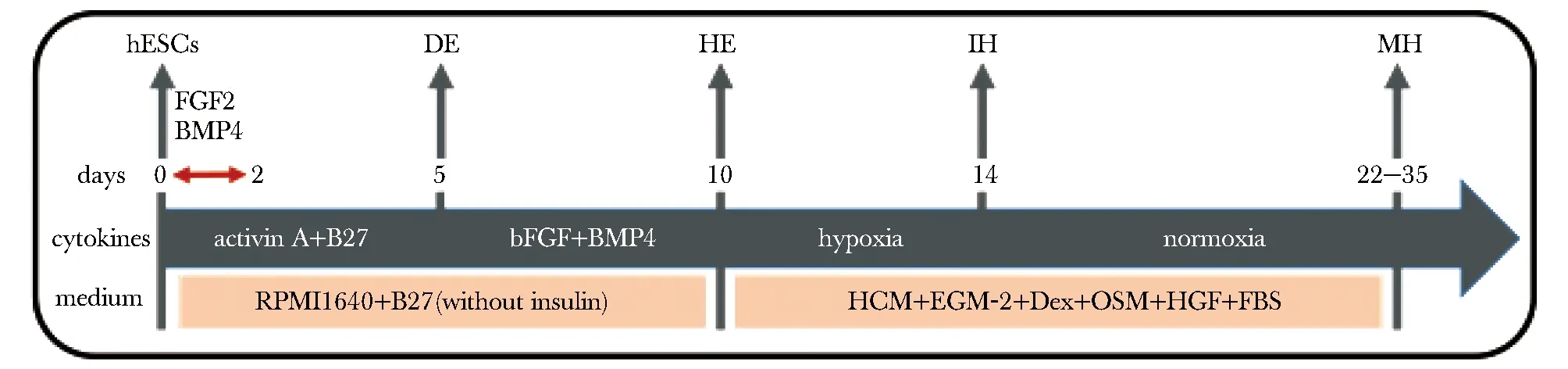
图1 人胚胎干细胞向肝脏细胞定向分化方案示意图

DE.definitive endoderm; HE.hepatic endoderm; IH:immature hepatocyte; MH.mature hepatocyte.
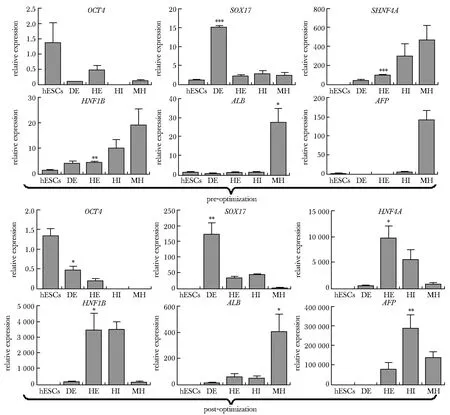
DE.definitive endoderm; HE.hepatic endoderm; IH:immature hepatocyte; MH.mature hepatocyte; the mRNA expression levels of each specific marker in the hESCs, DE, HE, IH, and MH;*P<0.05, **P<0.01, ***P<0.001 compared with hESCs.
2.2 优化的分化体系能提高HLCs的产生效率
本研究利用荧光显微镜观察到A组和B组分化到MH阶段的细胞群体中均有Venus信号的表达,且B组中Venus信号明显高于A组(图4A)。流式细胞分析结果显示B组的MH阶段的细胞群体中Venus+细胞占细胞总数的10.10%,而A组中Venus+细胞只占细胞总数的3.58%(图4B)。MH阶段标志物表达量显著高于A组(图5)。当分化进行到第28天后,B组中开始出现了类似肝细胞样类器官(hepatocyte-like liver organoids,HLOs)的饱满的囊泡样结构(图6),而A组则并未出现类似结构。这可能与B组细胞中HLCs群体比例较高相关。
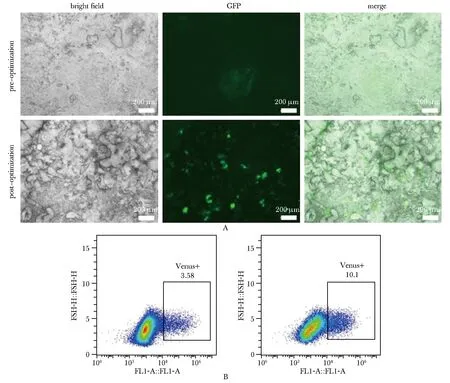
A.Venus fluorescence tracer in mature hepatocytes derived from H9[ALB-Venus]cells; B.the proportion of Venus+ cells in MH population generated by two different differentiation methods by flow cytometry.

A.pre-optimization; B.post-optimization; mRNA expression levels of each specific marker in the MH;*P<0.05, **P<0.01, ****P<0.000 1 compared with A.

图6 H9[ALB-Venus]细胞定向分化得到的肝细胞样类器官的形态
2.3 优化的分化体系显著提高了hESCs向DE分化的效率
进一步对分化过程细胞形态的追踪观察,本研究发现B组在向DE分化阶段的第1天内仅有少许死亡,而A组则出现大量死亡(图7)。随后数天内,B组细胞死亡率较低,增殖能力较强,细胞之间没有出现明显的空隙,细胞状态良好;A组细胞则大量死亡,细胞增殖能力降低,细胞甚至无法铺满整个孔板。随后本研究比较了A、B组在DE阶段细胞群体标志基因表达水平。结果表明B组细胞DE标志基因SOX17和FOXA2的表达量显著高于A组。不仅如此,下一阶段HE标志基因HNF4A和HNF1B的表达量仍然存在显著差异(图8)。

图7 2种不同分化方法在DE阶段的细胞形态
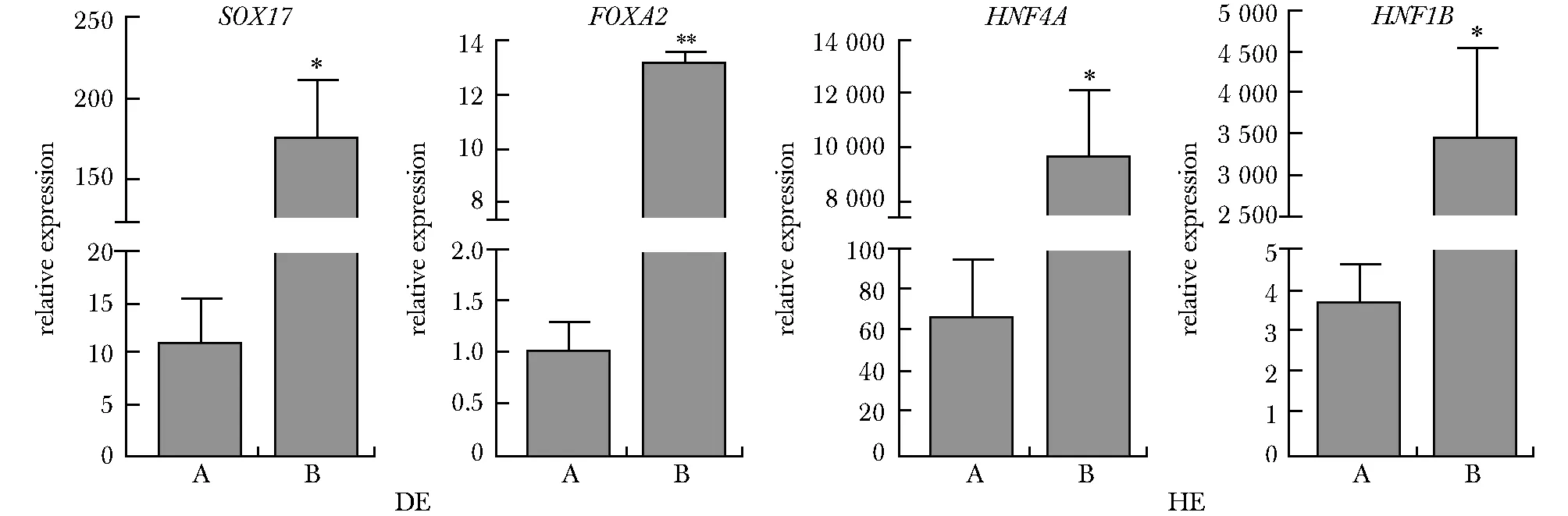
A.pre-optimization; B.post-optimization; DE.definitive endoderm; HE.hepatic endoderm; mRNA expression levels of each specific marker in the DH and HE.*P<0.05, **P<0.000 1 compared with A.
3 讨论
本研究对现有肝细胞的分化方法进行了改进,在DE阶段同时添加activin A、BMP4和FGF2这3种细胞因子能显著提高MH阶段细胞群体中Venus荧光蛋白信号和Venus+细胞的比例,同时该阶段中成熟肝细胞ALB表达量也明显上调。对整个DE阶段进行细胞形态追踪, 观察到BMP4和FGF2能大幅度降低该阶段细胞的死亡率,说明本研究建立了一种更加高效的PSCs向HLCs分化的方法,显著提高了得到HLCs的比例和成熟度,提高了细胞分化效率,甚至影响肝细胞类器官的形成效率。
在过去的数年里,利用多能干细胞向肝细胞定向分化的方法不断迭代优化,从二维培养系统到三维培养系统都取得了显著的进展[13]。但这些方法普遍存在分化效率低、肝细胞成熟度不高的缺陷。本研究根据肝细胞体内发育的规律,通过同时添加activin A、BMP4和FGF2提高了多能干细胞向DE样细胞转变的效率,最终得到更多的HLCs。
近年来,类器官(organoid)技术飞速发展。它的细胞组成与体内生理条件更相似,能够更好地在体外模拟人类器官发育过程或相关疾病的发生发展[14]。目前,肝脏类器官也成功构建,并且应用于基础医学研究[15]。文献报道[16],当成熟的HLCs达到一定比例后会通过自组织形成一种囊泡样结构,这种结构被称为HLOs。在本研究中发现优化的分化体系更容易出现囊泡样的结构,故而推测提高MH阶段细胞群体中HLCs的比例以及成熟度同样会促进HLOs的形成效率。
综上,本研究对现有的体外获得HLCs的方法进行了改进,制定出了更高效率的分化体系,为解决原代肝细胞短缺、研究人类肝脏疾病等问题提供了新的研究思路,也为再生医学的研究提供了参考。

