不同人工栽培方式对灵芝生长状况的影响
李佳 陈天然 邓紫凤 鹿雨晴 郭江


摘要 以灵芝品种G10为试验材料,通过设置代料栽培和椴木栽培这2种人工栽培方式,分析常用的不同人工栽培方式对灵芝生长状况,以及采摘后灵芝子实体多糖、三萜化合物含量的影响,比较得出实验室条件下,生长状况更好、营养价值更高的灵芝栽培方式,以期为灵芝种植产业和消费者选购灵芝提供一定的理论依据。结果表明,代料栽培灵芝菌丝洁白绵密、生长速度较快;子实体生长周期较短;采摘后子实体多糖含量为1.12%,三萜化合物含量为1.05%。椴木栽培灵芝菌丝疏松发黄,生长速度较慢;子实体生长周期较长;采摘后子实体多糖含量为0.99%,三萜化合物含量为0.98%。不同栽培方式对灵芝生长状况及采后子实体多糖、三萜化合物的含量有较为显著的影响,且优良的代料配方栽培优于椴木栽培。
关键词 灵芝;栽培方式;药用真菌;成分测定
中图分类号 S567.3+1 文献标识码 A
文章编号 0517-6611(2023)06-0031-04
doi:10.3969/j.issn.0517-6611.2023.06.010
Effects of Cultivation Methods on Growth Conditions of Ganoderma lucidum
LI Jia,CHEN Tian-ran,DENG Zi-feng et al
(College of Bioscience and Food Engineering, Shaanxi Xueqian Normal University, Xi’an,Shaanxi 710100)
Abstract In this study, Ganoderma lucidum ‘G10’ was used as the experimental material.By setting two artificial cultivation methods: substitute cultivation and basswood cultivation, the effects of different artificial cultivation methods on the growth status of Ganoderma lucidum and the content of polysaccharides and triterpenes in Ganoderma lucidum fruiting body after picking were explored and analyzed.The cultivation method of Ganoderma lucidum with better growth status and higher nutritional value under laboratory conditions was compared, in order to provide some theoretical basis for Ganoderma lucidum planting industry and consumers buying Ganoderma lucidum.The results showed that the mycelium of Ganoderma lucidum cultivated with substitute was white and dense, and the growth rate was fast;the growth cycle of fruiting body was short;the content of polysaccharides and triterpenoids in fruiting bodies were 1.12% and 1.05%.The hyphae of Ganoderma lucidum cultivated in basswood were loose and yellow, and the growth rate was slow;the growth cycle of fruiting body was long;the content of polysaccharides and triterpenoids in fruit bodies were 0.99% and 0.98%.Different cultivation methods had significant effects on the growth of Ganoderma lucidum and the content of polysaccharides and triterpenoids in postharvest fruiting bodies, and the excellent substitute formula cultivation was better than basswood cultivation.
Key words Ganoderma lucidum;Cultivation method;Medical fungi;Composition determination
靈芝(Ganoderma lucidum)是一种珍贵的食药用真菌,有“仙草”“林中灵”的美称[1],属于真菌界担子菌门伞菌纲多孔菌目灵芝科灵芝属[2]。在我国灵芝已经有2 000多年的历史[3],早在《神农本草经》中,对灵芝的药用功效就有了较为详细的记载[4]。中医认为灵芝入药有清热解毒、益肾保肝、滋补强身、扶正固本、美容养颜、安神益精气等功效[5]。现代医学研究表明,灵芝的天然成分中含有灵芝多糖、灵芝萜类、灵芝多酚、脂肪酸、有机锗、氨基酸等有效成分[6],在抗肿瘤、抗心肌缺血、提高免疫、调节血脂、抗肥胖以及降低血糖改善糖尿病并发症等方面有巨大的应用潜力[7]。
我国现行的《中华人民共和国药典》2020年版第一部中收录的灵芝药材为多孔菌科真菌赤芝或紫芝的干燥子实体[8]。由于医药科学的迅猛发展,百姓的保健意识也随之提高,灵芝作为一种传统名贵中药材而广受大众关注和喜爱,灵芝市场的需求越来越高。但一直以来,野生灵芝资源十分有限,且价格昂贵,随着科技的发展,人工栽培灵芝成为丰富灵芝资源的重要途径,能很好地扩大灵芝产量,以供市场需求。
目前,常用的灵芝人工栽培方式主要有椴木栽培和代料栽培2种。椴木栽培是指把适合于食用菌生长的原木砍伐,截成一定长度,经灭菌后进行人工接种,在适宜的环境条件下进行栽培[9]。而代料栽培是指在食用菌种植过程中利用玉米芯、秸秆、木屑等农副产品下脚料替代椴木实施栽培的一种方式。以上这2种栽培方式因投资小、原料来源广、见效快,广受农户的青睐,相同条件下这2种人工栽培方式相比较,哪种能够使灵芝长得又快又好,这对于种植者具有十分重要的现实意义。而对于消费者而言,面對市场上各种各样的灵芝,价格也千差万别,同是人工栽培灵芝,哪种栽培条件下的灵芝产品功效性成分含量更高效果更好,是否能在选购过程中有一定的理论依据作为指导,具有十分重要的意义。因此,笔者探究常见的2种不同栽培条件对灵芝生长状况及营养价值的影响,以期为灵芝种植栽培基质的选择提供一定的理论基础,同时也能对消费者选购灵芝提供一定的理论指导。
1 材料与方法
1.1 试验材料 菌种为赤灵芝G10;棉籽壳、玉米芯、麦麸皮、石膏粉、椴木;聚乙烯塑料袋、塑料封口器、接种铲。
1.2 主要试剂
无水葡萄糖、齐墩果酸、甲醇、蒽酮、无水乙醇、浓硫酸、香草醛、冰醋酸、高氯酸、乙酸乙酯[10]等均为分析纯试剂,蒸馏水为实验室制备。
1.3 主要仪器
LDZX-40不锈钢立式电热蒸汽压力灭菌器(上海申安医疗器械厂),ZHJH-C115超净工作台(上海智城分析仪器制造有限公司),HH·B11·600-BS-II电热恒温培养箱(上海跃进医疗器械有限公司),AD-20多功能粉碎机,TU-1901紫外可见分光光度计(北京普析通用仪器有限公司),GZX-9030MBE电热鼓风干燥箱(上海博迅实业公司),FA-2004B电子天平(上海市安亭电子仪器厂)。
1.4 试验方法
1.4.1 灵芝培养基优化筛选配方。
以市场上常用的玉米芯、棉籽壳、麦麸皮为灵芝代料栽培材料[11]。通过单因素试验及正交试验确定最佳配方成分及配比为棉籽壳30%、玉米芯60%、麦皮10%、石膏1.5%[12]。综合考虑产地等因素,选择椴木段作为灵芝段木栽培培养基。
1.4.2 灵芝栽培方法。
将上述代料栽培的优化配方与椴木栽培所制作的料袋同时进行接菌、发菌管理、出芝管理等,定期进行生长状况监控与记录。
1.4.2.1 装料灭菌、接种。
将试验材料按照配方比例进行混合均匀,加水搅拌均匀,使料水比为1.0∶1.5[13]。静置2 h后,定量称量0.5 kg混料用铲子装入15 cm×30 cm×5 cm(折宽×长度×厚度)的聚丙烯封底菌种袋,用食用菌料袋封口器进行包装和封口,在121 ℃下,规范使用高压蒸汽灭菌锅下进行1 h 的湿热灭菌,静置,使料袋的温度降低到与室内温度相接近,将料袋移入超净工作台上,打开超净工作台的紫外灯照射消毒40 min后,消毒结束30 min后,进行后续的接种工作。
接种中,确保在整个接种过程中严格遵守无菌操作规程,在酒精灯对外焰旁用接种铲挖取等量适量菌块接种到料袋中。接种完成后,迅速用封口器再次封装好料袋口,转移到25 ℃培养箱中。
1.4.2.2 发菌管理。
接种后,将栽培料袋放入培养室,在25 ℃的温度下培养,确保恒温避光,环境清洁,通风良好[14],定期对灵芝菌丝生长实况进行观察并记录菌丝长势状况、满袋时间相关指标,及时处理杂菌感染的菌袋并对其进行标记记录。
1.4.2.3 出芝管理。
当原基不断增厚凸起即需开口,用消毒后的刀片或剪刀对袋料的顶端割口出芝处理。控制培养实验室的温度为25~28 ℃,同时要保证室内的空气相对湿度为80%~90%[15],确保灵芝的出芝过程中能够透气、通风。出芝过程中注意保持其湿度和二氧化碳浓度,保持良好的通风和环境的清洁[16],保证不同配方管理条件一致,对灵芝每日的生长变化做相应的观察记录。出芝期间不使用任何添加剂和农药。
1.4.2.4 子实体的采收。
当菌盖不再增大、边缘增厚,菌盖边缘的颜色和中间的颜色一致,整个子实体都变成该品种应有的颜色,芝片木质化加重,上附少量孢子时即可采收。
1.4.3 灵芝生长状况记录。
1.4.3.1 灵芝的菌丝生长状况记录。
接种后将料袋放入28 ℃恒温箱中培养。分别于第3、4、5、6、7、8天测量顶端到生长圈的距离,求3次重复平均值得菌丝生长速度,同时观察菌丝密度和菌丝形态,最终记录菌丝满袋天数[17],作为衡量菌丝生长状况的指标。
1.4.3.2 灵芝的子实体生长状况记录。
为方便记录各时期子实体生长状况,将灵芝生长过程人为划分为原基分化期、芝柄伸长期和子实体成熟期3个阶段。当菌丝长满菌袋后,菌丝逐渐密集形成菌块状,进入原基分化期;直至开口处有明显伸长,并逐渐转为黄褐色,即为芝柄伸长期;在适宜的条件下,芝柄顶端横向生长,形成似伞盖状的灵芝菌盖,伞盖下菌褶处喷射孢子粉,即为成熟期。分别记录2种栽培条件下灵芝在原基分化期、芝柄伸长期和子实体成熟期的天数,作为评估子实体生长状况的指标。
1.4.4 紫外-可见分光光度法测定灵芝多糖的含量[18]。
1.4.4.1 供试品溶液的制备。
精密称取2 g供试灵芝子实体粉末置于圆底烧瓶中,加入60 mL蒸馏水,静置1 h,加热回流4 h,趁热滤过,用少量热水洗涤滤器和滤渣,将滤渣及滤纸置烧瓶中,加水60 mL,加热回流3 h,趁热滤过,合并滤液,置水浴上蒸干,残渣用水5 mL溶解,边搅拌边缓慢滴加乙醇75 mL[19],摇匀,在4 ℃放置12 h,离心,弃去上清液,沉淀物用热水溶解并转移至50 mL量瓶中,放冷,加水至刻度,摇匀[20],取溶液适量,离心,精密量取上清液3 mL,置25 mL量瓶中,加水至刻度,摇匀,即得。
1.4.4.2 灵芝多糖含量测定标准曲线的绘制。
配制0.12 mg/mL的无水葡萄糖对照品溶液,精密量取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于10 mL具塞试管中,加蒸馏水至2.0 mL,迅速精密加入硫酸蒽酮溶液(精密称取蒽酮0.1 g,加硫酸100 mL使溶解,摇匀),放置15 min后,立刻冰水浴冷却15min,取出,以相应试剂为空白,在625 nm波长处测定吸光度值[21]。
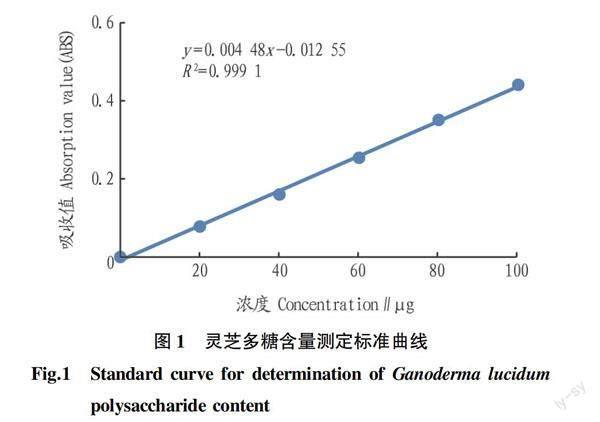
以无水葡萄糖对照品系列标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线[22],计算回归方程为Y=0.004 48X-0.012 55,R2=0.999 1(图1)。
1.4.4.3 灵芝多糖的含量测定。
精密量取供试品溶液1 mL于具塞试管中,加入1 mL蒸馏水,使用10 mL移液管迅速加入6 mL硫酸蒽酮溶液,立刻摇匀,放置15 min后立刻置于冰浴中冷却15 min,取出,以2 mL蒸馏水加入6 mL硫酸蒽酮溶液为空白,使用紫外可见分光光度计在625 nm波长处测定吸光度[23]。
1.4.5 紫外-可见分光光度法测定灵芝三萜类的含量
1.4.5.1 供试品溶液的制备。
取本品粉末约2 g,精密称定,置具塞锥形瓶中,加入50 mL乙醇,进行超声处理(功率140 W,频率42 kHz)45 min,滤过,滤液置100 mL量瓶中,用适量乙醇,分次洗涤后,洗液并入同一量瓶中,加乙醇至刻度,摇匀,得到供试品溶液[24]。
1.4.5.2 灵芝三萜类含量测定标准曲线的绘制。
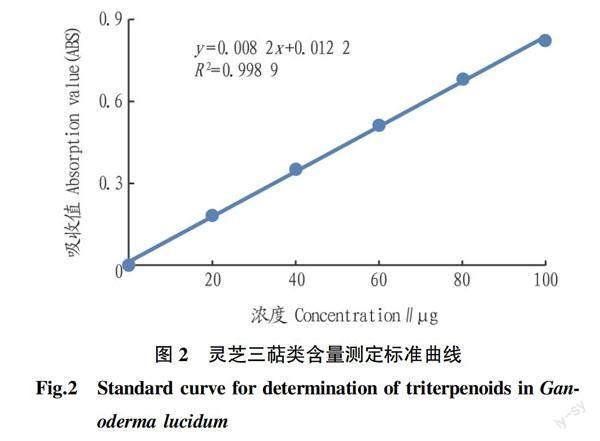
精密量取对照品溶液0.l、0.2、0.3、0.4、0.5 mL,分别置15 mL具塞试管中,挥干后静置放冷,精密加入新配制的0.2 mL香草醛冰醋酸溶液(精密称取香草醛0.5 g,加冰醋酸使溶解成10 mL,即得)、0.8 mL高氯酸,摇匀,在70 ℃水浴中加热15 min,立即置冰浴中冷却5 min,取出,精密加入4 mL乙酸乙酯,摇匀,以相应试剂为空白,在546 nm波长处测定吸光度[25],以吸光度为纵坐标、浓度为横坐标绘制标准曲线[26]。回归方程为Y=0.008 2X+0.012 2,R2=0.998 9(图2)。
1.4.5.3 灵芝三萜类的含量测定。
精密量取供试品溶液0.2 mL分別置于15 mL具塞试管中,挥干,放冷,精密加入0.2 mL香草醛冰醋酸溶液、0.8 mL高氯酸,摇匀,在70 ℃水浴中加热15 min,立即置冰浴中冷却5 min,取出,加入4 mL乙酸乙酯,摇匀,以相应试剂为空白,测定在波长为546 nm处的吸光度[27]。
1.5 数据统计分析 对不同栽培方式灵芝多糖含量、三萜类含量的差异进行方差分析。
2 结果与分析
2.1 不同栽培方式对灵芝菌丝生长状况的影响
2.1.1 不同栽培方式对灵芝菌丝体长速和满袋时间的影响。
不同栽培方式下灵芝的菌丝生长状况有差异,代料栽培条件下菌丝生长速度为3.89 cm/d;椴木栽培条件下菌丝生长速度为2.39 cm/d。由此可见,在控制光照、温度、湿度等条件一致时,代料栽培方式下菌丝生长速度比椴木栽培方式下菌丝生长速度慢,可能是优化代料配方中碳氮比例适当,有益于菌丝吸收营养成分,菌丝活性高。
2.1.2 不同栽培方式对灵芝菌丝形态和致密程度的影响。
不同栽培方式下灵芝的代料栽培和椴木栽培有差异(图3、4)。代料栽培的菌丝颜色为洁白色,菌丝附着更紧密,分布更均匀;椴木栽培菌丝颜色白中发黄,菌丝在树段平整处分布均匀,不平整处菌丝着生能力差(表1)。这种结果的产生可能是优于基质状态的显著不同。代料栽培条件下,菌块接种在料袋的中心预留孔洞中,在栽培基质中向下延伸同时穿过疏松的栽培料向袋壁处蔓延,菌丝牢牢缠绕代料基质,附着能力强;相较于疏松的代料基质,椴木段中的木头紧紧相接,菌块接种后短期内仅在木段表面扎根,附着面积小,进而菌丝生长密度较稀疏,木段与木段相接的不平整处菌丝附着能力差。所以,代料栽培灵芝的菌丝状况整体优于椴木栽培灵芝的菌丝,通过调整代料栽培基质配方进而调整基质内碳氮比及透气性而增加菌丝活性是可行的。
2.2 不同栽培方式对灵芝子实体生长状况的影响
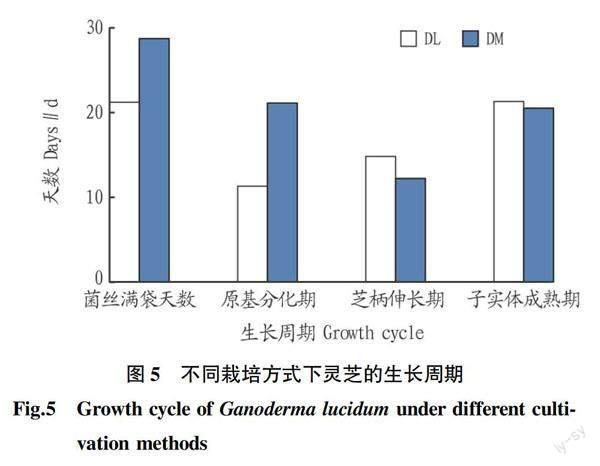
在不同培养基上子实体发育情况显著(图5)。在实验室条件下,代料栽培条件下菌丝满袋平均需要21.2 d,椴木栽培菌丝满袋平均需要28.7 d;子实体生长阶段,代料栽培从菌芽生成到子实体成熟需要47.4 d;椴木栽培则需要53.8 d。代料栽培条件下与椴木条件下相比菌蕾出现较早,子实体成熟较早,整个子实体生长周期较短。可初步判断,想要缩短子实体生长周期,抢占市场先机可选择代料栽培方式。
2.3 不同栽培方式对灵芝多糖和三萜类含量的影响
灵芝多糖和灵芝三萜类是灵芝的次生代谢产物,是灵芝重要的化学和药效成分。根据《中华人民共和国药典》2020年版第一部规定,灵芝多糖含量不得低于0.90%,灵芝总三萜酸含量不得低于0.50%[28]。
代料栽培和椴木栽培相比较,代料栽培的灵芝多糖含量显著高于椴木栽培,两者灵芝多糖的含量分别为1.12%和0.99%,平均分别超出药典标准24.44%和10.00%,均与药典规定值有极显著差异(P<0.01)。此外,代料栽培和椴木栽培的灵芝总三萜酸含量分别为1.05%和0.98%,平均分别超出药典标准110.00%和96.00%,与药典有极显著差异(P<0.01)。2种栽培方式相比,代料的灵芝多糖含量平均比椴木栽培高13.13%,灵芝总三萜酸平均比椴木高7.14%,差异均达极显著水平(P<0.01)。
3 结论与讨论
该研究为探讨不同人工栽培方式对灵芝生长状况的影响,以灵芝G10为试验材料,通过设置代料栽培和椴木栽培2种不同人工栽培方式,对赤灵芝进行种植并记录子实体的生长状况,对灵芝生长过程及采摘后灵芝内多糖、三萜化合物等天然活性成分的含量进行全面比较,以选出更好的人工栽培方式。
从生长速度和菌丝状况来看,代料栽培的生长速度更快且菌丝附着基质密度更高;从菌蕾萌发到子实体成熟时长来看,代料栽培的全过程用时更短,符合农业生产中成本低的要求。灵芝的生长周期与生物活性物质积累量是否有因果联系,还有待于进一步试验。
目前国内学术界就野生栽培和灵芝栽培在营养价值上是否有显著差异这一问题有较大分歧[14]。在前期市场调查时发现,同样是人工栽培,一些商家将椴木灵芝作为卖点,宣传椴木生灵芝营养价值高,代料栽培营养价值低。该试验44 d 内子实体多糖含量为1.12%;子实体三萜化合物含量为1.05%。椴木栽培灵芝菌丝疏松发黄生长速度较慢;44 d内子实体生长周期较短;子实体多糖含量为0.99%;子实体三萜化合物含量为0.98%。该研究发现,代料栽培和椴木栽培条件下灵芝多糖含量和三萜含量均符合国家药典要求,因此若药厂以灵芝多糖和三萜类化合物含量为指标收购,代料栽培和椴木栽培2种人工栽培方式下的灵芝均可以作为原料。从有效性成分含量差异来看,该研究中代料栽培灵芝的子实体生长状况和采摘后灵芝内多糖、三萜化合物含量均优于椴木栽培,而该试验是以喷射孢子粉来界定是否成熟、可否采摘的重要标志,因此只能说明在该试验条件下,在喷粉时采摘的灵芝子实体,代料栽培的生长状况以及多糖、三萜化合物含量均优于椴木栽培。但对于灵芝喷粉前后,子实体中的营养物质是否会随着孢子粉的弹射而散失,功效性成分会不会在不同采摘时期有所变化,将进一步探究。
参考文献
[1] 周萍,安东,王朝川,等.一种鲜活灵芝孢子的破壁方法:CN201110358260.2[P].2012-03-21.
[2] CAO Y,WU S H,DAI Y C.Species clarification of the prize medicinal Ganoderma mushroom “Lingzhi”[J].Fungal diversity,2012,56(1):49-62.
[3] BISHOP K S,KAO C H J,XU Y Y,et al.From 2000 years of Ganoderma lucidum to recent developments in nutraceuticals[J].Phytochemistry,2015,114:56-65.
[4] 韦达,黄青,何华奇.常压室温等离子体(ARTP)对灵芝菌丝体的影响[J].安徽科技学院学报,2020,34(1):32-36.
[5] LU J H,HE R J,SUN P L,et al.Molecular mechanisms of bioactive polysaccharides from Ganoderma lucidum (Lingzhi), a review[J].International journal of biological macromolecules,2020,150:765-774.
[6] ZENG P J,CHEN Y L,ZHANG L J,et al.Ganoderma lucidum polysaccharide used for treating physical frailty in China[J].Progress in molecular biology and translational science,2019,163:179-219.
[7] 毕秀兰,高陆.灵芝孢子粉新技术应用的前景探讨[J].人参研究,2015,27(3):44-47.
[8] 国家药典委员会.中华人民共和国药典:2020年版 一部[S] .北京: 中国医药科技出版社,2020:195
[9] 王琼.基于组学技术的灵芝三萜和多糖高产机制解析[D].无锡:江南大学,2020.
[10] 胡琼方.灵芝固态发酵、三萜化合物测定及结构分析[D].太谷:山西农业大学,2018.
[11] 李月梅,仝文玲,王建刚,等.正交试验法筛选醋糟玉米芯栽培平菇的最佳配方[J].中国食用菌,2018,37(6):24-26,31.
[12] SPEED T.Statistics for experimenters: Design,innovation, and discovery[J].Journal of the American statistical association,2006,101(476):1720-1721.
[13] 李晶晶.靈芝室内人工栽培方法的研究[D].武汉:湖北中医学院,2004.
[14] 王庆武,兰玉菲,罗霞,等.泰山赤灵芝代料栽培配方筛选试验[J].山东农业科学,2013,45(11):60-62.
[15] 姚林泉,张毅超.灵芝代料栽培试验初报[J] .上海蔬菜,2015(5):91-92.
[16] 骆美花.灵芝栽培技术及常见病虫害防治措施[J].乡村科技, 2020(14):88-89.
[17] 刘靖宇,孟俊龙,常明昌.黄伞菌丝生物学特性的研究[J].中国食用菌,2006,25(2):24-27.
[18] 杨瑞瑞,李国华,樊宝娟.灵芝多糖的含量测定方法探讨及改进[J].陕西中医学院学报,2009,32(5):62-63.
[19] 姜慧洁.灵芝药材的整体质量控制模式及初步活性研究[D].杭州:浙江工业大学,2016.
[20] 刘国健.灵芝孢子不同有效部位提取及体内抗肿瘤作用研究[D].广州:广东药科大学,2017.
[21] 廖川.茯苓水提液高效膜分离的应用研究[D].贵阳:贵州大学,2009.
[22] 黄宇明,滕健,许李.一种灵芝孢子粉的破壁方法及使用该方法得到的产品:CN201510217208.3[P].2015-08-26.
[23] 陈晗,张争,陈向东,等.海南橡胶林下不同栽培方式对赤芝多糖和灵芝酸含量的影响[J].贵州科学,2021,39(5):16-20.
[24] 孙恬,郭爱玲.蓝白光膜对灵芝田间生长、多糖含量及三萜含量的影响[J].生物化工,2019,5(1):70-72,76.
[25] 马玉涵.等离子体诱变灵芝及其药用成分的红外光谱分析[D].合肥:中国科学技术大学,2018.
[26] 姜玮,周桂生,陈骁鹏,等.紫外-可见分光光度法测定灵芝片中多糖、三萜及甾醇含量[J].中国药业,2018,27(14):9-12.
[27] 罗汝锋,罗艳萍,蓝泽基.不同处理方法对灵芝有效成分提取率的影响[J].农产品加工,2019(3):61-64.
[28] 林怡,叶菁,陈华,等.不同林下栽培方式对灵芝生长和培养料碳素转化的影响[J].热带作物学报,2019,40(3):425-431.
基金项目 省级大学生创新创业训练计划项目(S202014390067);陕西学前师范学院校级大学生创新创业训练计划项目(2020DC067);陜西学前师范学院科研扶贫项目(2019F02)。
作者简介 李佳(1989—),女,陕西宝鸡人,实验师,硕士,从事食品营养与安全研究。
收稿日期 2022-04-07;修回日期 2022-05-05

