森林脑炎病毒E蛋白DomainⅢ的串联表达、纯化及其多克隆抗体的制备
付明月,吴月,陈子杨,常东英,王清爽,常军亮
1.长春生物制品研究所有限责任公司,吉林 长春 130012;2.长春理工大学,吉林 长春 130012
森林脑炎又称蜱传脑炎,在我国多发于东北、西南及西北林区,已被我国列为5 大职业性传染病之一[1]。森林脑炎由携带森林脑炎病毒(tick-borne encephalitis virus,TBEV)的蜱虫叮咬所致,是以中枢神经系统病变为主的一种森林地区自然疫源性传染病。TBEV属黄病毒科、黄病毒属蜱传脑炎复合群[2-3]。TBEV为单股正链RNA包膜病毒,基因组全长约11 000 bp,靠近5'端依次编码衣壳蛋白C、膜蛋白PreM 及包膜蛋白E 3 种结构蛋白,靠近3'端编码7 种非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)[4];其中E 蛋白为疏水性蛋白,是最重要的病毒结构蛋白,可诱导保护性免疫反应,并作为TBEV的主要致病因子,具有影响病毒附着、膜融合、细胞嗜性和毒力等功能[5-6]。
REY 等[7]用胰蛋白酶处理TBEV E 蛋白,获得1个可溶性395 个氨基酸sE 片段,并对其三级结构采用X-衍射(分辨率为0.2 nm)进行结晶学分析,发现从E 蛋白的氨基端到羧基端依次为DomainⅠ、DomainⅡ、DomainⅢ3 个结构域。在病毒成熟期间,E蛋白的3 个结构域之间的旋转导致了该蛋白的成熟。其中DomainⅠ位于中心呈β 桶状结构;DomainⅡ的内融合肽决定二聚体的形成;DomainⅢ呈IgG样折叠,为E 蛋白最主要抗原区域,其在酸性条件下(pH <6.5)垂直伸出病毒表面形成的突起与受体的结合有关。DomainⅢ在TBEV 中呈高度保守,存在病毒特异性抗原表位,可用于病毒的特异性鉴定。因此对DomainⅢ的研究成为TBEV 亚单位疫苗、血清学诊断试剂、病毒与宿主细胞受体相互作用的重要靶点[8-9]。
本研究串联表达、纯化了TBEV 的2EDⅢ,并以纯化的重组蛋白为免疫原制备多克隆抗体。
1 材料与方法
1.1 质粒、细胞、毒株及疫苗 质粒pET-28a(+)、E.coliDH5α 感受态细胞由长春生物制品研究所有限责任公司(以下称长春公司)生物技术研究室保存,TBEV“森张”株灭活全病毒原液由该公司疫苗三室提供;E.coliBL21(DE3)感受态细胞购自上海泽叶生物科技有限公司;乙型脑炎灭活全病毒疫苗购自辽宁成大生物股份有限公司。
1.2 实验动物 雌性普通级新西兰大白兔,2 只,12周龄,体质量2 kg,由长春公司实验动物室提供,动物许可证号:SCXK(吉)-2017-0004。动物使用符合吉林省动物伦理相关文件规定(吉林省人大委员会第71号)。
1.3 主要试剂及仪器 TBEV 全病毒小鼠血清多克隆抗体由长春公司生物技术研究室保存;TransStart®FastPfu DNA Polymerase(cat:AP221)、FlyCut®SacⅠ限制性内切酶(cat:JS101)、FlyCut®HindⅢ限制性内切酶(cat:JH101)、T4 DNA Ligase(cat:FL101)、Easypure Plasmid MiniPrep Kit(cat:EM101-01)、HRP 标记的山羊抗兔IgG(cat:138437)购自北京全式金生物技术有限公司;硝酸纤维素膜(NC 膜)(cat:1060-0001)、HRP 标记的山羊抗小鼠IgG(cat:BL021A)购自北京兰杰柯科技有限公司;IPTG(cat:9030)购自宝生物工程(大连)有限公司;DAB 显色试剂盒购自北京索莱宝科技有限公司;AKTA 纯化系统、Ni-NTA 层析介质购自美国Therma公司。
1.4 引物设计及合成 根据GenBank中登录的TBEV“森张”(accession:JQ650523.1)全基因序列,应用Primer Premier 5.0软件设计2对引物,分别为EDⅢ特异性扩增引物1F 和1R,重叠PCR 引物2F 和2R。在引物1F 3'端及2R 5'端分别引入SacⅠ和HindⅢ酶切位点,其中引物1R和2F含有15 bp的互补区。1F:5'-CGGAGCTCATGAAATTCACGTGGAAGAGAATT-3'(下划线部分为SacⅠ酶切位点),1R:5'-AGAACCACCACCACCAGAACCACCACCACCTTTTTGGAACCATTGGTGAC-3';2F:5'-GGTGGTGGTGGTTCTGGTGGTGGTGGTTCTAAATTCACGTGGAAGAGAATT-3',2R:5'-CCAAGCTTATTTTTGGAACCATTGGTGAC-3'(下划线部分为HindⅢ酶切位点)。引物由吉林省库美生物科技有限公司合成。
1.5 目的基因的扩增 采用Trizol法提取TBEV“森张”株灭活全病毒原液RNA,逆转录合成cDNA,以其为模板,利用EDⅢ特异性引物进行RT-PCR 扩增。逆转录反应条件:25 ℃10 min;42 ℃30 min,85 ℃10 s;72 ℃10 min。PCR 反应条件:95 ℃预变性2 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸10 min。PCR 产物经1%琼脂糖凝胶电泳纯化回收后,再以2 段扩增的目的片段为模板,经连接肽进行退火延伸。PCR延伸条件:25 ℃10 min;45 ℃20 min;72 ℃10 min。利用重叠PCR 引物1F 和2R,以退火延伸产物为模板,构建二聚体串联融合基因。PCR反应条件:95 ℃预变性2 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃再延伸10 min。PCR 产物经1%琼脂糖凝胶电泳纯化回收,PCR 产物与融合基因片段经1%琼脂糖凝胶电泳鉴定。
1.6 重组表达质粒的构建 将胶回收产物与pET-28a(+)载体分别经SacⅠ和HindⅢ双酶切,回收酶切后的目的基因片段和载体片段,经T4 DNA Ligase 25 ℃连接60 min;连接产物转化至E.coliDH5α 感受态细胞,经卡那霉素抗性(50 μg/mL)固体培养基选择培养;挑取阳性克隆,进行双酶切鉴定,鉴定正确质粒送吉林省库美生物科技有限公司测序。测序正确质粒命名为pET-28a-2EDⅢ。
1.7 目的蛋白的诱导表达 将重组质粒pET-28a-2EDⅢ转化至E.coliBL21(DE3)感受态细胞,用卡那霉素抗性(50 μg/mL)固体培养基振荡培养至A600为0.6 ~0.8 时,加入终浓度1.0 mmol/L 的IPTG,37 ℃诱导5 h;菌液离心后进行超声破碎,分别收集上清和沉淀进行15%SDS-PAGE分析。蛋白胶经Image Lab 3.0软件分析,条带检测灵敏度设置为25。
1.8 重组2EDⅢ蛋白特异性鉴定 采用Western blot法。将重组2EDⅢ蛋白经15% SDS-PAGE 分离后,转移至NC 膜上(转膜条件:18 V,18 min),用10%小牛血清室温封闭30 min;加入TBEV 全病毒小鼠血清多克隆抗体(1∶1 000 稀释),4 ℃孵育过夜;PBST 洗涤3 次,每次5 min,加入HRP 标记山羊抗小鼠IgG(1∶5 000 稀释),室温孵育1 h;PBST 洗涤5 次,每次5 min,DAB显色。
1.9 重组2EDⅢ蛋白的纯化 收集诱导表达后菌液,4 ℃,10 000×g离心30 min;收集菌体,按照1∶10(W/V)比例,用50 mmol/L Tris-HCl(pH 8.0)缓冲液重悬后,800 bar条件下匀质3次;10 000×g离心30 min;收集沉淀(即包涵体),用含8 mol/L 尿素(pH 8.0)的Tris-HCl 重悬,4 ℃放置过夜;用0.45 μm 滤膜抽滤,收集滤液。采用AKTA 纯化系统进行镍离子金属鳌和亲和层析纯化,经3个体积的50 mmol/L Tris-HCl(pH 8.0)平衡Ni-NTA 介质,上样流速为1 mL/min,用含50、100、300 mmol/L 咪唑的洗脱液梯度洗脱目的蛋白,收集洗脱峰,进行15%SDS-PAGE分析。
1.10 多克隆抗体的制备 将纯化后的2EDⅢ蛋白作为免疫原,按照1 mg/只的剂量与等体积弗氏完全佐剂乳化后,经背部多点免疫2 只新西兰大白兔;2周后进行加强免疫(改用弗氏不完全佐剂乳化),共4次,每次间隔1周,前3次为0.5 mg/只,经背部多点注射,末次2 mg/只(不含佐剂),经耳缘静脉注射。于末次免疫3 d后采血,分离血清,即为多克隆抗体。设免疫前血清为阴性对照。
1.11 多克隆抗体效价的检测 采用间接ELISA 法。以浓度为10 μg/mL 纯化后的2EDⅢ串联抗原包被酶标板,100 μL/孔;加入10倍系列稀释的兔抗2EDⅢ多克隆抗体,设免疫前兔血清为阴性对照,37 ℃孵育2 h;PBST 洗涤3 次,加入HRP 标记的山羊抗兔IgG(1∶8 000 稀释),37 ℃孵育30 min;PBST 洗涤5次,TMB显色,上酶标仪于450 nm波长处测定A值。
1.12 多克隆抗体特异性鉴定 采用Western blot法。将浓度为0.1 mg/mL 纯化后的2EDⅢ、0.8 mg/mL TBEV“森张”株灭活全病毒原液、0.2 mg/mL乙型脑炎灭活全病毒疫苗上样,20 μL/孔,经15%SDS-PAGE分离后,转移至NC 膜上,用含10%血清的PBS 封闭液室温封闭30 min;加入兔抗2EDⅢ多克隆抗体(1∶1 000稀释),4 ℃孵育过夜;PBST洗涤3次,每次5 min,加入HRP 标记的山羊抗兔IgG(1∶5 000 稀释),室温孵育1 h;DAB显色。
1.13 黄病毒EDⅢ氨基酸序列比对 利用DNAMAN软件,对GenBank登录的TBEV“森张”株(JQ650523.1)、日本脑炎病毒(Japanese encephalitis virus,JEV)(AAA-21436.1)、登革病毒(Dengue virus,DENV)(QXJ792-36.1)及黄热病病毒(yellow fever virus,YFV)(AGO-04419.1)EDⅢ氨基酸序列进行比对,分析同源性。
1.14 数据采集及分析 利用Image lab 软件采集数据,DNAMAN软件处理数据。
2 结果
2.1 目的基因扩增产物的鉴定EDⅢ基因扩增产物经1%琼脂糖凝胶电泳分析,在255 bp处可见特异性条带,大小与理论值相符;2EDⅢ融合基因扩增产物经1%琼脂糖凝胶电泳分析,在555 bp处可见目的条带,大小与理论值相符。见图1。
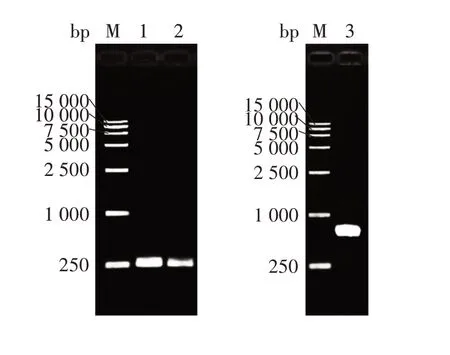
图1 EDⅢ基因及二聚体串联融合基因2EDⅢPCR 产物电泳图Fig.1 Electrophoretic profile of PCR products of EDⅢgene and dimer tandem fusion gene 2EDⅢ
2.2 重组质粒pET-28a-2EDⅢ的鉴定 质粒的双酶切(SacⅠ/HindⅢ)产物经1%琼脂糖凝胶电泳分析,可见550 bp 的目的基因条带和约5 350 bp 的载体条带,大小与理论值相符,见图2。测序结果表明,扩增序列与GenBank中登录的TBEV“森张”株(JQ650523.1)序列一致。表明质粒构建正确。

图2 重组质粒pET-28a-2EDⅢ的双酶切(SacⅠ/HindⅢ)鉴定Fig.2 Restriction map of recombinant plasmid pET-28a-2EDⅢ(SacⅠ/HindⅢ)
2.3 表达产物的鉴定 15%SDS-PAGE 分析显示,表达的重组2EDⅢ蛋白相对分子质量约21 000,大小与理论值相符,主要以包涵体形式存在,见图3。经ImageLab 3.0 软件分析,蛋白表达量约占菌体总蛋白的41.3%,见图4。
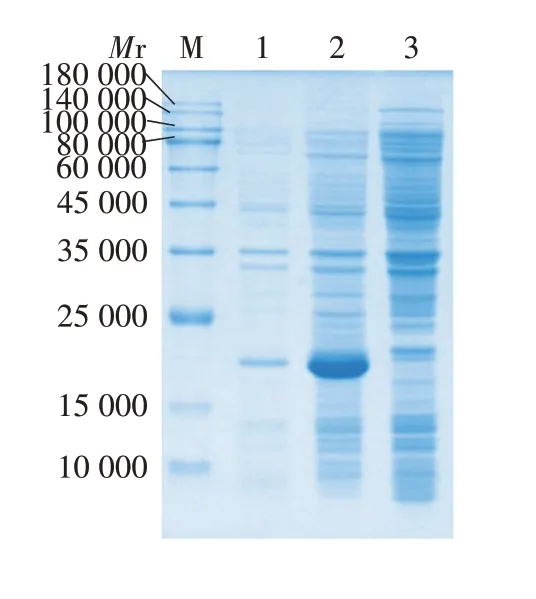
图3 表达的重组2EDⅢ蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of expressed recombinant protein 2EDⅢ

图4 重组2EDⅢ蛋白表达量的分析Fig.4 Analysis of recombinant protein 2EDⅢexpression
2.4 重组2EDⅢ蛋白的特异性 Western blot 分析显示,重组2EDⅢ蛋白可与TBEV 全病毒小鼠血清多克隆抗体发生特异性反应,于相对分子质量约21 000处可见特异性条带,反应原性良好,且具有一定的生物学活性和抗原性,见图5。
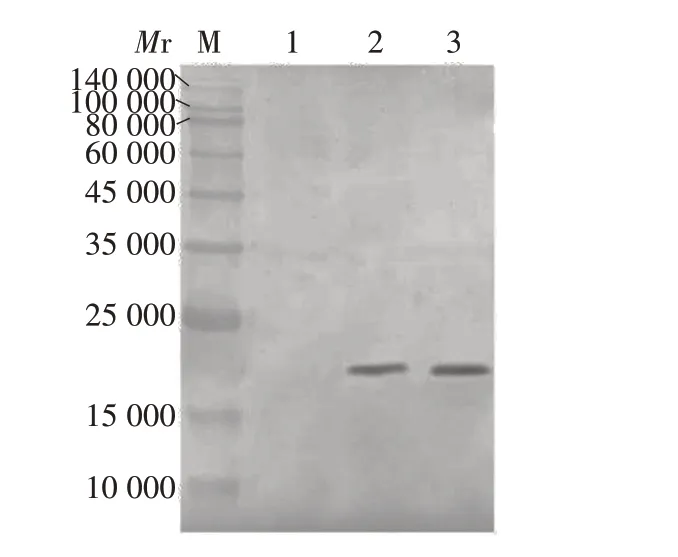
图5 重组2EDⅢ蛋白的的Western blot鉴定Fig.5 Western blot identification of recombinant protein 2EDⅢ
2.5 纯化产物的鉴定 纯化的重组2EDⅢ蛋白经15%SDS-PAGE分析,在相对分子质量约21 000处可见目的条带,见图6,纯度可达97.5%,见图7。
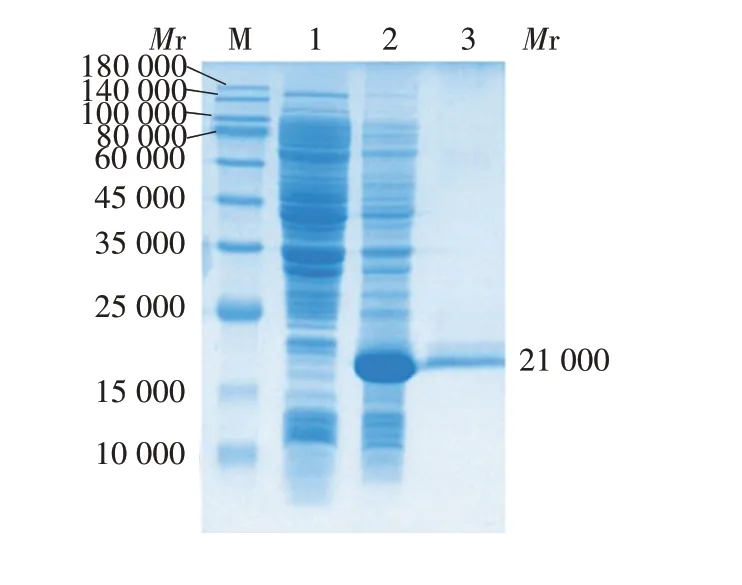
图6 纯化的重组2EDⅢ蛋白的SDS-PAGE分析Fig.6 SDS-PAGE analysis of purified recombinant protein 2EDⅢ
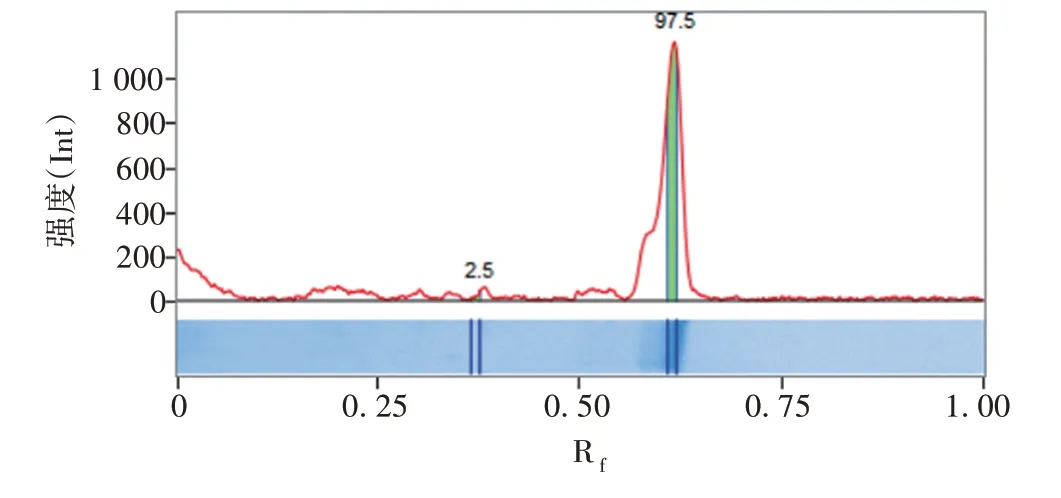
图7 纯化的重组2EDⅢ蛋白的纯度分析Fig.7 Purity analysis of purified recombinant protein 2EDⅢ
2.6 兔抗2EDⅢ血清多克隆抗体效价 间接ELISA结果显示,兔抗2EDⅢ血清多克隆抗体效价可达1∶107。
2.7 兔抗2EDⅢ血清多克隆抗体特异性 Western blot分析显示,兔抗2EDⅢ血清多克隆抗体可与2EDⅢ、TBEV灭活全病毒发生特异性反应,未与乙型脑炎灭活全病毒发生抗原交叉反应,抗原特异性良好,见图8。

图8 兔抗2EDⅢ血清多克隆抗体的Western blot鉴定Fig.8 Western blot identification of rabbit anti-2EDⅢserum polyclonal antibody
2.8 黄病毒EDⅢ氨基酸序列比对 经DNAMAN 比对,TBEV 与JEV、YFV、DENV EDⅢ氨基酸序列同源性分别为36.56%、9.28%和30.77%。EDⅢ氨基酸序列较保守区域相对分散且序列较短,存在多个高度保守的氨基酸位点。见图9。表明几种黄病毒EDⅢ氨基酸序列存在差异,TBEV EDⅢ具有较高特异性。

图9 黄病毒EDⅢ氨基酸序列的多序列比对Fig.9 Multiple sequence alignment of ED Ⅲamino acid sequences of flaviviruses
3 讨论
E 蛋白是TBEV 最重要的结构蛋白,作为主要包膜蛋白参与TBEV 与宿主靶细胞受体识别及膜融合等,在病毒入侵过程中可诱导宿主产生保护性体液免疫[4-5]。黄病毒属E 蛋白氨基酸序列高度保守但存在局部区域的多变性,其单个氨基酸的改变可导致病毒的毒力和融合活性改变;JULIANA 等[10]报道,TBEV E蛋白可与黄病毒属中的乙型脑炎病毒、DENV的抗血清发生交叉反应[11];而EDⅢ为TBEV 特异性抗原位点存在部位,具有较高特异性[12]。E 蛋白的晶体结构研究表明,DomainⅢ约100 个氨基酸,只有唯一一对二硫键稳定其免疫球蛋白样结构[7]。DomainⅢ垂直伸出病毒表面形成特有突起,使该区域成为TBEV 与受体结合的主要部位,因此DomainⅢ是决定病毒与受体结合的关键结构域,含有宿主细胞受体识别位点和多种型及亚型特异性的中和抗原表位。因此,TBEV 的EDⅢ可作为具有良好特异性的检测抗原[13]。DomainⅢ抗原抗体的制备在TBEV结构蛋白生物学功能研究、森林脑炎临床诊断、新型基因工程疫苗研发领域具有重要的应用价值。
通过将2 段重复EDⅢ编码基因串联构建并表达,制备串联重组蛋白2EDⅢ,经Western blot 分析,可与TBEV 全病毒小鼠血清多克隆抗体发生特异性反应,表明其与TBEV E 蛋白天然构象相似,具有良好的抗原性。考虑到EDⅢ相对分子质量(约10 000)较小,免疫小鼠时不能较好地刺激免疫反应[14],因此制备了高效价兔抗2EDⅢ血清多克隆抗体,该抗体可与TBEV 和2EDⅢ发生特异性反应,与乙型脑炎病毒不反应。氨基酸序列同源性分析显示,TBEV 与其他病毒EDⅢ同源性较低,因此EDⅢ可作为特异性良好的新型备选抗原。以上结果表明,该串联方法用于TBEV 2EDⅢ构建和应用具有较高的可行性。2EDⅢ可作为一种特异性TBEV 保护性抗原,在临床检测、疫苗评价、病毒结构蛋白功能研究中具有广阔的应用前景[15-17]。DomainⅢ特有的靶细胞的结合位点可诱导保护性体液免疫,阻止TBEV侵染靶细胞[14]。与单克隆抗体相比,多克隆抗体具有成本低、制备周期短、效果好等优点,且使用原核表达蛋白免疫动物制备多克隆抗体是最为常见的一种手段,在病毒的血清学治疗中广泛应用[18]。
DomainⅢ抗原抗体的制备在TBEV 结构蛋白生物学功能研究、新型基因工程疫苗研发领域具有重要应用价值,良好的特异性重组抗原,可为相关疾病临床血清学诊断和疫苗免疫学检验提供均一的易于标准化的抗原试剂;另外,特异性抗体的制备及制备方法也可为相关急性疾病的治疗提供参考。

