冷藏条件下肉源莓实假单胞菌nuoB对其生物被膜形成和细胞代谢的影响
吴亚婕,谭松,陈愉平,牛阿娟,柳雨欣,王光宇,徐幸莲,邱伟芬
冷藏条件下肉源莓实假单胞菌对其生物被膜形成和细胞代谢的影响
吴亚婕1,谭松1,陈愉平1,牛阿娟1,柳雨欣1,王光宇,徐幸莲2,邱伟芬1
1南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,南京 210023;2南京农业大学食品科技学院,南京 210095
【目的】研究对莓实假单胞菌生物被膜形成和细胞代谢的影响,进一步揭示对莓实假单胞菌介导的冷鲜肉腐败的调控机制,为优化冷鲜肉保鲜体系提供理论基础。【方法】以莓实假单胞菌NMC25野生株和突变株作为研究对象,利用共聚焦激光扫描显微镜(CLSM)观察生物被膜空间结构的差异;通过菌落细胞计数、胞外聚合物的表征解析生物被膜组分变化;基于超高效液相色谱联合质谱的非靶向代谢组学方法探寻与相关的代谢产物水平变化。【结果】CLSM显示,原位条件下野生株生物被膜细胞呈现密集排列、垂直化定殖的状态,而Δ生物被膜显示为相对无序、松散的结构。菌落中细胞计数结果显示,不同生长环境下的野生型菌株和突变型菌株的生物被膜细胞数量均无显著性差异,表明突变株在TSA或肉表面上以生物被膜形式生长的能力没有发生大的变化。与野生株相比,原位培养时突变株的蛋白质(<0.01)和总糖(<0.05)含量都显著升高,表明影响了莓实假单胞菌胞外聚合物的分泌。代谢组结果显示,野生组与突变组在正交偏最小二乘法判别分析模型中有明显的分离(2X=0.481,2Y=0.977,Q2=0.909),说明原位培养时突变株的代谢产物发生了明显变化。模型中组间差异显著的代谢物包括2-羟基肉桂酸、L-酪氨酸、L-苯丙氨酸、DL-色氨酸、17-羟基-二十碳四烯酸、5-OxoETE等。这些代谢物经过通路分析后发现,它们主要与脂肪酸的生物合成、不饱和脂肪酸的生物合成、核黄素代谢、2-氧代羧酸代谢、嘌呤代谢、氰基氨基酸代谢、苯丙氨酸代谢等有关。【结论】的破坏会导致莓实假单胞菌原位培养时生物被膜空间结构发生变化,促进胞外聚合物的生物合成,影响细胞内碳代谢、核苷酸代谢、脂质代谢和氨基酸代谢。
莓实假单胞菌;;生物被膜;胞外聚合物;细胞代谢
0 引言
【研究意义】鲜肉中含有较高的水分活度以及丰富的营养物质,极易发生腐败变质[1],给食品产业及供应链造成了巨大的经济损失。除了非生物因素和内源性自溶酶反应,肉类的腐败主要由含异质细菌类群的复杂微生物动力学引起[2],其中假单胞菌属(spp.)作为重要的革兰氏阴性菌,具有适应低温、分解蛋白和脂肪的能力[3],是有氧储藏条件下导致冷鲜肉腐败变质的优势菌属[4]。在该属中,莓实假单胞菌()广泛存在于有氧条件下的冷鲜鸡肉[5]、牛肉[6-7]和水产品[8]等中,能够在肉中快速生长,活跃地参与分解代谢,进而导致肉品感官品质的下降[9-10]。在前期研究中,笔者团队从腐败的冷鲜鸡肉中分离出了强致腐NMC25,并研究了该分离株的插入失活突变株在原位培养时致腐能力的变化,结果显示突变株所引起的冷鲜鸡肉腐败特征减弱,表明在导致的腐败进程中起到重要作用[11],但具体的作用机理尚不清楚。因此,深入了解如何在分子水平上调节细菌腐败能力至关重要。【前人研究进展】复合体I(complex I)是NADH的电子进入大多数线粒体和许多细菌呼吸链的主要入口,在细胞能量代谢和维持细胞内氧化还原平衡中起着重要作用。虽然它在真核生物线粒体呼吸链背景下的作用已被广泛研究[12-13],但对其在细菌中所起到的生理作用却缺乏系统研究。在细菌门中,复合体I的共同作用是重新氧化NADH,从而维持细胞的氧化还原状态。同时,细菌复合体I能够作用于不同菌群的一系列生长条件和代谢过程[14]。编码的NuoB亚基是组成复合体I的14个不同蛋白质亚基之一[15]。在真核生物线粒体复合体I中,相应基因的缺失通常会阻碍复合体的成熟[16];而在细菌中,组装NADH脱氢酶片段至少需要NuoB存在[17]。FLEMMING等[18]通过构建缺少70%阅读框的突变株和分析d-NADH氧化酶活性、d-NADH/铁氰化物还原酶活性的变化,判断出的缺失会阻止整个复合体I的组装以及功能的正常发挥。SCHNEIDER等[19]利用插入打断法破坏大肠杆菌的、等基因后,发现任何基因的失活都会导致膜中复合体I活性的丧失,阻止功能性复合体的产生或组装。PRÜSS等[20]研究发现在胰蛋白胨肉汤中培养时,大肠杆菌突变株细胞在生长后期生长缓慢,因为NADH dhⅠ缺乏的细胞会积累NADH,而且较大的NADH/NAD+比值会抑制柠檬酸合酶和苹果酸脱氢酶的变构作用,影响突变细胞对氨基酸的利用。这些发现表明可能会通过对复合体I功能的影响而改变细菌的生理代谢活动。【本研究切入点】虽然前期研究表明,的破坏导致了的部分生物学特性和原位致腐能力的改变,但冷鲜肉腐败过程中该基因对细胞代谢活动的影响规律尚不明确,仍需在分子水平上进行系统性研究。【拟解决的关键问题】以强致腐NMC25及其突变株为研究对象,分析对生物被膜空间结构和基质成分的影响,并基于超高效液相色谱联合质谱的非靶向代谢组学方法确定与破坏相关的代谢产物水平变化,以更好地阐明的对其生存和致腐效应的影响,完善致腐机制的科学理论。
1 材料与方法
试验于2021年在南京财经大学食品科学与工程学院国家重点实验室和南京农业大学国家肉品质量安全控制工程技术研究中心进行。
1.1 材料与试剂
从腐败的冷鲜鸡肉中分离到的NMC25菌株以及构建的Δ插入失活突变株由笔者研究团队收集保存[21]。胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)购自青岛海博生物技术有限公司;硝酸纤维素膜购自上海兴亚净化材料厂;BCA蛋白定量试剂盒购自南京诺唯赞生物科技股份有限公司;LIVE/DEAD™ BacLight™ Bacterial Viability Kit购自美国 Invitrogen公司;冷鲜鸡大胸购自南京市苏果超市。
1.2 仪器与设备
GI54DP高压灭菌锅(致微,厦门);SW-CJ-2FD超净工作台(AIRTECH,苏州);SHP-350生化培养箱(精宏,中国);TCS SP8 X激光扫描共聚焦显微镜(Leica,德国);SpectraMax M5多功能酶标仪(Molecular Devices,美国);Vanquish UHPLC system,Orbitrap Q Exactive TM HF-X mass spectrometer超高效液相色谱-质谱联用仪(Thermo Fisher,德国)。
1.3 方法
1.3.1 生物被膜形成及样品制备生物被膜的形成与样品制备参照FENG等[22]的方法并稍作修改,具体步骤如下:将NMC25与Δ突变株接种于TSB中,28 ℃、150 r/min过夜培养至稳定期。取上述稳定期菌液稀释,调整菌液浓度约为5 log CFU/mL。将0.22 μm硝酸纤维素膜分别放置在已辐照灭菌的10 g鸡胸肉切片和TSA平板上,表面接种100 μL制备好的菌液,于8 ℃下培养4 d。对放置于TSA平板上的硝酸纤维素膜,每24 h无菌转移至新的琼脂平板上。
1.3.2 菌落中细胞总数的测定 上述样品培养4 d后,使用一次性塑料接种环收集在膜上形成的生物被膜,并转移到含有1 mL 0.9%生理盐水的无菌试管中用于计数。称量增重后,剧烈涡旋1 min。吸取100 μL涡旋后的上清液进行10倍梯度稀释,选取合适的梯度用一次性涂布棒将100 μL菌液涂布于TSA平板上,28 ℃下培养24 h后计数,每组重复4次。
1.3.3 共聚焦激光扫描显微镜(CLSM)观察 参考PANG等[23]的方法通过CLSM观察原位培养时生物被膜的空间结构。在室温避光条件下,将3 μL来自LIVE/DEAD™ BacLight™ Bacterial Viability Kit的SYTO 9荧光染色剂和PI荧光染色剂(1﹕1)混合物加入到1 mL的无菌生理盐水中并混合均匀。然后,将带有已形成生物被膜的硝酸纤维素膜从无菌鸡胸肉切片或琼脂平板转移到无菌培养皿中,并将100 μL的上述染液沉积在试样上,室温下避光培养30 min。生理盐水洗涤3次以去除多余染料后,将试样斑点面朝下放置在玻璃底皿(20 mm/35 mm)中观察。使用倒置的CLSM观察图像,用10倍物镜扫描表面总面积,选出3个有代表性的区域。然后使用63×油浸物镜,以600 Hz扫描获得图像。在498—567 nm范围内收集SYTO9的绿色荧光信号,在567—689 nm范围内收集PI的红色荧光信号。使用莱卡共聚焦软件分析生物被膜图像。
1.3.4 胞外聚合物(EPS)的提取与分析 将如上所述得到的生物被膜重悬于含有0.9%生理盐水的离心管中,调整菌悬液浓度约为3 mg菌体湿重/mL,涡旋混匀。将菌悬液12 000×离心10 min,得到上清液,用0.22 μm孔径的滤器过滤灭菌,过滤后用于检测胞外聚合物的含量。
参照BCA蛋白质分析试剂盒说明书分析提取的胞外聚合物蛋白质浓度。使用苯酚硫酸法[24]测定碳水化合物含量,具体如下:准确称取104 ℃烘干的葡萄糖10 mg于100 mL容量瓶中,加水至刻度处,混匀。分别吸取0、0.2、0.4、0.6、0.8和1.0 mL的葡萄糖溶液,各加蒸馏水补至2.0 mL,然后加入1 mL 6%苯酚及5 mL浓硫酸,摇匀冷却,室温放置20 min后在96孔细胞培养板于490 nm波长下测吸光度。其中,用2.0 mL蒸馏水代替葡萄糖溶液,按照同样的显色操作作为空白,横坐标为总糖(μg),纵坐标为吸光度值,得到标准曲线。随后进行样品含量测定,吸取2.0 mL胞外聚合物样品,然后加入6%苯酚1.0 mL及浓硫酸5.0 mL,摇匀冷却,室温放置20 min,最后将培养板置于酶标仪中,在490 nm测定吸光度。使用上述标准曲线计算总糖含量。在测定蛋白质和总糖含量时,每个处理设置4个重复。
1.3.5 代谢组学样本的制备 按照1.3.1制备原位培养样品并使用一次性塑料接种环收集菌体到1 mL 0.9%生理盐水中混匀。将细胞悬浮液低温离心10 min(12 000×,4 ℃)后收集沉淀用于代谢组学分析。通过涡旋将预冷的80%甲醇和0.1%甲酸与EP管中的细胞颗粒混合。将混合物放入液氮中速冻5 min,冰上融化后涡旋30 s,超声6 min。然后将样本放入4 ℃离心机中,5 000 r/min离心1 min,取上清液到新离心管,冻干成粉末,并溶解于10%甲醇溶液中,随后用于UHPLC-MS/MS系统分析。为了监测数据的稳定性和可靠性,从每个试验样本中取等体积样本混匀作为质量控制(QC)样本。每组试验设置6个重复。
1.3.6 UHPLC-MS/MS分析 色谱条件:Hypesil Gold(C18)色谱柱(100 mm×2.1 mm,1.9 μm);柱温40 ℃;流速0.2 mL∙min-1;在正电离模式下,0.1%甲酸和甲醇作为流动相A和B,而在负电离模式下,5 mmol∙L-1醋酸铵(pH 9.0)和甲醇作为流动相A或B;流动相梯度洗脱程序见表1。
质谱条件:质谱扫描范围,质荷比(m/z)为100— 1 500;电喷雾电压3.2 kV;鞘气流速40 arb;辅助气流速10 arb;毛细管温度保持在320 ℃。
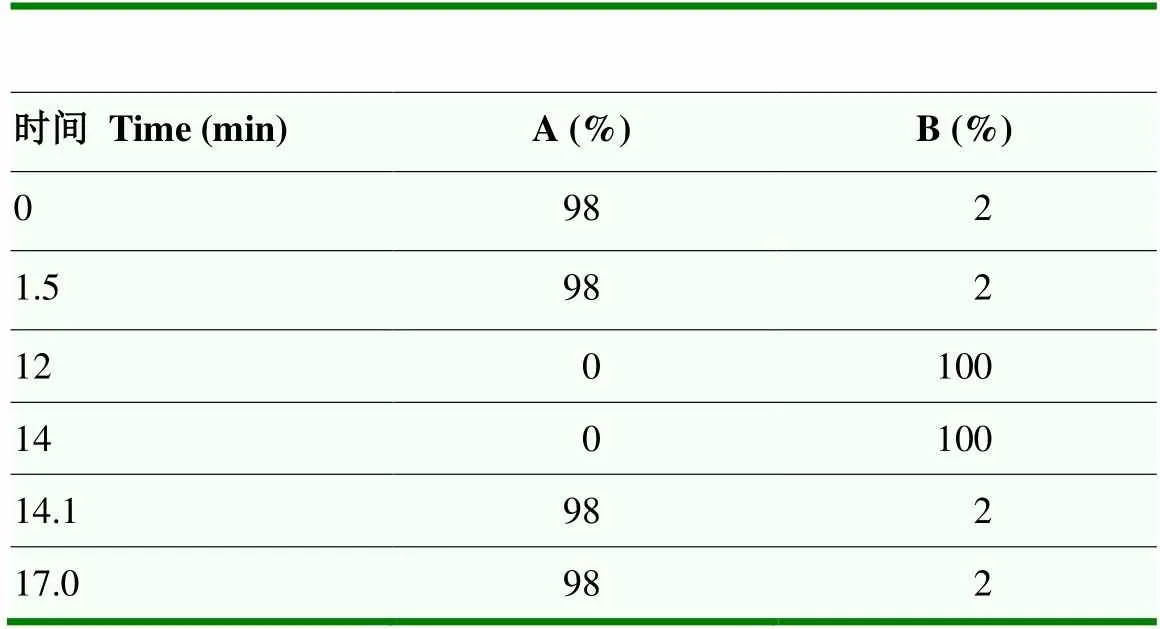
表1 流动相梯度洗脱程序
1.3.7 数据处理 使用Compound Discoverer 3.1软件(Thermo Fisher)对UHPLC-MS/MS导出的数据进行提取和预处理,然后通过分子离子峰和碎片离子预测分子式并与mzCloud(https://www.mzcloud.org/)、mzVault和Masslist数据库比对,获得准确的定性和相对的定量结果;利用统计软件R 3.4.3、Python 2.7.6和CentOS 6.6对所得数据进行多元统计学分析,根据正交偏最小二乘法判别分析(OPLS-DA)模型中的变量投影重要性(VIP)和值筛选出差异代谢物。最后,将差异代谢物通过KEGG数据库(https://www. kegg.jp/)比对并注释。
2 结果
2.1 nuoB对P. fragi生物被膜空间结构的影响
为了探究对的固气界面生物被膜形成的影响,对NMC25及突变菌株的大菌落生物被膜进行观察(图1)。在TSA培养2 d后,可以明显看出所有菌株都形成了比较完整的薄层生物被膜,并且随着培养时间的推移,细菌细胞逐渐向上扩散,生物被膜厚度增加。其中,经每24 h无菌转移的各基因型菌株生物被膜的菌落中心厚度都明显高于相对应的不进行转移的对照组。在不同生长基质上,野生型菌株与Δ菌株形成的生物被膜的厚度在视觉上几乎一致。另一方面,与TSA上培养的生物被膜相比,原位培养形成的NMC25和Δ生物被膜的厚度下降,表面粗糙度升高,并且菌落边缘明显高于中心。

对照:TSA培养时不进行转移的生物被膜被视为对照;A:P. fragi NMC25生物被膜;B:ΔnuoB生物被膜
在此基础上,利用CLSM进一步探明在不同培养基上生长的NMC25和Δ生物被膜细胞分布和存活情况,以评估生物被膜空间结构的变化(图2)。结果显示,与TSA培养相比,原位培养的所有菌株生物被膜的厚度都明显减少,这与上述肉眼观察结果一致。在不同生长环境下,NMC25生物被膜的厚度均略高于突变株。在TSA上培养时,野生株和突变株都形成了严密有序的生物被膜,大多数细菌细胞在垂直于硝酸纤维素膜表面的方向上排列;而原位培养时,Δ生物被膜显示出相对杂乱的松散结构,细胞在菌落中无序分布。
2.2 nuoB对P. fragi生物被膜的生物量及胞外聚合物成分的影响
在8 ℃培养4 d后,两组鸡胸肉切片或TSA上的细胞总数均在9 log CFU/colony以上;不同生长基质上,野生株和Δ突变株的生物被膜细胞数量均无显著差异,说明突变株在TSA或鸡肉上的生物被膜细胞的数量没有发生较大变化。如表2所示,肉样上突变株的蛋白质(<0.01)和总糖(<0.05)含量都显著高于野生株;对于TSA上的胞外聚合物,Δ生物被膜中蛋白质的分泌量显著增加(<0.01),蛋白质与糖含量比例显著高于野生组(<0.01),而两组的总糖含量无显著差异,说明在体外或原位培养时突变株生物被膜基质的分泌都会受到的影响。此外,所有菌株于原位培养时的蛋白质含量均高于碳水化合物含量,而在TSA培养时则情况相反。

绿色细胞代表活细胞,红色细胞代表死细胞。A:原位培养时,NMC25的生物被膜空间结构;B:原位培养时,ΔnuoB的生物被膜空间结构;C:TSA上培养时,NMC25的生物被膜空间结构;D:TSA上培养时,ΔnuoB的生物被膜空间结构
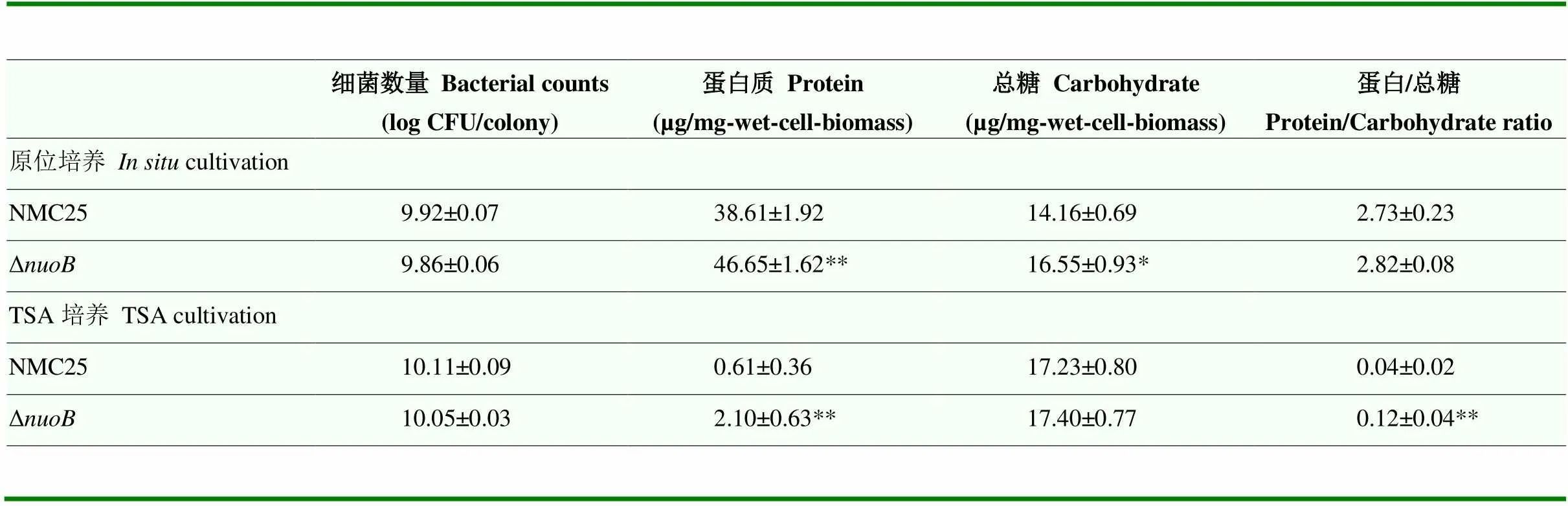
表2 不同生长环境下两株P. fragi生物被膜的细胞计数和胞外聚合物分析结果
原位培养或TSA培养中同一列数据表示野生组和突变组的差异显著(*:<0.05;**:<0.01)
Within the same culture condition (or TSA cultivation), the asterisk indicates significant differences between the NMC25 group and Δgroup (*:<0.05; **:<0.01)
2.3 nuoB对P. fragi细胞代谢的影响
图3显示,两组分别位于第一主成分(t1)轴垂直线的两侧,有明显的分离(2X=0.481,2Y=0.977,2=0.909),说明原位培养时Δ突变株的代谢产物发生了明显改变。得分图提供了不同组间的分组信息,而载荷图有助于找出对比较组间代谢物模式变化贡献最大的代谢物。如图3-B所示,对组间差异贡献较大的代谢产物包括17-羟基-二十碳四烯酸(17(S)-HETE)、5-酮咯-6E,8Z,11Z,14Z-丁烯酸(5-OxoETE)、肌酸(Creatine)、亚精胺(Spermidine)、D-(+)-高脯氨酸(D-(+)-Pipecolinic acid)、L-赖氨酸和丁酸(1﹕1)的复合物(Lysine Butyrate)、2-羟基肉桂酸(2-Hydroxycinnamic acid)、L-苯丙氨酸(L-Phenylalanine)、L-酪氨酸(L-Tyrosine)等。OPLS-DA模型置换检验的结果见图3-C,2回归直线的y轴上截距值为负数,表明OPLS-DA模型在本研究中未过度拟合,适用且可靠。
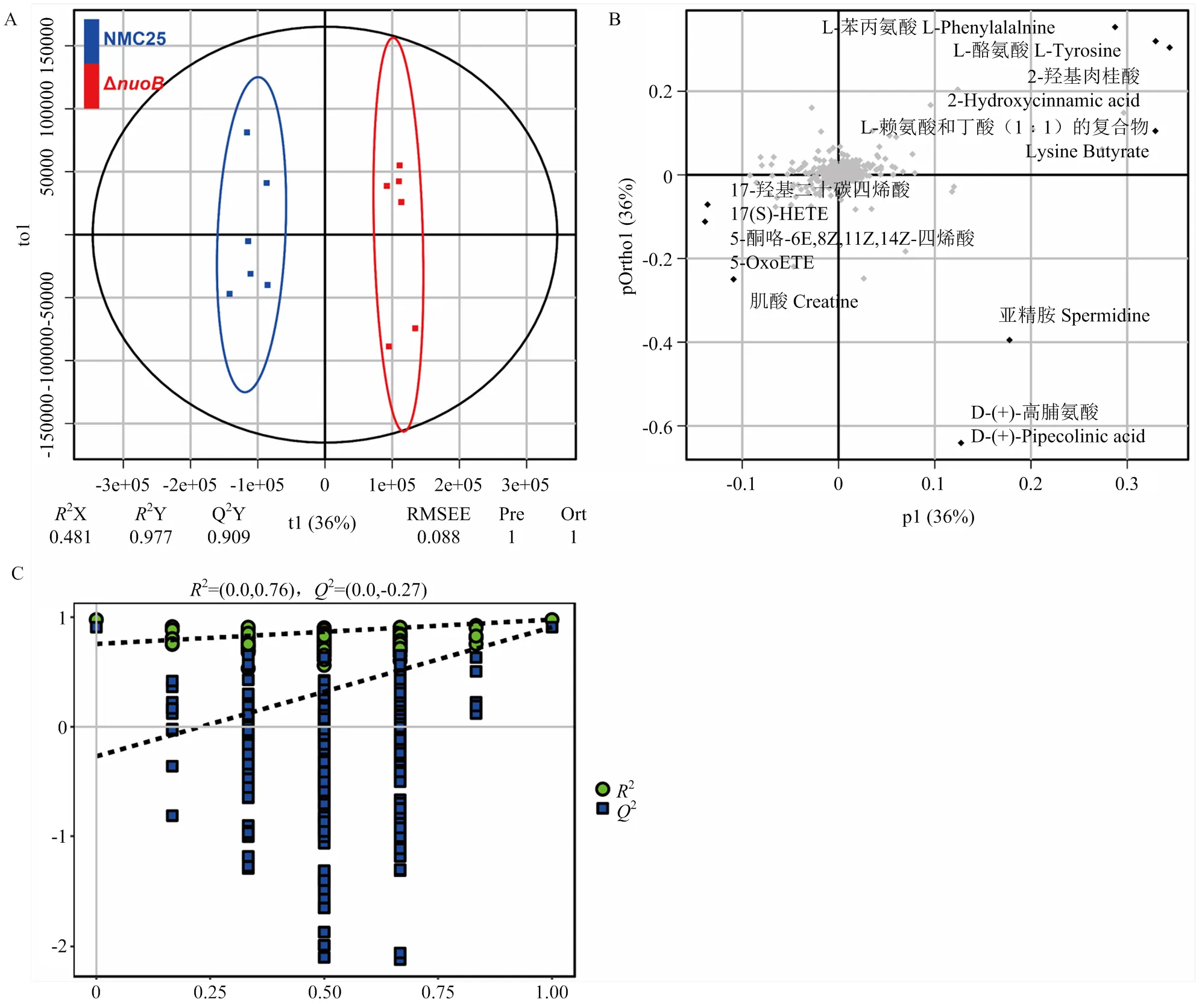
图3 基于P. fragi野生组和突变组间的OPLS-DA得分图(A)、载荷图(B)和置换检验图(C)
为了进一步筛选与突变相关的关键代谢物,计算OPLS-DA模型中变量投影的重要性。基于代谢物的相关系数、VIP、差异倍数(FC)和值生成的火山图(图4-A),其中VIP>1,检验<0.05的代谢物被认为具有统计学意义。在原位培养的Δ突变菌株中,比较分析发现有29种代谢物显著上调,22种代谢物显著下调。与野生组相比,Δ组的2-羟基肉桂酸、L-酪氨酸、L-苯丙氨酸、DL-色氨酸等明显增加,而17-羟基-二十碳四烯酸、5-酮咯-6E,8Z,11Z,14Z-丁烯酸、油酸酰胺、3-甲基组氨酸等代谢产物则呈现相反的趋势(图4-B)。
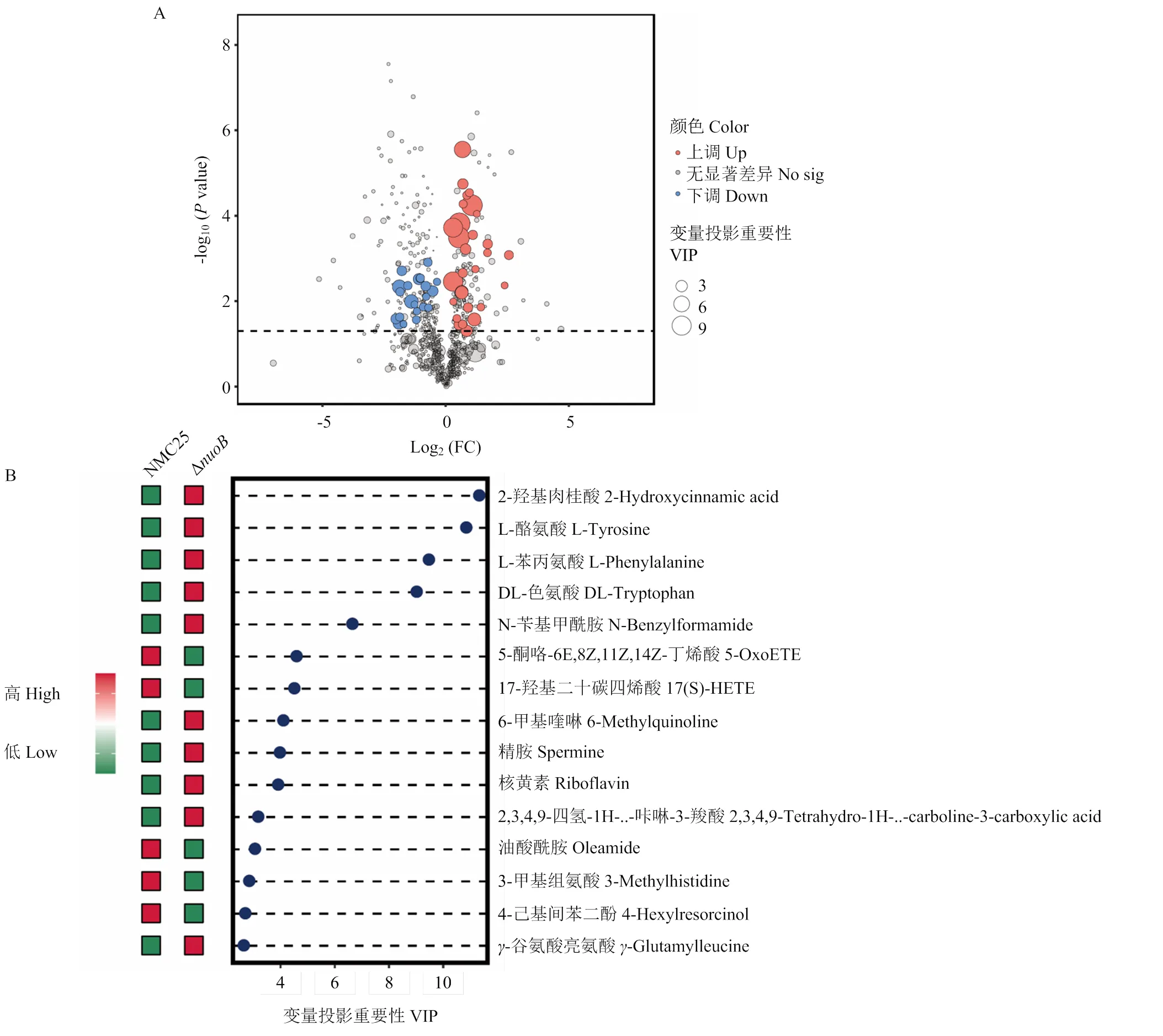
图4 基于P.fragi野生株和nuoB突变株代谢产物的火山图(A)和排名前15位重要特征代谢物的VIP分数图(B)
根据所鉴定出的显著差异代谢物进行路径分析,以确定与相关的代谢活动(图5)。总共涉及43条通路,其中2条途径具有显著意义(<0.05),即脂肪酸的生物合成和不饱和脂肪酸的生物合成。此外,的破坏主要影响的通路还有核黄素代谢、2-氧代羧酸代谢、嘌呤代谢、氨酰tRNA生物合成和一些氨基酸代谢,包括氰基氨基酸代谢,苯丙氨酸代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,组氨酸代谢等。图6概述了的破坏导致NMC25主要代谢途径代谢产物的变化。

图5 野生组/突变组前20位代谢通路气泡图
3 讨论
目前,与肉品腐败相关的研究多注重于关联微生物种类、数量和腐败特征[25-26],而冷鲜肉中的特征优势腐败菌与致腐相关基因的调控关系在很大程度上仍然未知,这限制了对肉源假单胞菌致腐能力相关调节因子的理解。NuoB是细菌能量生产过程中至关重要的复合体I的重要组成部分,它所对应基因的缺失会导致NADH脱氢酶活性的丧失,细菌生长策略可能因此发生改变,失活的NADH脱氢酶将重新调配代谢通量以维持细胞内NADH/NAD+池的氧化还原平衡[27]。
3.1 nuoB影响P. fragi生物被膜的空间结构
生物被膜是微生物群落一种常见的存在形式,它的形成是食品污染的常见来源。在肉品工业常使用的冷藏温度范围内,能于原位条件下形成生物被膜,为低温逆境中的生存与竞争提供支持[28]。本研究中,使用硝酸纤维素膜作为固气界面生物被膜形成的基质,以便观察肉上生物被膜的完整结构。肉眼观察显示原位形成的生物被膜生长边缘高于菌落中心处的表面。研究发现,生物被膜中的细胞分裂通常发生在菌落的边缘,到达边缘的细菌可以优先获得营养和空间[29-30],这可能是细菌细胞聚集在生物被膜边缘的原因。另外,肉片上NMC25和Δ生物被膜的厚度明显低于TSA上对应的生物被膜厚度,而粗糙度则呈相反趋势。这种变化可能与基质的营养成分和细菌对环境适应性的不同有关。同时,有研究表明生物被膜的物理特性,如表面粗糙度等,在细菌生物被膜对各种应激条件的响应中起重要作用[31-32]。生物被膜表面越光滑,受机械剪切力的影响就越小[22]。CLSM能够在不影响微生物组成的情况下可视化生物结构[33],因此,本研究利用CLSM观察到了野生株与突变株的生物被膜空间结构。结果显示,野生株形成了严密有序、排列均匀的空间结构,这与WICKRAMASINGHE等[34]的研究结果一致。其中,细菌细胞垂直化的现象可能是由于细胞快速生长产生的有效表面压力超过了细胞与表面的粘附。微生物控制生物被膜抵抗外来物种入侵的一个关键性因素是它的紧致性[35-36]。因此,试验中发现的野生株生物被膜的空间结构将有助于阻止其他微生物入侵,这可能是它在有氧储存肉品中长期占据优势地位的原因之一。此外,研究发现原位培养时突变株的排列与野生株相比相对杂乱、疏松,表明的破坏影响了肉源的生物被膜空间结构。细菌运动在生物被膜形成过程中必不可少[37]。操纵子此前已被证明在生物被膜形成过程中被激活,对调节生物被膜的形成和运动至关重要[38]。研究发现,中的经插入打断后,菌株的swimming泳动能力明显下降[11],这可能是Δ生物被膜空间结构杂乱无序的原因之一。

标记代谢物的颜色代表与野生组相比,其在ΔnuoB组中的浓度高低(VIP>1,P<0.05),绿色表示较低水平,红色表示较高水平。代谢物旁向上和向下的箭头则分别表示除差异代谢物外的增加和减少(|lg2FC|>0.58或VIP>1)。黑色无箭头的代谢物在野生组和突变组中的含量无显著差异,未检测到的代谢物用斜体表示
3.2 nuoB影响P. fragi胞外聚合物的分泌
生物被膜代表了一种相当复杂的多细胞细菌系统,其特征是具有较高的细胞数量与密度以及产生细胞外聚合物质基质[39-40]。本研究中,不同生长环境下的野生株与突变株的生物被膜细胞数量均无显著差异,细菌总数都超过了9 log CFU/colony,表明8 ℃培养4 d后的野生株与突变株都已形成了成熟的生物被膜。这种现象可能是突变株充分利用肉中丰富的营养物质与调节能量代谢的结果。细菌的细胞外聚合物主要包括胞外多糖、蛋白质、脂类和eDNA,其中的每个成分都对维持生物被膜的结构和稳定性做出了巨大贡献[41]。在假单胞菌中,EPS中大量的胞外多糖和蛋白质与高生物量和强粘附性相关[42]。本研究发现,原位培养时野生株产生的胞外聚合物含量显著低于突变株,因此,推测的破坏可能导致加强对肉表面的粘附,通过水解酶的渗透获取肉中丰富的营养。此外,野生株中低水平的胞外基质可能会促进染色剂的进入,导致在CLSM观察时野生株的生物被膜厚度增加。研究表明,除了微生物的存在外,环境条件也显著影响胞外聚合物的产生[43]。试验中发现体外培养时野生株与突变株的总糖含量无显著差异,且均高于对应的蛋白质含量,这与原位培养时的趋势相反。这种现象的产生可能与各培养基质提供的营养成分不同有关。
3.3 nuoB影响P. fragi的细胞代谢
代谢组学是一种能够揭示分子调控机制下大量代谢产物变化的系统方法,提供了对细胞生理信息的全面理解[44]。近年来,与基因突变相关的代谢组学研究成功揭示了这些基因在细菌中的相关作用[45-46]。本研究通过分析不同表达的代谢物发现,它们主要涉及了碳代谢、核苷酸代谢、脂质代谢、氨基酸代谢4种途径。SPERO等[14]研究表明细菌中的复合体I对TCA循环产生的NADH在氧化过程可能有广泛的作用,并预测缺乏复合体I的细菌可能会使用改良版TCA循环为细胞提供重要的生物合成前体,同时产生较少的还原剂或使用其他类型的还原剂。本研究发现,在Δ组中检测到的苹果酸、柠檬酸、琥珀酸以及NADH的浓度没有发生显著性变化,而NAD+含量显著性增加,因此,推测突变株可能使用其他酶或策略来保持细胞氧化还原状态。此外,突变株中的磷酸烯醇式丙酮酸、1,6-二磷酸果糖和6-磷酸葡萄糖的含量均高于野生株,表明突变株中的糖酵解代谢可能更活跃。在枯草芽孢杆菌中,半乳糖代谢在生物被膜的形成中起着至关重要的作用,因为二磷酸尿苷半乳糖可用于EPS的合成[47]。但本研究中二磷酸尿苷半乳糖在突变组中的含量升高,这可能是原位培养时突变株EPS含量显著高于野生株的原因之一。
嘌呤和嘧啶不仅是核酸的含氮碱基,而且在ATP、GTP、环单磷酸腺苷、NADH和辅酶A中也能作为能量载体分子发挥作用[48]。本研究中,突变株中大部分核苷酸及其衍生物的含量增加,包括腺嘌呤、次黄嘌呤、黄嘌呤、尿嘧啶、UMP、dAMP和IMP等。这可能是由于核苷酸代谢增强,导致合成DNA和RNA的能力升高。脂质不仅参与生化反应和信号通路,而且其组成的动态变化和空间分布也影响着细胞生物功能。本研究发现,突变组中的棕榈酸、硬脂酸、5-OxoETE、9-KODE等不饱和脂肪酸含量显著减少,LPE18:1和LPE18:4等磷脂的水平也下降,但作为饱和脂肪酸的癸酸含量增加。研究表明,细菌中膜流动性在调节物质跨膜运输和维持细胞生理活性方面起至关重要的作用[49],而它的维持在很大程度上取决于膜脂肪酸的组成,包括直链不饱和脂肪酸、饱和脂肪酸和支链脂肪酸[50]。同时,磷脂中脂肪酸链的长度和饱和度也会影响细胞膜的流动性[51]。因此,本研究推测Δ中细胞膜的流动性可能发生下降。此外,甜菜碱和胆碱在维持细胞结构和功能方面也发挥着重要作用[52]。本研究中,突变株内的甜菜碱和胆碱水平上升,说明Δ细胞可能需要它们的支持来修复细胞损伤,维持细胞膜的完整性。
氨基酸是蛋白质的主要组成部分,在调节机体能量和蛋白质代谢以及抗应激方面发挥着十分重要的作用[53]。在本研究中,突变组内的鹅肌肽含量显著上调,表明突变株可能加强了对鸡肉中鹅肌肽的利用。芳香族氨基酸作为一些抗氧化剂的生物合成前体,在环境胁迫下,它的增加能够为细胞提供一些渗透保护功能。本研究发现,与野生株相比,Δ菌株中苯丙氨酸、色氨酸和酪氨酸含量显著增加,说明突变株可能通过调节芳香族氨基酸代谢来维持细胞内氧化还原平衡,增加对环境胁迫的抗力。此外,酪氨酸是合成酪醇的前体物质,还在细胞信息传递中发挥重要作用。有研究表明,在酵母细胞中酪醇能够促进细胞生长,增强菌株毒力[54]。因此,根据本研究中酪氨酸的显著上调推测其可能影响了酪醇的生物合成,进而有助于突变株的生长。在地衣芽孢杆菌[55]和枯草芽孢杆菌[56]中,谷氨酸作为聚-谷氨酸的重要前体,也被发现为生物被膜基质生产的必要氨基酸。本研究中,突变组内谷氨酸的浓度上升,可能与Δ生物被膜基质中胞外聚合物含量的增多有关。同时,有研究表明在单增李斯特菌中,氨基酸的生物合成与细菌的能量转导和代谢有关,因为谷氨酸等氨基酸能够通过底物水平磷酸化提供ATP[57]。因此,试验中发现谷氨酸含量的升高可能表明Δ菌株能通过底物水平磷酸化调节细菌能量代谢,维持自身的生命活动。鸟氨酸不仅是多胺等细胞增殖关键物质的重要原料,而且在尿素循环等代谢活动中发挥着重要作用[58]。另外,鸟氨酸还可以合成脯氨酸。本研究发现,突变株中鸟氨酸、精氨酸琥珀酸酯、脯氨酸、精胺和亚精胺含量增多,而突变组与野生组内精氨酸含量无显著差异,这表明的破坏促进了中多胺的生成和脯氨酸的积累,并且影响了菌体内部尿素循环的速率。而且脯氨酸具有保护细胞结构,参与生物体氧化应激反应等生理功能[59]。
4 结论
经插入打断后,原位培养时的生物被膜空间结构产生较大变化,基质内蛋白质和总糖含量显著增加,细胞代谢中的碳代谢、核苷酸代谢、脂质代谢、氨基酸代谢发生改变,表明在的生物被膜形成过程和细胞的各个代谢活动中发挥着重要作用。
[1] ODEYEMI O A, ALEGBELEYE O O, STRATEVA M, STRATEV D. Understanding spoilage microbial community and spoilage mechanisms in foods of animal origin. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2): 311-331.
[2] BOTTA C, FERROCINO I, CAVALLERO M C, RIVA S, GIORDANO M, COCOLIN L. Potentially active spoilage bacteria community during the storage of vacuum packaged beefsteaks treated with aqueous ozone and electrolyzed water. International Journal of Food Microbiology, 2018, 266: 337-345.
[3] CALDERA L, FRANZETTI L, VAN COILLIE E, DE VOS P, STRAGIER P, DE BLOCK J, HEYNDRICKX M. Identification, enzymatic spoilage characterization and proteolytic activity quantification ofspp. isolated from different foods. Food Microbiology, 2016, 54: 142-153.
[4] MOHAREB F, IRIONDO M, DOULGERAKI A I, VAN HOEK A, AARTS H, CAUCHI M, NYCHAS G J E. Identification of meat spoilage gene biomarkers inusing gene profiling. Food Control, 2015, 57: 152-160.
[5] WANG G Y, WANG H H, HAN Y W, XING T, YE K P, XU X L, ZHOU G H. Evaluation of the spoilage potential of bacteria isolated from chilled chickenand. Food Microbiology, 2017, 63: 139-146.
[6] MANSUR A R, SONG E J, CHO Y S, NAM Y D, CHOI Y S, KIM D O, SEO D H, NAM T G. Comparative evaluation of spoilage- related bacterial diversity and metabolite profiles in chilled beef stored under air and vacuum packaging. Food Microbiology, 2019, 77: 166-172.
[7] YANG X Y, ZHU L X, ZHANG Y M, LIANG R R, LUO X. Microbial community dynamics analysis by high-throughput sequencing in chilled beef longissimus steaks packaged under modified atmospheres. Meat Science, 2018, 141: 94-102.
[8] ZOTTA T, PARENTE E, IANNIELLO R G, DE FILIPPIS F, RICCIARDI A. Dynamics of bacterial communities and interaction networks in thawed fish fillets during chilled storage in air. International Journal of Food Microbiology, 2019, 293: 102-113.
[9] WICKRAMASINGHE N N, RAVENSDALE J, COOREY R, CHANDRY S P, DYKES G A. The predominance of psychrotrophic pseudomonads on aerobically stored chilled red meat. Comprehensive Reviews in Food Science and Food Safety, 2019, 18(5): 1622-1635.
[10] DE FILIPPIS F, LA STORIA A, VILLANI F, ERCOLINI D. Strain-level diversity analysis ofafterpangenome reconstruction shows distinctive spoilage-associated metabolic traits clearly selected by different storage conditions. Applied and Environmental Microbiology, 2019, 85(1): e02212- e02218.
[11] 王光宇, 李晴, 唐文倩, 王虎虎, 徐幸莲, 邱伟芬. nuoB对莓实假单胞菌生理特性及在冷鲜鸡肉中致腐能力的影响. 中国农业科学, 2021, 54(8): 1761-1771.
WANG G Y, LI Q, TANG W Q, WANG H H, XU X L, QIU W F. Effects of nuoB on physiological properties ofand its spoilage potential in chilled chicken. Scientia Agricultura Sinica, 2021, 54(8): 1761-1771. (in Chinese)
[12] HIRST J. Towards the molecular mechanism of respiratory complex I. Biochemical Journal, 2010, 425(2): 327-339.
[13] SHARMA L, LU J X, BAI Y D. Mitochondrial respiratory complex I: Structure, function and implication in human diseases. Current Medicinal Chemistry, 2009, 16(10): 1266-1277.
[14] SPERO M A, AYLWARD F O, CURRIE C R, DONOHUE T J. Phylogenomic analysis and predicted physiological role of the proton-translocating NADH: Quinone oxidoreductase (Complex I) across bacteria. MBio, 2015, 6(2): e00389-15.
[15] OPPERMANN S, SENG K, SHWEICH L, FRIEDRICH T. The gene order in the-operon is not essential for the assembly of.complex I. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2022, 1863(7): 148592.
[16] FORMOSA L E, DIBLEY M G, STROUD D A, RYAN M T. Building a complex complex: Assembly of mitochondrial respiratory chain complex I. Seminars in Cell & Developmental Biology, 2018, 76: 154-162.
[17] FRIEDRICH T, DEKOVIC D K, BURSCHEL S. Assembly of theNADH: ubiquinone oxidoreductase (respiratory complex I). Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2016, 1857(3): 214-223.
[18] FLEMMING D, HELLWIG P, FRIEDRICH T. Involvement of tyrosines 114 and 139 of subunit NuoB in the proton pathway around cluster N2inNADH: Ubiquinone oxidoreductase. Journal of Biological Chemistry, 2003, 278(5): 3055-3062.
[19] SCHNEIDER D, POHL T, WALTER J, DÖRNER K, KOHLSTÄDT M, BERGER A, SPEHR V, FRIEDRICH T. Assembly of theNADH: Ubiquinone oxidoreductase (complex I). Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2008, 1777(7/8): 735-739.
[20] PRÜSS B M, NELMS J M, PARK C, WOLFE A J. Mutations in NADH: Ubiquinone oxidoreductase ofaffect growth on mixed amino acids. Journal of Bacteriology, 1994, 176(8): 2143-2150.
[21] 王光宇. 气调包装对冷鲜鸡肉中莓实假单胞菌致腐效应的抑制机制[D]. 南京: 南京农业大学, 2018.
WANG G Y. Inhibition mechanism of modified atmosphere packaging on the rotting effect ofin chilled chicken [D]. Nanjing: Nanjing Agricultural University, 2018. (in Chinese)
[22] FENG J S, LAMOUR G, XUE R, MIRVAKLIKI M N, HATZIKIRIAKOS S G, XU J, LI H B, WANG S, LU X N. Chemical, physical and morphological properties of bacterial biofilms affect survival of encasedF38011 under aerobic stress. International Journal of Food Microbiology, 2016, 238: 172-182.
[23] PANG X Y, CHEN L, YUK H G. Stress response and survival ofEnteritidis in single and dual species biofilms withfollowing repeated exposure to quaternary ammonium compounds. International Journal of Food Microbiology, 2020, 325: 108643.
[24] WANG G Y, MA F, WANG H H, XU X L, ZHOU G H. Characterization of extracellular polymeric substances produced byunder air and modified atmosphere packaging. Journal of Food Science, 2017, 82(9): 2151-2157.
[25] ZHANG T, DING H, CHEN L, ZHANG S S, WU P F, XIE K Z, PAN Z M, ZHANG G X, DAI G J, WU H Q, WANG J Y. Characterization of chilled chicken spoilage using an integrated microbiome and metabolomics analysis. Food Research International, 2021, 144: 110328.
[26] ZHANG P P, BADONI M, GÄNZLE M, YANG X Q. Growth ofspp. isolated from chilled vacuum-packaged meat under relevant acidic conditions. International Journal of Food Microbiology, 2018, 286: 120-127.
[27] MA K, ZHAO H X, ZHANG C, LU Y, XING X H. Impairment of NADH dehydrogenase for increased hydrogen production and its effect on metabolic flux redistribution in wild strain and mutants of. International Journal of Hydrogen Energy, 2012, 37(21): 15875-15885.
[28] WICKRAMASINGHE N N, RAVENSDALE J, COOREY R, DYKES G A, CHANDRY P S. Transcriptional profiling of biofilms formed on chilled beef by psychrotrophic meat spoilage bacterium,1793. Biofilm, 2021, 3: 100045.
[29] FROST I, SMITH W P J, MITRI S, MILLAN A S, DAVIT Y, OSBORNE J M, PITT-FRANCIS J M, MACLEAN R C, FOSTER K R. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME Journal, 2018, 12(6): 1582-1593.
[30] MITRI S, CLARKE E, FOSTER K R. Resource limitation drives spatial organization in microbial groups. The ISME Journal, 2016, 10(6): 1471-1482.
[31] NG J, KIDD S P. The concentration of intracellular nickel inis linked to its surface properties and cell-cell aggregation and biofilm formation. International Journal of Medical Microbiology, 2013, 303(3): 150-157.
[32] BOVE P, CAPOZZI V, GAROFALO C, RIEU A, SPANO G, FIOCCO D. Inactivation of thegene ofWCFS1: Effects on growth, stress tolerance, cell surface properties and biofilm formation. Microbiological Research, 2012, 167(4): 187-193.
[33] ASHRAFUDOULLA M, MIZAN M F R, HA A J W, PARK S H, HA S D. Antibacterial and antibiofilm mechanism of eugenol against antibiotic resistance. Food Microbiology, 2020, 91: 103500.
[34] WICKRAMASINGHE N N, RAVENSDALE J T, COOREY R, DYKES G A, SCOTT CHANDRY P.characterisation of biofilms formed by psychrotrophic meat spoilage pseudomonads. Biofouling, 2019, 35(8): 840-855.
[35] YAN J, NADELL C D, STONE H A, WINGREEN N S, BASSLER B L. Extracellular-matrix-mediated osmotic pressure drivesbiofilm expansion and cheater exclusion. Nature Communications, 2017, 8(1): 1-11.
[36] NADELL C D, DRESCHER K, WINGREEN N S, BASSLER B L. Extracellular matrix structure governs invasion resistance in bacterial biofilms. The ISME Journal, 2015, 9(8): 1700-1709.
[37] LIU F, SUN Z L, WANG F T, LIU Y W, ZHU Y Z, DU L H, WANG D Y, XU W M. Inhibition of biofilm formation and exopolysaccharide synthesis ofby phenyllactic acid. Food Microbiology, 2020, 86: 103344.
[38] SUN E. The regulation and characterization of surfing motility in[D]. Vancouver: University of British Columbia, 2019.
[39] EVANS C R, KEMPES C P, PRICE-WHELAN A, DIETRICH L E P. Metabolic heterogeneity and cross-feeding in bacterial multicellular systems. Trends in Microbiology, 2020, 28(9): 732-743.
[40] FLEMMING H C, WINGENDER J. The biofilm matrix. Nature Reviews Microbiology, 2010, 8(9): 623-633.
[41] RATHER M A, GUPTA K, BARDHAN P, BORAH M, SARKAR A, ELDIEHY K S H, BHUYAN S, MANDAL M. Microbial biofilm: A matter of grave concern for human health and food industry. Journal of Basic Microbiology, 2021, 61(5): 380-395.
[42] WANG Y Y, HONG X L, LIU J C, ZHU J L, CHEN J R. Interactions between fish isolatesandin dual-species biofilms and sensitivity to carvacrol. Food Microbiology, 2020, 91: 103506.
[43] WAGNER E M, FISCHEL K, RAMMER N, BEER C, PALMETZHOFER A L, CONRADY B, ROCH F F, HANSON B T, WAGNER M, RYCHLI K. Bacteria of eleven different species isolated from biofilms in a meat processing environment have diverse biofilm forming abilities. International Journal of Food Microbiology, 2021, 349: 109232.
[44] WU Y J, MA F, PANG X Y, CHEN Y P, NIU A J, TAN S, CHEN X, QIU W F, WANG G Y. Involvement of AprD in regulating biofilm structure, matrix secretion, and cell metabolism of meat-borneduring chilled storage. Food Research International, 2022, 157: 111400.
[45] ZHAO Y N, REN J M, JIANG H Y, CHEN X F, XU M D, LI Y, ZHAO J Y, CHEN D, ZHANG K, LI H, LIU H. Metabolomics and lipidomics analyses delineating Hfq deletion-induced metabolic alterations in. Aquaculture, 2021, 535: 736349.
[46] ZHANG W, GAO H L, HUANG Y M, WU S Q, TIAN J T, NIU Y N, ZOU C J, JIA C F, JIN M F, HUANG J, CHANG Z Y, YANG X X, JIANG D M. Glutamine synthetase geneplays a vital role in curdlan biosynthesis ofsp. CGMCC 11546. International Journal of Biological Macromolecules, 2020, 165: 222-230.
[47] WANG N, GAO J, YUAN L, JIN Y J, HE G Q. Metabolomics profiling during biofilm development ofisolated from milk powder. International Journal of Food Microbiology, 2021, 337: 108939.
[48] ZHANG H, LIU J M, WEN R, CHEN Q, KONG B H. Metabolomics profiling reveals defense strategies ofR1 isolated from Harbin dry sausages under oxidative stress. LWT, 2021, 135: 110041.
[49] LI F, ZHU L Z. Surfactant-modified fatty acid composition ofsp. SA01 and its effect on phenanthrene transmembrane transport. Chemosphere, 2014, 107: 58-64.
[50] WANG Y B, WANG F F, ZHANG X S, CEN C N, FU L L. Transcription factors FabR and FadR regulate cold adaptability and spoilage potential of. International Journal of Food Microbiology, 2020, 331: 108693.
[51] OREŠIČ M. Informatics and computational strategies for the study of lipids. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2011, 1811(11): 991-999.
[52] GAUCHER F, RABAH H, KPONOUGLO K, BONNASSIE S, POTTIER S, DOLIVET A, MARCHAND P, JEANTET R, BLANC P, JAN G. Intracellular osmoprotectant concentrations determinesurvival during drying. Applied Microbiology and Biotechnology, 2020, 104(7): 3145-3156.
[53] HAN J, MENG J, CHEN S Y, LI C. Integrative analysis of the gut microbiota and metabolome in rats treated with rice straw biochar by 16S rRNA gene sequencing and LC/MS-based metabolomics. Scientific Reports, 2019, 9: 17860.
[54] CHEN H, FUJITA M, FENG Q H, CLARDY J, FINK G R. Tyrosol is a quorum-sensing molecule in. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(14): 5048-5052.
[55] YU W C, CHEN Z, YE H, LIU P Z, LI Z P, WANG Y P, LI Q B, YAN S, ZHONG C J, HE N. Effect of glucose on poly-γ-glutamic acid metabolism in. Microbial Cell Factories, 2017, 16(1): 22.
[56] YU Y Y, YAN F, CHEN Y, JIN C, GUO J H, CHAI Y R. Poly-γ-glutamic acids contribute to biofilm formation and plant root colonization in selected environmental isolates of. Frontiers in Microbiology, 2016, 7: 1811.
[57] ZHAO X, CHEN L, WU J E, HE Y, YANG H S. Elucidating antimicrobial mechanism of nisin and grape seed extract againstin broth and on shrimp through NMR-based metabolomics approach. International Journal of Food Microbiology, 2020, 319: 108494.
[58] 刘苗苗. 基于转录组学和代谢组学解析柿单宁对食源性耐甲氧西林金黄色葡萄球菌的抑菌机理[D]. 杨凌: 西北农林科技大学, 2019.
LIU M M. Analysis of the antibacterial mechanism of persimmon tannin against food borne methicillin-resistantbased on transcriptome and metabolomics [D]. Yangling: Northwest A & F University, 2019. (in Chinese)
[59] SAYÉ M, MIRANDA M R, DI GIROLAMO F, DE LOS MILAGROS CÁMARA M, PEREIRA C A. Proline modulates theresistance to reactive oxygen species and drugs through a novel D, L-proline transporter. PLoS ONE, 2014, 9(3): e92028.
Effects ofon the Biofilm Formation and Cellular Metabolism of Meat-BorneDuring Chilled Storage
WU YaJie1, TAN Song1, CHEN YuPing1, NIU AJuan1, LIU YuXin1, WANG GuangYu, XU XingLian2, QIU WeiFen1
1College of Food Science and Engineering/Collaborative Innovation Center for Modern Grain Circulation and Safety, Nanjing University of Finance and Economics, Nanjing 210023;2College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095
【Objective】This paper focused on the impacts ofon the biofilm formation and cell metabolism in(), so as to further reveal the regulatory mechanism ofin the spoilage of chilled meat contaminated withand to provide a theoretical basis for developing effective preservation system of chilled meat. 【Method】NMC25 and its-mutant strain were used in the present study, and the differences in the spatial structure of biofilms were observed by confocal laser scanning microscopy (CLSM). The changes in biofilm composition were tested by the cell enumeration and the analysis of the extracellular polymeric substances. In addition, theultra-high performance liquid chromatography coupled with mass spectrometry (UHPLC-MS/MS) was employed to investigate the alterations of-related metabolite abundance. 【Result】CLSM images showed that cells in the biofilms of wild-type strains cultivatedwas highly dense, nematic ordering, whereas Δdisplayed relatively disorganized and sparse arrangement. Additionally, cell enumeration revealed insignificant differences between the wild-type and mutant biofilms regardless of the difference of culture medium. The result indicated thatthe mutants did not change significantly in their ability to grow as biofilm on the surface of TSA or meat sample.For extracellular polymeric substances from biofilms, the protein and carbohydrate contents of Δwere significantly higher (<0.01,<0.05, respectively) than those of wild-type strains,indicating thataffected the secretion of extracellular polymers by.The metabolomics results revealed a clear separation between the wild and mutant groups in an orthogonal partial least squares discriminant analysis model (2X=0.481,2Y=0.977, Q2=0.909), which suggested that the metabolites of the mutants had changed markedly. In the model, differentially expressed metabolites were screened, including 2-hydroxycinnamic acid, L-tyrosine, L-phenylalanine, DL-tryptophan, 17(S)-HETE, and 5-OxoETE. Pathway mapping analysis was conducted based on the chosen candidates. In total, the major metabolic pathways included fatty acid biosynthesis, unsaturated fatty acid biosynthesis, riboflavin metabolism, 2-oxocarboxylic acid metabolism, purine metabolism, cyanogenic amino acid metabolism, and phenylalanine metabolism. 【Conclusion】The disruption ofstimulated significant variations in the spatial structure of thebiofilm grown, promoting the biosynthesis of extracellular polymeric substances and affecting intracellular metabolic pathways, such as carbon, nucleotide, lipid, and amino acid metabolism.
;; biofilm; extracellular polymeric substances; cell metabolism
2022-10-25;
2022-12-21
国家自然科学基金(31901759)、江苏高校优势学科建设工程资助项目(PAPD)
吴亚婕,E-mail:W1270316335@163.com。通信作者王光宇,E-mail:gywang@nufe.edu.cn
10.3864/j.issn.0578-1752.2023.11.011
(责任编辑 赵伶俐)

