腹腔镜直肠癌全系膜切除术后排尿功能障碍的危险因素分析
李朝剑, 芶 勇, 蔡美煌, 谢 宇
(1. 四川省彭州市中医医院 胃肠/胸外科, 四川 彭州, 611930;2. 四川省中西医结合医院 骨科, 四川 成都, 610000)
直肠癌是常见的消化系统恶性肿瘤,具有较高的发病率,患病人群主要集中在中老年人群[1]。近年来,中国直肠癌的发病情况呈逐年上升化、年轻化的趋势,这可能是由脂肪摄入量不断上升造成的[2]。研究[3]表明不良的饮食习惯和错误的饮食结构是导致直肠癌发生的重要原因。腹腔镜手术因具有创伤小、术后疼痛轻、术后恢复快等优点而被广泛应用于临床治疗,腹腔镜直肠癌全系膜切除术结合了微创手术的优越性,因此被定义为直肠癌手术治疗的金标准[4-5]。然而,患者术后排尿功能障碍等相关并发症会给手术的治疗效果及术后恢复造成不良影响[6]。本研究分析腹腔镜直肠癌全系膜切除术后排尿功能障碍的危险因素,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年10月—2022年10月收治的92例直肠癌患者的临床资料,其中男49例,女43例,年龄33~71岁,平均(56.73 ±7.68)岁,平均体质量指数(BMI)为(24.74±3.35) kg/m2。采用随机数字法将患者以3∶1的比例分为训练集69例和验证集23例,分别用于构建术后排尿功能障碍的预测模型和模型验证。训练集患者平均年龄(56.34±7.25)岁,平均BMI为(24.98±3.51) kg/m2, 根据术后膀胱残余尿量情况又分为排尿功能障碍组22例和排尿功能正常组47例。验证集患者平均年龄(57.12±7.81)岁,平均BMI为(24.50±3.11) kg/m2。训练集与验证集患者一般资料比较,差异无统计学意义(P>0.05)。纳入标准: ① 符合直肠癌诊断标准者[7]; ② 采用腹腔镜直肠癌全系膜切除术治疗者; ③ 术前排尿功能正常者。排除标准: ① 中转开腹的患者; ② 合并其他恶性肿瘤的患者; ③ 肿瘤远端转移并侵犯临近脏器的患者。
1.2 方法
1.2.1 手术方法: 手术采取传统5孔法进行,即脐上(观察孔),左、右腹直肌外(操作孔),左侧麦氏点(牵引结肠)以及右侧麦氏点处(主操作孔); 建立人工气腹,根据直肠癌全系膜切除术原则分离肠系膜,期间注意保护神经丛和输尿管,将Denonvilliers筋膜与肿瘤病灶全部切除,切除范围不低于肿瘤远端直肠系膜5 cm。
1.2.2 观察指标: 收集患者的一般资料,包括性别、年龄、BMI、病程、是否患有高血压及糖尿病,术前是否进行放疗、是否存在淋巴结转移、直肠前壁分离,同时记录肿瘤位置、肿瘤直径、病理类型、病理分期、淋巴结切除数量、盆腔自主神经受损情况、手术方式、术中视野、出血量、手术时间、术后拔尿管时间以及是否发生吻合口瘘。
1.2.3 排尿功能评价: 术后2周时,依据膀胱残余尿量评估患者排尿功能[8]。残余尿量<50 mL为排尿功能正常,残余尿量≥50 mL为排尿功能障碍。
1.3 统计学分析
采用SPSS 23.0统计软件进行数据分析,计量资料以均数±标准差表示,组间比较采用t检验; 计数资料采用[n(%)]表示,组间比较采用χ2检验。采用多因素Logistic回归模型确定患者术后排尿功能障碍的独立风险预测因子。构建列线图模型,采用受试者工作特征(ROC)曲线和校准曲线对列线图预测模型进行检验。采用递归分割分析(RPA)法建立危险分层系统,并通过不同手术方式进行亚组分析。在不同手术方式内,采用Kaplan-Meier法绘制排尿功能障碍发生率曲线,并采用Log-rank检验对排尿功能障碍发生率曲线进行比较。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料比较
训练集69例患者中, 22例(31.88%)术后排尿功能障碍; 分析结果显示,术后排尿功能障碍与性别、年龄、糖尿病、术前放疗、肿瘤位置、淋巴结切除数量、盆腔自主神经受损情况、手术方式有相关性(P<0.05)。见表1。

表1 训练集中排尿功能障碍与正常患者的临床资料的单因素分析
2.2 多因素分析
将单因素分析中有统计学意义的指标纳入多因素分析,结果显示性别、年龄、糖尿病、术前放疗、肿瘤位置、淋巴结切除数量、盆腔自主神经受损情况、手术方式均是患者术后排尿功能障碍的独立影响因素(P<0.05), 见表2。

表2 多因素Logistic回归分析
2.3 模型构建
将多因素Logistic回归分析中有统计学意义的变量纳入列线图预测模型,通过每个变量对应得分,计算个体风险评分总分,并预测个体患者术后排尿功能障碍发生概率,见图1。例如,某例患者为男性、年龄>55岁、未合并糖尿病、术前未接受放疗、肿瘤位置为低位、淋巴结切除数量较少、盆腔自主神经受损、手术方式为Dixon术,对应的总分为18+15+0+0+52+0+79+0=164分,列线图风险预测值约为78%。

图1 列线图预测模型
2.4 模型评价
2.4.1 区分度评价: 训练集和验证集的曲线下面积(AUC)分别为0.843(95%CI: 0.788~0.898,P<0.001)和0.801(95%CI: 0.740~0.862,P<0.001), 曲线的特异度分别为92.94%、92.56%, 敏感度分别为92.37%、91.86%, 表明本模型的区分度良好,见图2。
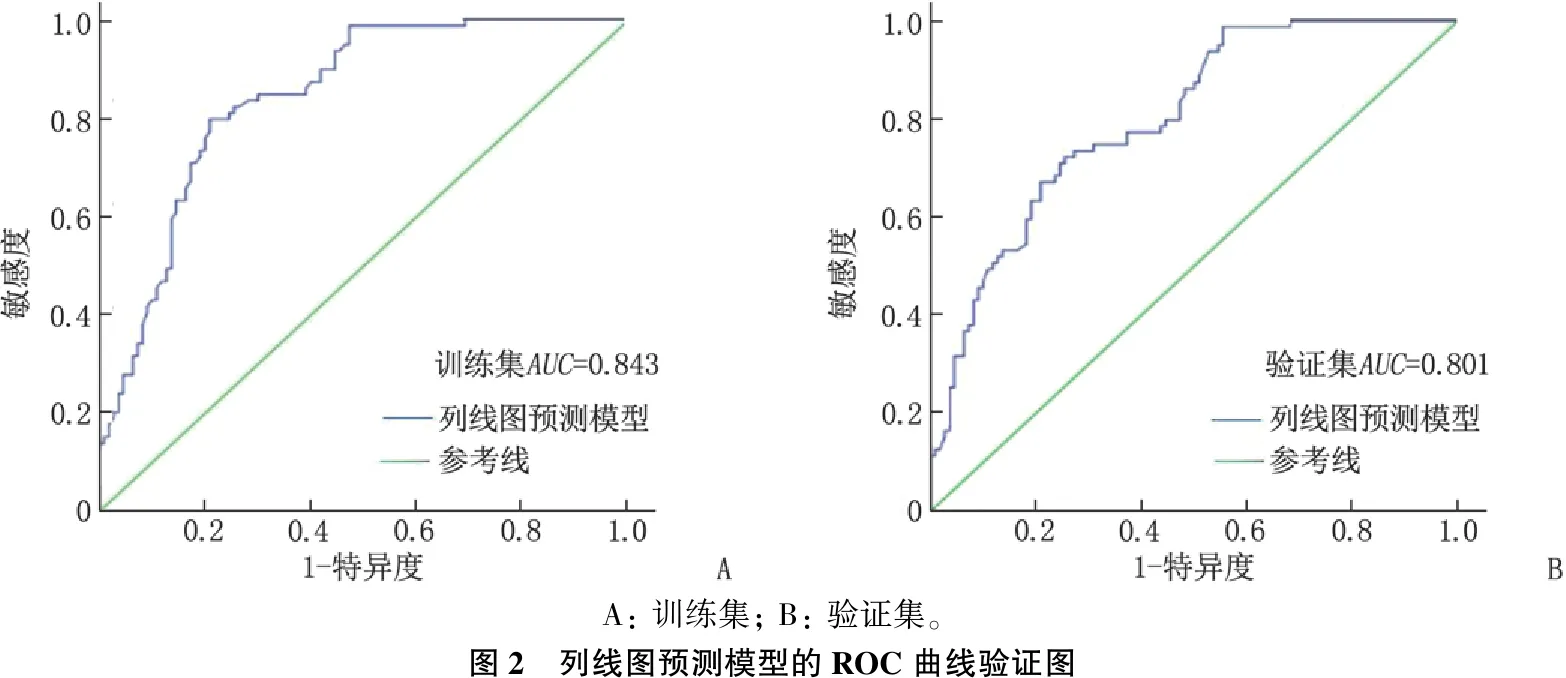
A: 训练集; B: 验证集。图2 列线图预测模型的ROC曲线验证图
2.4.2 校准度评价: 绘制校正曲线,结果显示训练集和验证集的一致性指数(C-index)分别为0.896(95%CI: 0.841~0.944,P<0.001)和0.874(95%CI: 0.819~0.923,P<0.001), 见图3。
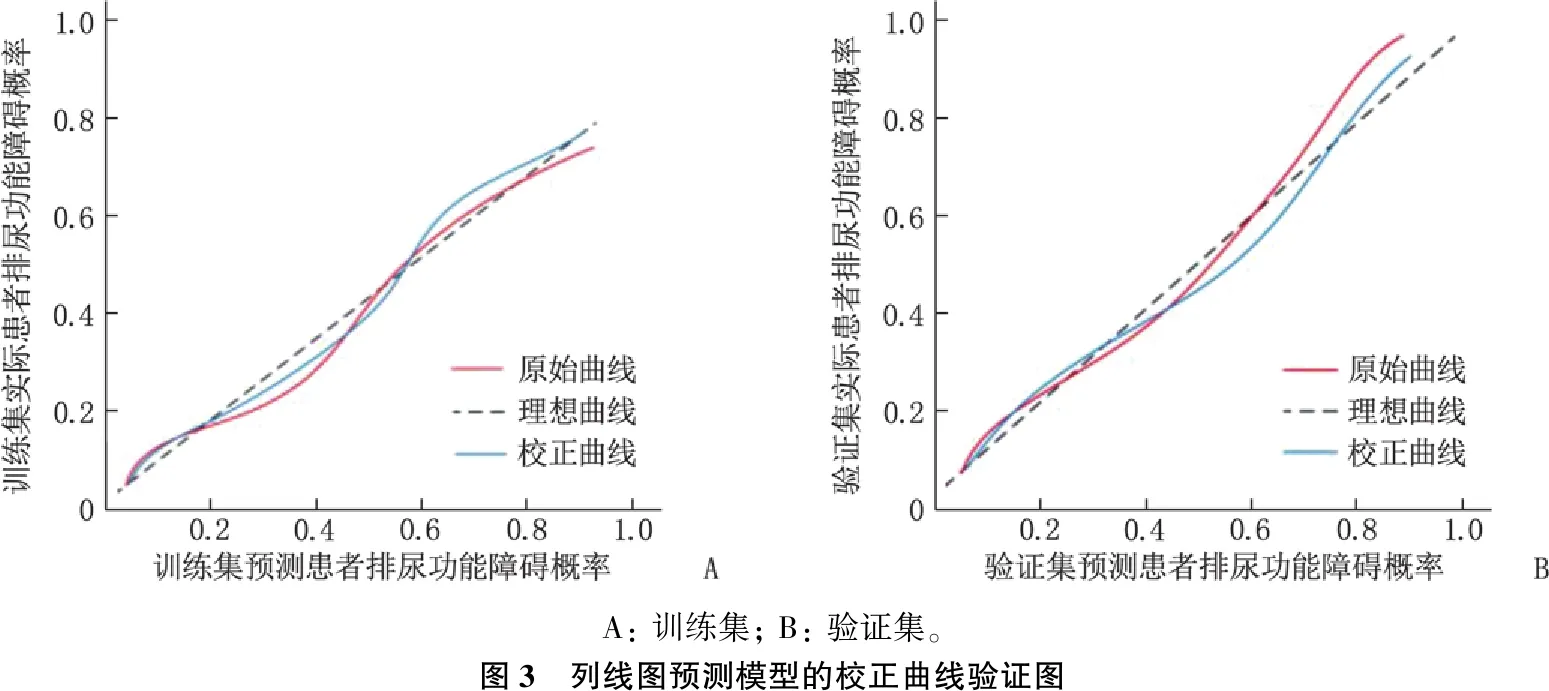
A: 训练集; B: 验证集。图3 列线图预测模型的校正曲线验证图
2.5 危险分层系统
采用RPA以产生树型结构模型,树形算法在建模队列中展开,将所有患者分为4个危险分组: 极低风险组(总分<138分)、低风险组(总分138~<216分)、中风险组(总分216~<274分)和高风险组(总分≥274分),见图4。在不同手术方式中验证该危险分层系统,结果显示在2种手术方式内,该危险分层系统均能对患者术后排尿功能障碍概率进行区分(P<0.05), 见图5。

图4 RPA将患者进行危险分层
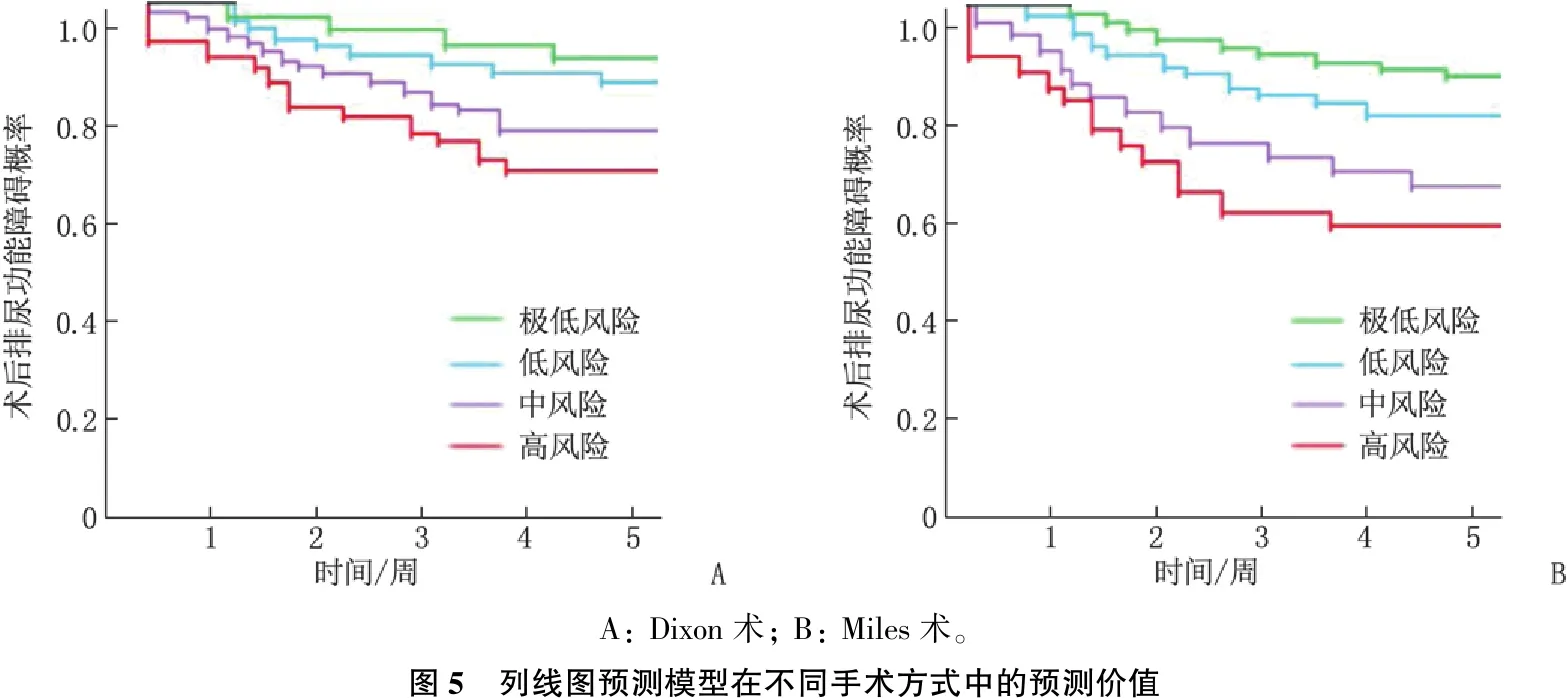
A: Dixon术; B: Miles术。图5 列线图预测模型在不同手术方式中的预测价值
3 讨 论
直肠癌的发生发展与不健康的生活方式、不良饮食习惯、肥胖及遗传等因素密切相关[9], 其早期临床症状不明显,当发生肿瘤感染或破裂时,会出现便血等临床表现[10]。若不及时接受手术治疗,会严重威胁患者的身体健康和生命安全。腹腔镜直肠癌全系膜切除术是目前临床上治疗直肠癌的首选方案[11], 但术后极易引发排尿功能障碍等并发症,而长期排尿功能障碍则会引起患者肾脏病变,不利于患者术后康复[12]。
本研究结果显示,性别、年龄、是否患有糖尿病、术前是否进行放疗、肿瘤位置、淋巴结切除数量、盆腔自主神经受损情况、手术方式均是影响患者术后排尿功能障碍的独立危险因素。与女性盆腔相比,男性盆腔更狭窄,且盆丛神经更接近直肠,手术操作难度更大,术中造成盆丛神经损伤的风险更高,因而术后排尿功能障碍的发生率高于女性[13-14]。随着患者年龄的增长,机体排尿功能发生退行性改变,从而导致术后排尿功能障碍的发生率上升,同时高龄患者免疫力减弱,术后发生并发症的概率更高[15]。有研究[16-19]指出,合并糖尿病的直肠癌患者术后发生排尿功能障碍的风险明显升高,其原因可能是糖尿病造成的机体高血糖状态容易对盆腔神经组织造成损伤,降低盆腔自主神经敏感性,而盆腔自主神经受损又会造成患者排尿感知减退,是导致患者术后排尿功能障碍的主要原因。研究[20-22]表明,放疗会导致膀胱、前列腺、尿道括约肌等组织纤维化,对患者排尿功能产生不良影响。术中淋巴结清扫数量多、范围大也是导致盆腔自主神经损伤的重要原因[23]。肿瘤位置也是影响患者术后排尿功能的重要因素,肿瘤位置越低,手术切除范围越靠近盆底,对盆丛神经造成损伤的可能性越大,同时肿瘤位置也是决定手术方式的重要因素,肿瘤位置距离肛缘较远的患者一般可以采用Dixon术进行保肛治疗,以减轻对盆腔自主神经的损伤[24-25]。与Miles术相比, Dixon术可较好地保留完整肛管、会阴,对患者排尿反射系统影响较小,尽可能减少对盆腔自主神经功能的损伤,以降低排尿功能障碍的发生率[26-28]。
本研究在单因素、多因素分析的基础上,针对上述危险因素建立列线图预测模型。ROC曲线以及校准曲线分析结果显示,该预测模型的区分度和准确度均较高,可为临床预测患者术后排尿功能障碍情况提供帮助。危险分层系统将所有患者分为4个危险分组,即极低风险组(总分<138分)、低风险组(总分138~<216分)、中风险组(总分216~<274分)和高风险组(总分≥274分)。不同手术方式对危险分层系统区分度的验证结果显示,该危险分层系统区分度良好,对预测患者术后排尿功能障碍有积极作用,并且对临床上采取相应措施保护患者正常的排尿功能具有一定的指导作用。
本研究也有不足之处,例如影响直肠癌全系膜切除患者术后排尿功能障碍的因素较多,本研究纳入的影响因素尚不全面,得到的结果也可能因为样本量不足而产生偏差,还需扩大样本量并纳入更多的可能影响因素以进行更为全面的分析。
综上所述,性别、年龄、是否患有糖尿病、术前是否进行放疗、肿瘤位置、淋巴结切除数量、盆腔自主神经受损情况、手术方式是腹腔镜直肠癌全系膜切除术后排尿功能障碍的影响因素。本研究建立的列线图预测模型能有效预测直肠癌全系膜切除患者术后排尿功能障碍的情况,且基于该模型的危险分层系统对区分患者术后排尿功能障碍情况具有一定的临床价值。

